高中化学 人教版(2019) 选择性必修2 第三章 第二节 第2课时 共价晶体 课件 (共32张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修2 第三章 第二节 第2课时 共价晶体 课件 (共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 09:53:57 | ||
图片预览




文档简介
(共32张PPT)
共价晶体(二)
人教版 选择性必修2
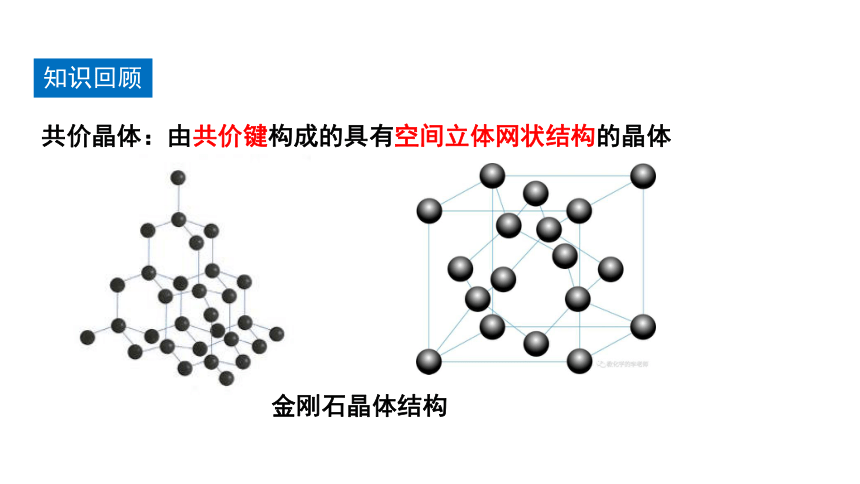
知识回顾
共价晶体:由共价键构成的具有空间立体网状结构的晶体
金刚石晶体结构
除了金刚石、晶体硅以外,还有这些常见共价晶体
二氧化硅 (SiO2)
碳化硅 (SiC)
氮化硼 (BN)
氮化硅 (Si3N4)等
思考讨论
知识拓展
自然界含量最高的固态二元氧化物,熔点1713℃
有多种结构,最常见的是低温石英(α-SiO2)
海滩河岸边的黄沙、石英矿脉、花岗石中的白色晶体以及透明的水晶都是低温石英。
应用广泛的高科技产品原料---二氧化硅(SiO2)
资料卡片
二氧化硅(SiO2)
晶体硅结构
已知SiO2晶体骨架结构与晶体硅相似,根据SiO2中Si元素和O元素的比例,你能否在晶体硅的骨架结构基础上将O原子合理地填充进去以形成SiO2 骨架结构?
√
思考讨论
SiO
SiO2
SiO4
二氧化硅(SiO2)
晶体硅结构
二氧化硅晶体结构
二氧化硅(SiO2)
(注意:以“O”为中心的“Si-O”键的夹角不是180度)
知识迁移
正四面体结构
晶体硅中硅原子采取sp3杂化
二氧化硅晶体中硅原子采取sp3杂化
二氧化硅(SiO2)
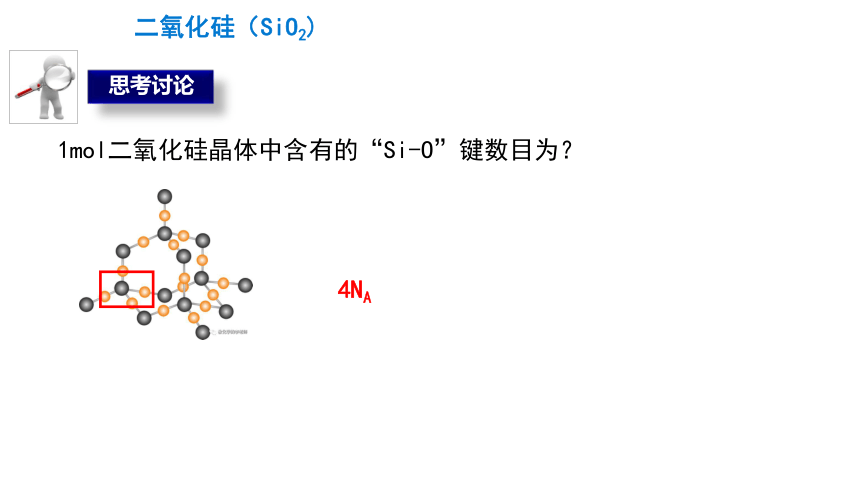
1mol二氧化硅晶体中含有的“Si-O”键数目为?
4NA
思考讨论
二氧化硅(SiO2)
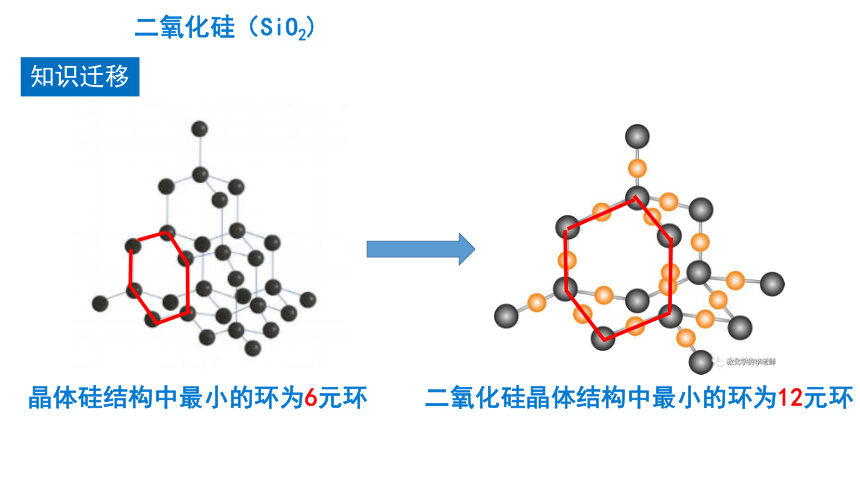
晶体硅结构中最小的环为6元环
二氧化硅晶体结构中最小的环为12元环
知识迁移
二氧化硅(SiO2)
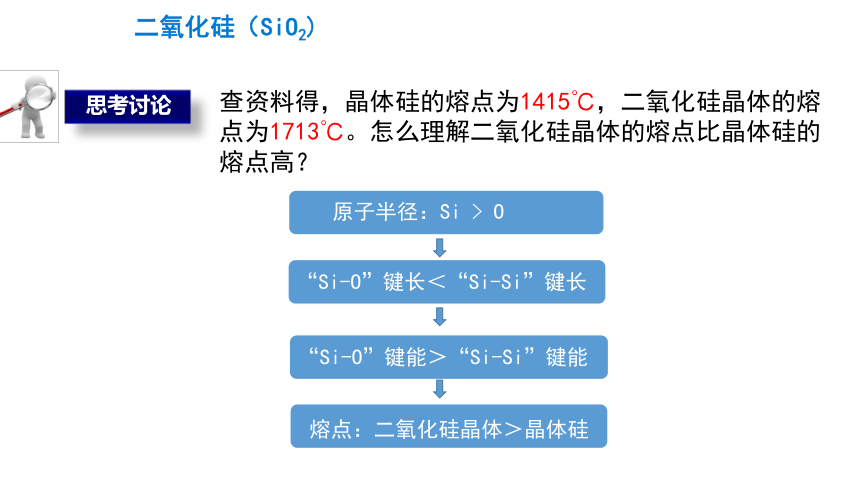
查资料得,晶体硅的熔点为1415℃,二氧化硅晶体的熔点为1713℃。怎么理解二氧化硅晶体的熔点比晶体硅的熔点高?
熔点:二氧化硅晶体>晶体硅
“Si-O”键能>“Si-Si”键能
“Si-O”键长<“Si-Si”键长
原子半径:Si > O
思考讨论
二氧化硅(SiO2)
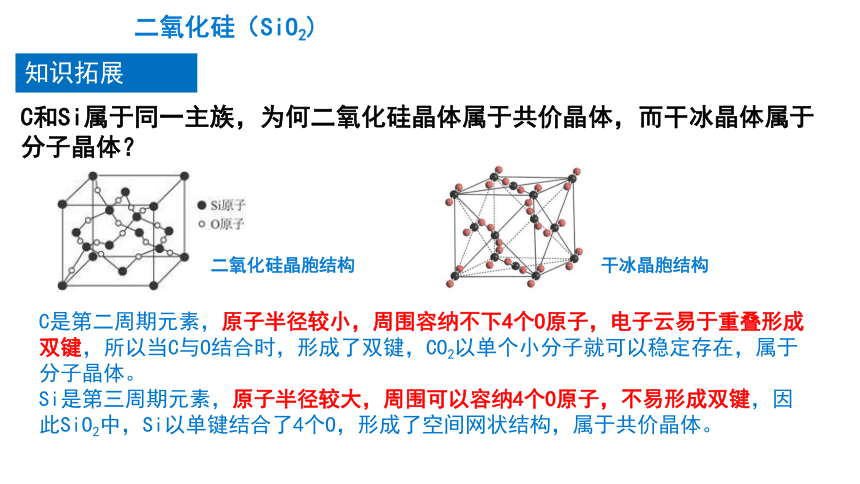
C和Si属于同一主族,为何二氧化硅晶体属于共价晶体,而干冰晶体属于分子晶体?
知识拓展
C是第二周期元素,原子半径较小,周围容纳不下4个O原子,电子云易于重叠形成双键,所以当C与O结合时,形成了双键,CO2以单个小分子就可以稳定存在,属于分子晶体。
Si是第三周期元素,原子半径较大,周围可以容纳4个O原子,不易形成双键,因此SiO2中,Si以单键结合了4个O,形成了空间网状结构,属于共价晶体。
干冰晶胞结构
二氧化硅晶胞结构
二氧化硅(SiO2)
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
(一)该二氧化碳晶体属于分子晶体还是共价晶体?
该二氧化碳晶体与二氧化硅晶体结构相似,且具备高熔点、高硬度特征,属于典型的共价晶体
思考讨论
二氧化硅(SiO2)
(二)1mol该二氧化碳晶体中含有的“C-O”键数目为?
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
4NA
思考讨论
二氧化硅(SiO2)
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
(三)该二氧化碳晶体的熔点、硬度与二氧化硅晶体相比如何?
“C-O”键长 < “Si-O”键长
“C-O”键能 >“Si-O”键能
熔点、硬度:该二氧化碳晶体>二氧化硅晶体
原子半径: C < Si
思考讨论
二氧化硅(SiO2)
二氧化硅的用途
单晶硅 硅芯片 硅太阳能电池 二氧化硅光导纤维
(以SiO2为原料制造的高科技产品)
资料卡片
二氧化硅(SiO2)
SiC器件的主要用途是车载设备。SiC器件可以使纯电动汽车、混合动力车的电机控制系统损失的功率降低到1/10,实现低功耗化;同时,能将新能源汽车的效率提高10%,使用SiC工艺生产的功率器件的导通电阻更低、芯片尺寸更小、工作频率更高
,并可耐受更高的环境温度
SiC 的球棍模型
新能源汽车中的明星材料---碳化硅(SiC)
资料卡片
碳化硅(SiC)
碳化硅(SiC)
SiC 的球棍模型
SiC俗称“金刚砂”,类似于金刚石的构造。已知SiC晶体中只存在“Si-C”共价键,根据SiC中Si元素和C元素的比例,你能否在金刚石晶体的结构基础上将C原子和Si原子标示出来?
Si
C
或
金刚石晶体
思考讨论
SiC晶胞结构
碳化硅(SiC)
碳化硅(SiC)
原子半径: C < Si
“C-C” 键长<“Si-C”键长<“Si-Si”键长
硬度、熔点:金刚石晶体>碳化硅晶体>晶体硅
“C-C” 键能>“Si-C”键能>“Si-Si”键能
立方氮化硼晶体结构与金刚石相似,它有可能在哪些领域具有广泛的应用前景?
熔点高
硬度大
产品坚硬,可制成高速切削刀具、地质勘探、石油钻头
可以制造高温构件、火箭燃烧室内衬、宇宙飞船的热屏蔽等
性能优异的陶瓷材料—氮化硼(BN)
(一)立方氮化硼
氮化硼(BN)
立方氮化硼晶体结构与金刚石相似,已知BN晶体中只存在“B-N”共价键,根据BN中B元素和N元素的比例,你能否在金刚石晶胞的结构基础上画出BN的晶胞结构示意图?
金刚石晶胞结构
BN晶胞结构
思考讨论
氮化硼(BN)
(二)六方氮化硼
六方氮化硼的晶体为平面六元并环的层状结构
氮化硼(BN)
知识拓展
1.六方氮化硼晶体结构中B、N原子采取哪种类型的轨道杂化方式?
因六方氮化硼晶体为平面六元并环结构,故B、N原子均采用sp2杂化方式
思考讨论
氮化硼(BN)
3. 六方氮化硼的晶体的层状结构之间并不存在化学键的作用,那它属于共价晶体吗?
不属于。层与层之间没有共价键作用,即构成不了空间立体网状结构,故不属于共价晶体
思考讨论
氮化硼(BN)
六方氮化硼用途
(一)绝缘性
广泛应用于高压高频电及等离子弧的绝缘体以及各种加热器的绝缘子,加热管套管和高温、高频、高压绝缘散热部件,高频应用电炉的材料
(二)热导性
用作制备砷化镓、磷化镓、磷化铟的坩锅,半导体封装散热底板、移相器的散热棒,行波管收集极的散热管,半导体和集成电极的p型扩散源和微波窗口
(后期在学习“混合型晶体”中石墨部分知识时可进行对比分析)
资料卡片
氮化硼(BN)
课堂小结
二氧化硅晶胞结构
碳化硅晶胞结构
氮化硼晶胞结构
①每个Si周围有4个O
Si的杂化轨类型是sp3
②Si原子与Si-O键之比为1:4
③最小环为12元环。
“金刚砂”,它具有类似金刚石的结构和性质,其空间结构中碳原子和硅原子相间排列,化学式为 SiC。
①立方氮化硼晶体结构与金刚石相似
硬度大 熔点高
②六方氮化硼的晶体为平面六元并环的层状结构
B、N原子均采用sp2杂化方式
不属于共价晶体
1.下列说法中,错误的是( )
A. 只含分子的晶体一定是分子晶体
B. 碘晶体升华时破坏了共价键
C. 几乎所有的酸都属于分子晶体
D. 稀有气体分子中只含原子,但稀有气体的晶体属于分子晶体
课堂练习
2.下列说法中,正确的是( )
A. 分子晶体一定存在分子间作用力和共价键
B. 分子晶体的熔点一般比共价晶体的熔点高
C. 稀有气体形成的晶体属于分子晶体
D. CO2 晶体是分子晶体,可推测 SiO2 晶体也是分子晶体
课堂练习
3.下列说法中,正确的是( )
冰融化时,分子中 H-O 键发生断裂
共价晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 分子晶体中,分子间作用力越大,对应的物质越稳定
课堂练习
4.下列事实能说明刚玉(Al2O3)是共价晶体的是( )
①Al2O3 是两性氧化物;
②硬度很大;
③它的熔点是 2045 ℃;
④自然界中的刚玉有红宝石和蓝宝石
A. ①② B. ②③ C. ①④ D. ③④
课堂练习
5.以下晶体是共价晶体还是分子晶体?
金刚石 干冰 冰 可燃冰 硫磺 C60 碘 石英 白磷(P4) 苯甲酸 金刚砂(SiC) 稀有气体的晶体 氧气的晶体 氮气的晶体
课堂练习
参考答案
1.B 2.C. 3.B 4.C
5.
分子晶体 干冰、冰、可燃冰、硫磺、C60、碘 、 白磷(P4)、苯甲酸 、稀有气体的晶体 、氧气的晶体、氮气的晶体
共价晶体 金刚石、石英、金刚砂(SiC)
共价晶体(二)
人教版 选择性必修2
知识回顾
共价晶体:由共价键构成的具有空间立体网状结构的晶体
金刚石晶体结构
除了金刚石、晶体硅以外,还有这些常见共价晶体
二氧化硅 (SiO2)
碳化硅 (SiC)
氮化硼 (BN)
氮化硅 (Si3N4)等
思考讨论
知识拓展
自然界含量最高的固态二元氧化物,熔点1713℃
有多种结构,最常见的是低温石英(α-SiO2)
海滩河岸边的黄沙、石英矿脉、花岗石中的白色晶体以及透明的水晶都是低温石英。
应用广泛的高科技产品原料---二氧化硅(SiO2)
资料卡片
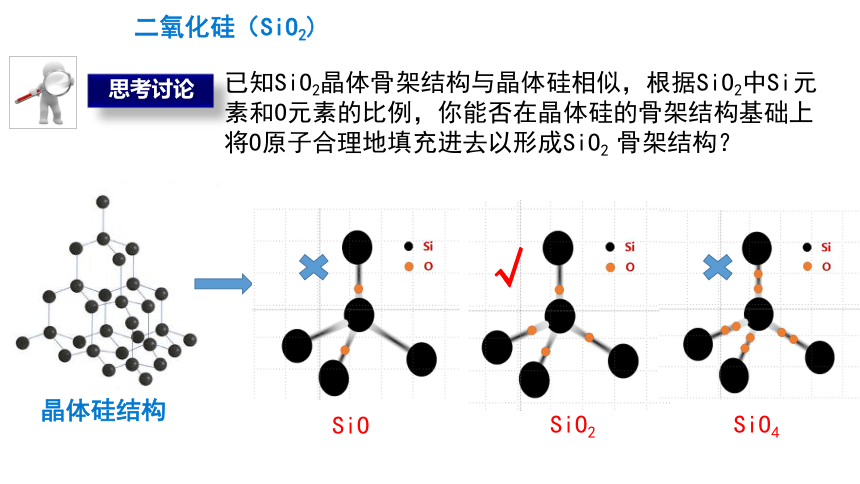
二氧化硅(SiO2)
晶体硅结构
已知SiO2晶体骨架结构与晶体硅相似,根据SiO2中Si元素和O元素的比例,你能否在晶体硅的骨架结构基础上将O原子合理地填充进去以形成SiO2 骨架结构?
√
思考讨论
SiO
SiO2
SiO4
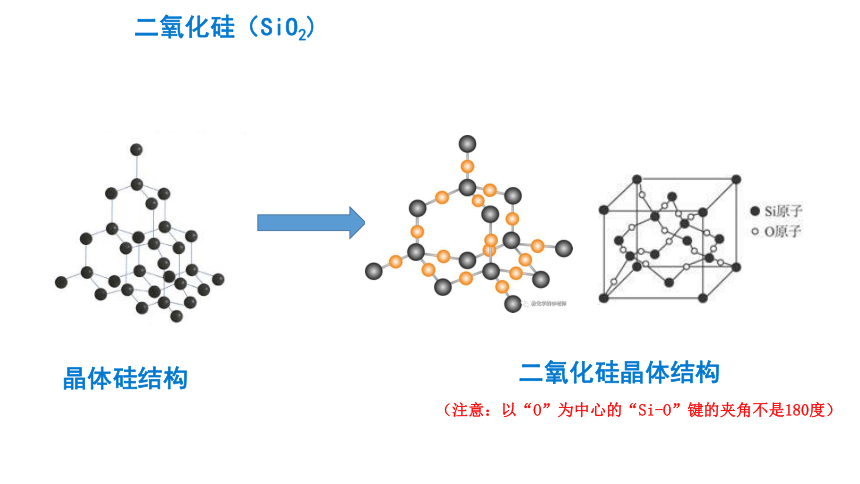
二氧化硅(SiO2)
晶体硅结构
二氧化硅晶体结构
二氧化硅(SiO2)
(注意:以“O”为中心的“Si-O”键的夹角不是180度)
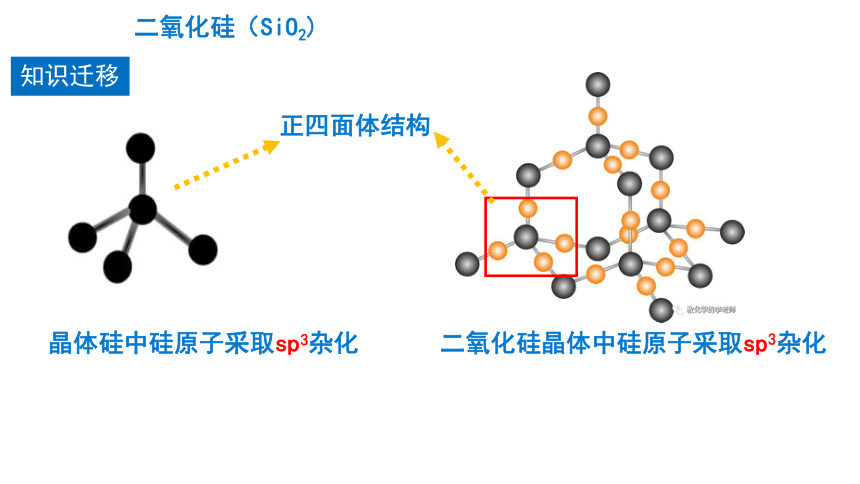
知识迁移
正四面体结构
晶体硅中硅原子采取sp3杂化
二氧化硅晶体中硅原子采取sp3杂化
二氧化硅(SiO2)
1mol二氧化硅晶体中含有的“Si-O”键数目为?
4NA
思考讨论
二氧化硅(SiO2)
晶体硅结构中最小的环为6元环
二氧化硅晶体结构中最小的环为12元环
知识迁移
二氧化硅(SiO2)
查资料得,晶体硅的熔点为1415℃,二氧化硅晶体的熔点为1713℃。怎么理解二氧化硅晶体的熔点比晶体硅的熔点高?
熔点:二氧化硅晶体>晶体硅
“Si-O”键能>“Si-Si”键能
“Si-O”键长<“Si-Si”键长
原子半径:Si > O
思考讨论
二氧化硅(SiO2)
C和Si属于同一主族,为何二氧化硅晶体属于共价晶体,而干冰晶体属于分子晶体?
知识拓展
C是第二周期元素,原子半径较小,周围容纳不下4个O原子,电子云易于重叠形成双键,所以当C与O结合时,形成了双键,CO2以单个小分子就可以稳定存在,属于分子晶体。
Si是第三周期元素,原子半径较大,周围可以容纳4个O原子,不易形成双键,因此SiO2中,Si以单键结合了4个O,形成了空间网状结构,属于共价晶体。
干冰晶胞结构
二氧化硅晶胞结构
二氧化硅(SiO2)
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
(一)该二氧化碳晶体属于分子晶体还是共价晶体?
该二氧化碳晶体与二氧化硅晶体结构相似,且具备高熔点、高硬度特征,属于典型的共价晶体
思考讨论
二氧化硅(SiO2)
(二)1mol该二氧化碳晶体中含有的“C-O”键数目为?
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
4NA
思考讨论
二氧化硅(SiO2)
有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。请思考以下问题
(三)该二氧化碳晶体的熔点、硬度与二氧化硅晶体相比如何?
“C-O”键长 < “Si-O”键长
“C-O”键能 >“Si-O”键能
熔点、硬度:该二氧化碳晶体>二氧化硅晶体
原子半径: C < Si
思考讨论
二氧化硅(SiO2)
二氧化硅的用途
单晶硅 硅芯片 硅太阳能电池 二氧化硅光导纤维
(以SiO2为原料制造的高科技产品)
资料卡片
二氧化硅(SiO2)
SiC器件的主要用途是车载设备。SiC器件可以使纯电动汽车、混合动力车的电机控制系统损失的功率降低到1/10,实现低功耗化;同时,能将新能源汽车的效率提高10%,使用SiC工艺生产的功率器件的导通电阻更低、芯片尺寸更小、工作频率更高
,并可耐受更高的环境温度
SiC 的球棍模型
新能源汽车中的明星材料---碳化硅(SiC)
资料卡片
碳化硅(SiC)
碳化硅(SiC)
SiC 的球棍模型
SiC俗称“金刚砂”,类似于金刚石的构造。已知SiC晶体中只存在“Si-C”共价键,根据SiC中Si元素和C元素的比例,你能否在金刚石晶体的结构基础上将C原子和Si原子标示出来?
Si
C
或
金刚石晶体
思考讨论
SiC晶胞结构
碳化硅(SiC)
碳化硅(SiC)
原子半径: C < Si
“C-C” 键长<“Si-C”键长<“Si-Si”键长
硬度、熔点:金刚石晶体>碳化硅晶体>晶体硅
“C-C” 键能>“Si-C”键能>“Si-Si”键能
立方氮化硼晶体结构与金刚石相似,它有可能在哪些领域具有广泛的应用前景?
熔点高
硬度大
产品坚硬,可制成高速切削刀具、地质勘探、石油钻头
可以制造高温构件、火箭燃烧室内衬、宇宙飞船的热屏蔽等
性能优异的陶瓷材料—氮化硼(BN)
(一)立方氮化硼
氮化硼(BN)
立方氮化硼晶体结构与金刚石相似,已知BN晶体中只存在“B-N”共价键,根据BN中B元素和N元素的比例,你能否在金刚石晶胞的结构基础上画出BN的晶胞结构示意图?
金刚石晶胞结构
BN晶胞结构
思考讨论
氮化硼(BN)
(二)六方氮化硼
六方氮化硼的晶体为平面六元并环的层状结构
氮化硼(BN)
知识拓展
1.六方氮化硼晶体结构中B、N原子采取哪种类型的轨道杂化方式?
因六方氮化硼晶体为平面六元并环结构,故B、N原子均采用sp2杂化方式
思考讨论
氮化硼(BN)
3. 六方氮化硼的晶体的层状结构之间并不存在化学键的作用,那它属于共价晶体吗?
不属于。层与层之间没有共价键作用,即构成不了空间立体网状结构,故不属于共价晶体
思考讨论
氮化硼(BN)
六方氮化硼用途
(一)绝缘性
广泛应用于高压高频电及等离子弧的绝缘体以及各种加热器的绝缘子,加热管套管和高温、高频、高压绝缘散热部件,高频应用电炉的材料
(二)热导性
用作制备砷化镓、磷化镓、磷化铟的坩锅,半导体封装散热底板、移相器的散热棒,行波管收集极的散热管,半导体和集成电极的p型扩散源和微波窗口
(后期在学习“混合型晶体”中石墨部分知识时可进行对比分析)
资料卡片
氮化硼(BN)
课堂小结
二氧化硅晶胞结构
碳化硅晶胞结构
氮化硼晶胞结构
①每个Si周围有4个O
Si的杂化轨类型是sp3
②Si原子与Si-O键之比为1:4
③最小环为12元环。
“金刚砂”,它具有类似金刚石的结构和性质,其空间结构中碳原子和硅原子相间排列,化学式为 SiC。
①立方氮化硼晶体结构与金刚石相似
硬度大 熔点高
②六方氮化硼的晶体为平面六元并环的层状结构
B、N原子均采用sp2杂化方式
不属于共价晶体
1.下列说法中,错误的是( )
A. 只含分子的晶体一定是分子晶体
B. 碘晶体升华时破坏了共价键
C. 几乎所有的酸都属于分子晶体
D. 稀有气体分子中只含原子,但稀有气体的晶体属于分子晶体
课堂练习
2.下列说法中,正确的是( )
A. 分子晶体一定存在分子间作用力和共价键
B. 分子晶体的熔点一般比共价晶体的熔点高
C. 稀有气体形成的晶体属于分子晶体
D. CO2 晶体是分子晶体,可推测 SiO2 晶体也是分子晶体
课堂练习
3.下列说法中,正确的是( )
冰融化时,分子中 H-O 键发生断裂
共价晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 分子晶体中,分子间作用力越大,对应的物质越稳定
课堂练习
4.下列事实能说明刚玉(Al2O3)是共价晶体的是( )
①Al2O3 是两性氧化物;
②硬度很大;
③它的熔点是 2045 ℃;
④自然界中的刚玉有红宝石和蓝宝石
A. ①② B. ②③ C. ①④ D. ③④
课堂练习
5.以下晶体是共价晶体还是分子晶体?
金刚石 干冰 冰 可燃冰 硫磺 C60 碘 石英 白磷(P4) 苯甲酸 金刚砂(SiC) 稀有气体的晶体 氧气的晶体 氮气的晶体
课堂练习
参考答案
1.B 2.C. 3.B 4.C
5.
分子晶体 干冰、冰、可燃冰、硫磺、C60、碘 、 白磷(P4)、苯甲酸 、稀有气体的晶体 、氧气的晶体、氮气的晶体
共价晶体 金刚石、石英、金刚砂(SiC)
