高中化学 人教版(2019) 选择性必修2 第三章第三节 金属晶体与离子晶体 第2&3课时 课件(共31张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修2 第三章第三节 金属晶体与离子晶体 第2&3课时 课件(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 16:13:09 | ||
图片预览




文档简介
(共31张PPT)
第三章 第三节 第2课时 《离子晶体》
人教版 选择性必修2
我们知道,熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体
却不能导电,这是为什么呢?
那么,NaCl晶体中微粒是怎样分布的呢?
交流研讨
没有自由移动的Na+和Cl-
NaCl晶体模型又是怎样的呢?
活动·探究
②能否根据你的理解运用相关知识拼接氯化钠的晶体模型?
①利用放大镜观察NaCl晶体,能否看到其微观结构?
资料卡片
1913年布拉格首次用X射线衍射法测定了氯化钠的晶体结构
氯化钠晶体的微观结构
一种现代实验室使用的X射线衍射仪
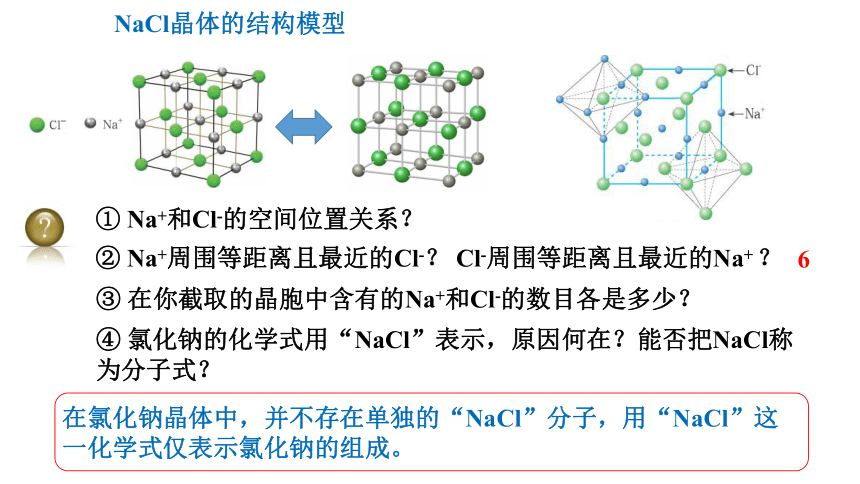
观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞?
观察思考
NaCl晶体的结构模型
③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?
① Na+和Cl-的空间位置关系?
② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?
在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。
6
④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?
NaCl晶体的结构模型
NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?
Na+和Cl-之间存在强烈的相互作用
离子键
交流研讨
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
(静电作用)
共价键特征:有方向性和饱和性
晶体与晶体性质
活动·探究
①揉捏食盐晶体,你的感受?
②盐焗时,发现食盐都未熔融,说明了什么?
离子晶体这些物理性质与离子间的相互作用是否有一定的关系?
硬度较大,难以压缩
熔点高
结构
性质
决定
用途
决定
构成微粒
相互作用
晶体类型
阴、阳离子
离子键
离子晶体
晶体与晶体性质
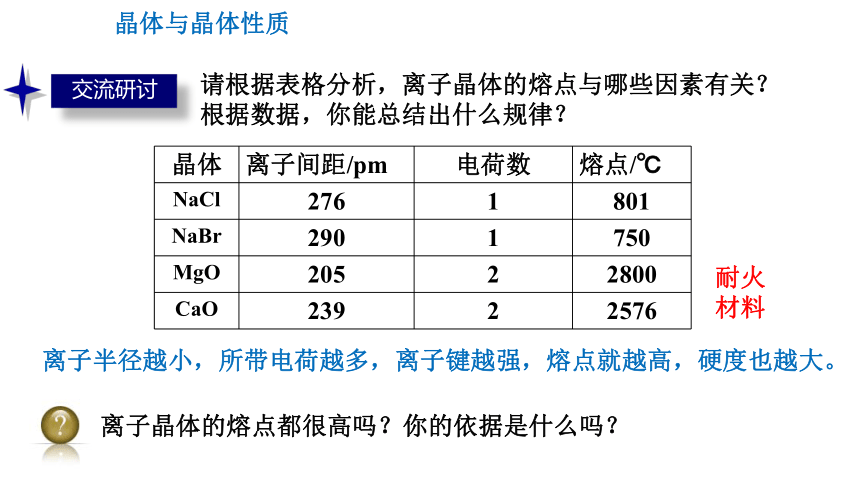
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔点
影响
离子半径、所带电荷
影响
晶体与晶体性质
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
耐火材料
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
离子晶体的熔点都很高吗?你的依据是什么吗?
晶体与晶体性质
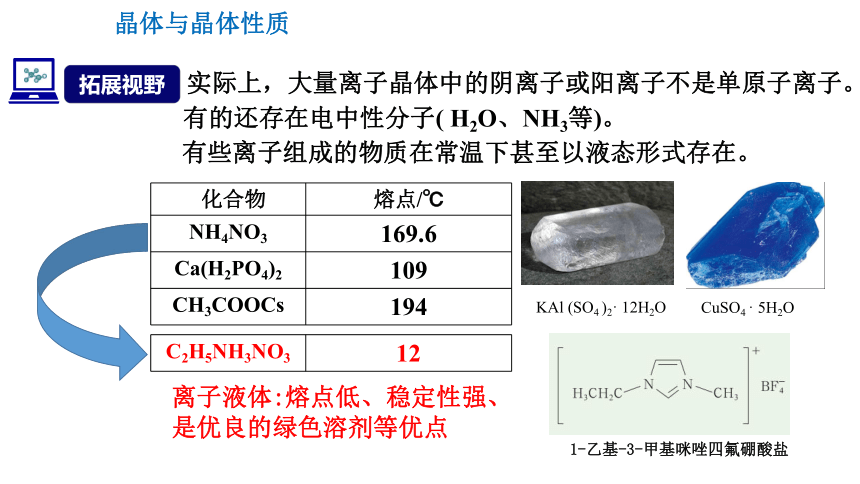
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
C2H5NH3NO3 12
有些离子组成的物质在常温下甚至以液态形式存在。
拓展视野
CuSO4 · 5H2O
1-乙基-3-甲基咪唑四氟硼酸盐
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。
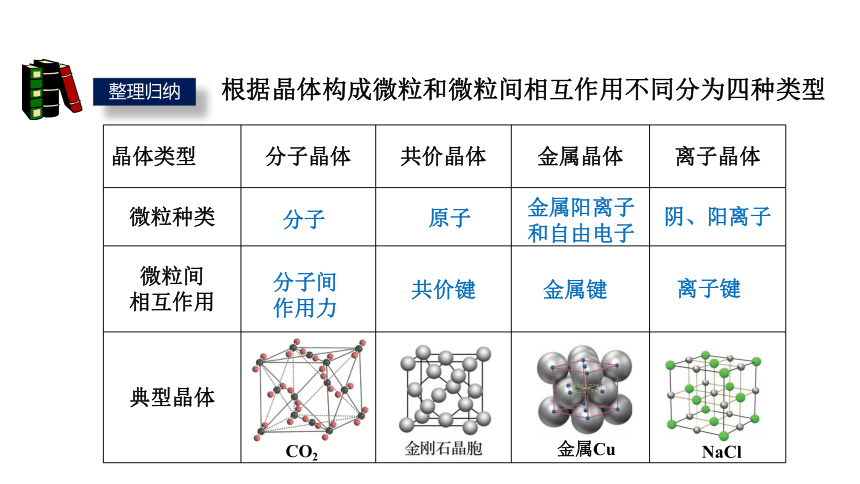
晶体与晶体性质
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
根据晶体构成微粒和微粒间相互作用不同分为四种类型
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间
作用力
阴、阳离子
整理归纳
金属Cu
NaCl
CO2
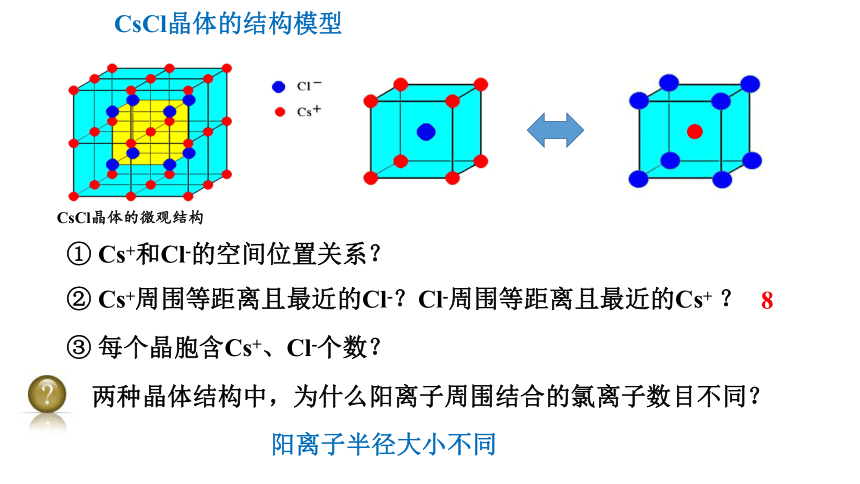
① Cs+和Cl-的空间位置关系?
② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?
阳离子半径大小不同
③ 每个晶胞含Cs+、Cl-个数?
8
CsCl晶体的结构模型
CsCl晶体的微观结构
晶体 熔点/℃
NaCl 801
CuCl 426
已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
交流研讨
② Cu+和Cl-的空间位置关系?
① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?
离子 r/pm
Na+ 102
Cu+ 60
③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
4
CuCl晶体的结构模型
课堂练习
1.下列物质中,含有非极性共价键的离子晶体是( )
A.NaOH B.Na2O2 C.NaCl D.AlCl3
2.已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;一般来说,两成键原子对应的元素间电负性差值大于1.7时,形成离子键;两成键原子对应的元素间电负性差值小于1.7时,形成共价键。下表给出了14种元素的电负性,则下列说法正确的是( )
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.2 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
A.从表中数据看,C和S的电负性相等,所以C和S两元素原子间形成的键为非极性共价键
B.根据电负性数据可知,SiCl4中含离子键,属于离子化合物
C.根据电负性数据可知,Mg3N2中含有离子键
D.BeCl2因含金属元素铍,故属于离子化合物
3.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
A.该晶体属于分子晶体
B.该晶胞中Zn2+和S2-数目不相等
C. Zn2+周围等距离且最近的S2-为6
D.氧化锌的熔点高于硫化锌
4.萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
5.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。某同学画出的MgO晶胞结构示意图如下图所示,下列说法错误的是( )
A.图中的错误的是⑧
B.MgO是优良的耐高温材料,MgO的熔点比CaO的高
C.NiO晶胞中Ni和O周围等距离且最近的O和Ni分别为6、6
D.晶体中与每个O2-距离最近且等距离的O2-有6个
课堂练习正确答案:B C D B D
第三章 第三节 第3课时
《过渡晶体与混合型晶体》
人教版 选择性必修2
课堂引入
复杂多样的晶体
共价晶体 分子晶体 离子晶体 金属晶体
课堂引入
晶体类型之间存在绝对的界限吗?
阅读教材P89 表3-4关于几种氧化物中化学键中离子键成分的百分数
阅读
Na、Mg、Al、Si四种元素氧化物的化学键中离子键成分逐渐减少
过渡晶体
氧化物 Na2O MgO Al2O3 SiO2
离子键百分数% 62 50 41 33
过渡晶体
介于某两种晶体类型之间的晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
过渡晶体
成因分析
元素性质
电负性差值
化学键类型
成键微粒
结论一:四种典型晶体类型都存在过渡晶体
思考
Na2O、MgO、Al2O3 、SiO2化学键中离子键成分为何逐渐减少?
与氧元素的电负性差值逐渐减小
推测
请推测P2O5、SO3、Cl2O7的离子键成分变化趋势
百分数小于33,且逐渐减少
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
P2O5 SO3 Cl2O7
分子晶体
结论二:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
混合型晶体
熔点均较高,金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
你认为是什么造成了这种差异?
思考交流
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
石墨性质特征
熔点高、质软、能导电
共价晶体特征
金属晶体特征
石墨结构特征
范德华力维系
分子晶体特征
混合型晶体
混合型晶体
石墨结构中未参与杂化的p轨道
层状结构
思考交流
混合型晶体
六方氮化硼的结构和性质特征如下图所示,请分析其属于什么晶体类型?
熔点 莫氏硬度 其他
3000℃ 2 导热、润滑
复杂多样的晶体结构
科学前沿·视野拓展
硅酸盐晶体中的阴离子结构示例
总结归纳 · 整合提升
晶体类型的划分
构成晶体的微粒
微粒间的相互作用力
晶体结构的复杂与多样性
课堂练习
1. 判断正误
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)石墨的二维结构内,每个碳原子的配位数为3( )
(6)石墨的导电只能沿石墨平面的方向进行( )
(7)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
2.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合),下列说法正确的是( )
A.根据:
两个反应说明金刚石比石墨稳定,石墨转变为金刚石为放热反应
B.相同质量的金刚石与石墨晶体中,所含共价键数相同
C.估计金刚石与石墨的熔、沸点均较高,硬度均较大
D.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
课堂练习
课堂练习
3.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A. 8 B. 12 C. 24 D. 60
课堂练习
4. 下列各组物质的沸点按由低到高的顺序排列的是( )
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
5. 下列氧化物中所含离子键成分的百分数最小的是( )
A.N2O3 B.P2O3
C.As2O3 D.Bi2O3
课堂练习参考答案
× × √ √ √ √ ×
D
A
C
A
第三章 第三节 第2课时 《离子晶体》
人教版 选择性必修2
我们知道,熔融的NaCl或者NaCl的水溶液能够导电,而NaCl晶体
却不能导电,这是为什么呢?
那么,NaCl晶体中微粒是怎样分布的呢?
交流研讨
没有自由移动的Na+和Cl-
NaCl晶体模型又是怎样的呢?
活动·探究
②能否根据你的理解运用相关知识拼接氯化钠的晶体模型?
①利用放大镜观察NaCl晶体,能否看到其微观结构?
资料卡片
1913年布拉格首次用X射线衍射法测定了氯化钠的晶体结构
氯化钠晶体的微观结构
一种现代实验室使用的X射线衍射仪
观察NaCl的微观结构示意图,你将如何截取NaCl晶体的晶胞?
观察思考
NaCl晶体的结构模型
③ 在你截取的晶胞中含有的Na+和Cl-的数目各是多少?
① Na+和Cl-的空间位置关系?
② Na+周围等距离且最近的Cl-? Cl-周围等距离且最近的Na+ ?
在氯化钠晶体中,并不存在单独的“NaCl”分子,用“NaCl”这一化学式仅表示氯化钠的组成。
6
④ 氯化钠的化学式用“NaCl”表示,原因何在?能否把NaCl称为分子式?
NaCl晶体的结构模型
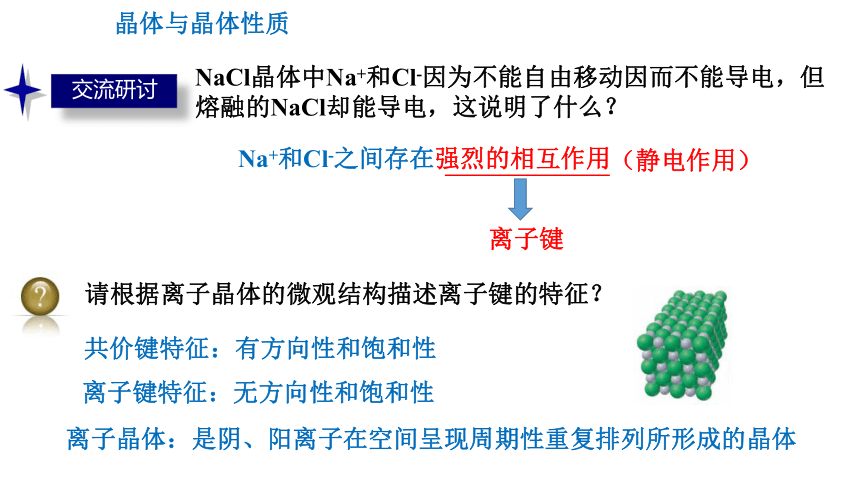
NaCl晶体中Na+和Cl-因为不能自由移动因而不能导电,但熔融的NaCl却能导电,这说明了什么?
Na+和Cl-之间存在强烈的相互作用
离子键
交流研讨
请根据离子晶体的微观结构描述离子键的特征?
离子键特征:无方向性和饱和性
离子晶体:是阴、阳离子在空间呈现周期性重复排列所形成的晶体
(静电作用)
共价键特征:有方向性和饱和性
晶体与晶体性质
活动·探究
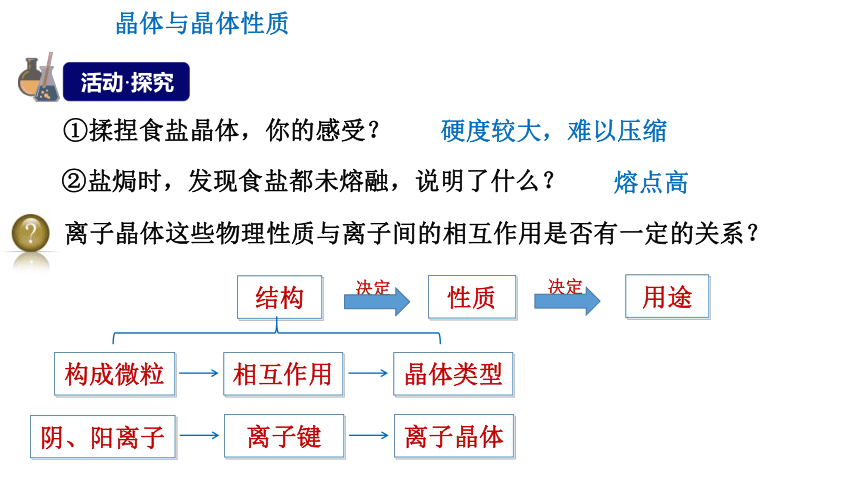
①揉捏食盐晶体,你的感受?
②盐焗时,发现食盐都未熔融,说明了什么?
离子晶体这些物理性质与离子间的相互作用是否有一定的关系?
硬度较大,难以压缩
熔点高
结构
性质
决定
用途
决定
构成微粒
相互作用
晶体类型
阴、阳离子
离子键
离子晶体
晶体与晶体性质
交流研讨
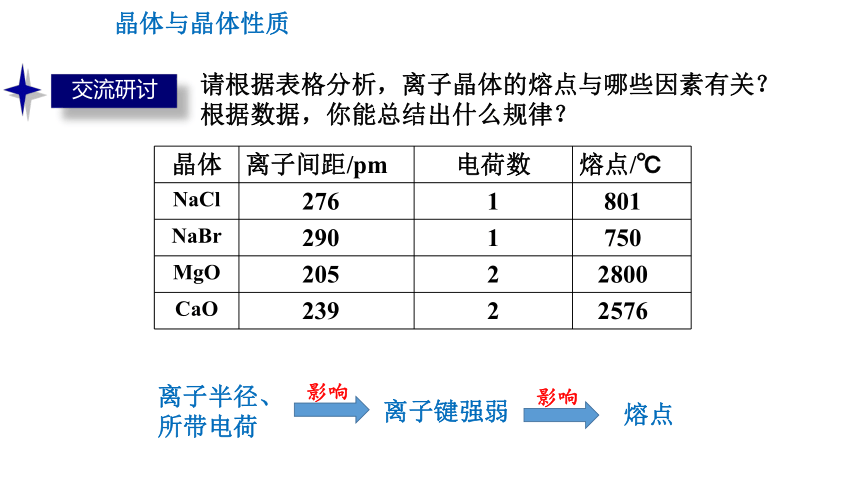
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
离子键强弱
熔点
影响
离子半径、所带电荷
影响
晶体与晶体性质
交流研讨
请根据表格分析,离子晶体的熔点与哪些因素有关?
根据数据,你能总结出什么规律?
晶体 离子间距/pm 电荷数 熔点/℃
NaCl 276 1 801
NaBr 290 1 750
MgO 205 2 2800
CaO 239 2 2576
耐火材料
离子半径越小,所带电荷越多,离子键越强,熔点就越高,硬度也越大。
离子晶体的熔点都很高吗?你的依据是什么吗?
晶体与晶体性质
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
CH3COOCs 194
C2H5NH3NO3 12
有些离子组成的物质在常温下甚至以液态形式存在。
拓展视野
CuSO4 · 5H2O
1-乙基-3-甲基咪唑四氟硼酸盐
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
KAl (SO4 )2· 12H2O
有的还存在电中性分子( H2O、NH3等)。
晶体与晶体性质
晶体类型 分子晶体 共价晶体 金属晶体 离子晶体
微粒种类
微粒间 相互作用
典型晶体
根据晶体构成微粒和微粒间相互作用不同分为四种类型
金属阳离子和自由电子
金属键
原子
离子键
共价键
分子
分子间
作用力
阴、阳离子
整理归纳
金属Cu
NaCl
CO2
① Cs+和Cl-的空间位置关系?
② Cs+周围等距离且最近的Cl-?Cl-周围等距离且最近的Cs+ ?
两种晶体结构中,为什么阳离子周围结合的氯离子数目不同?
阳离子半径大小不同
③ 每个晶胞含Cs+、Cl-个数?
8
CsCl晶体的结构模型
CsCl晶体的微观结构
晶体 熔点/℃
NaCl 801
CuCl 426
已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
交流研讨
② Cu+和Cl-的空间位置关系?
① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?
离子 r/pm
Na+ 102
Cu+ 60
③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
4
CuCl晶体的结构模型
课堂练习
1.下列物质中,含有非极性共价键的离子晶体是( )
A.NaOH B.Na2O2 C.NaCl D.AlCl3
2.已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;一般来说,两成键原子对应的元素间电负性差值大于1.7时,形成离子键;两成键原子对应的元素间电负性差值小于1.7时,形成共价键。下表给出了14种元素的电负性,则下列说法正确的是( )
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.2 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
A.从表中数据看,C和S的电负性相等,所以C和S两元素原子间形成的键为非极性共价键
B.根据电负性数据可知,SiCl4中含离子键,属于离子化合物
C.根据电负性数据可知,Mg3N2中含有离子键
D.BeCl2因含金属元素铍,故属于离子化合物
3.锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )
A.该晶体属于分子晶体
B.该晶胞中Zn2+和S2-数目不相等
C. Zn2+周围等距离且最近的S2-为6
D.氧化锌的熔点高于硫化锌
4.萤石(氟化钙CaF2)晶体属于立方晶系,在氟化钙的晶胞中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为( )
A.2 B.4 C.6 D.8
5.科学家通过X射线证明,MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。某同学画出的MgO晶胞结构示意图如下图所示,下列说法错误的是( )
A.图中的错误的是⑧
B.MgO是优良的耐高温材料,MgO的熔点比CaO的高
C.NiO晶胞中Ni和O周围等距离且最近的O和Ni分别为6、6
D.晶体中与每个O2-距离最近且等距离的O2-有6个
课堂练习正确答案:B C D B D
第三章 第三节 第3课时
《过渡晶体与混合型晶体》
人教版 选择性必修2
课堂引入
复杂多样的晶体
共价晶体 分子晶体 离子晶体 金属晶体
课堂引入
晶体类型之间存在绝对的界限吗?
阅读教材P89 表3-4关于几种氧化物中化学键中离子键成分的百分数
阅读
Na、Mg、Al、Si四种元素氧化物的化学键中离子键成分逐渐减少
过渡晶体
氧化物 Na2O MgO Al2O3 SiO2
离子键百分数% 62 50 41 33
过渡晶体
介于某两种晶体类型之间的晶体
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
过渡晶体
成因分析
元素性质
电负性差值
化学键类型
成键微粒
结论一:四种典型晶体类型都存在过渡晶体
思考
Na2O、MgO、Al2O3 、SiO2化学键中离子键成分为何逐渐减少?
与氧元素的电负性差值逐渐减小
推测
请推测P2O5、SO3、Cl2O7的离子键成分变化趋势
百分数小于33,且逐渐减少
Na2O MgO Al2O3 SiO2
离子晶体 共价晶体
P2O5 SO3 Cl2O7
分子晶体
结论二:晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
混合型晶体
熔点均较高,金刚石硬度很高、不导电,石墨质软、能导电
结构决定性质
同是碳单质的晶体,金刚石和石墨的性质存在哪些异同?
你认为是什么造成了这种差异?
思考交流
金刚石部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3550℃ 10 2.11*10-13
石墨部分物理性质 熔点 莫氏硬度 电导率/(s·m-1)
3850℃ 1 2.5*103
石墨性质特征
熔点高、质软、能导电
共价晶体特征
金属晶体特征
石墨结构特征
范德华力维系
分子晶体特征
混合型晶体
混合型晶体
石墨结构中未参与杂化的p轨道
层状结构
思考交流
混合型晶体
六方氮化硼的结构和性质特征如下图所示,请分析其属于什么晶体类型?
熔点 莫氏硬度 其他
3000℃ 2 导热、润滑
复杂多样的晶体结构
科学前沿·视野拓展
硅酸盐晶体中的阴离子结构示例
总结归纳 · 整合提升
晶体类型的划分
构成晶体的微粒
微粒间的相互作用力
晶体结构的复杂与多样性
课堂练习
1. 判断正误
(1)纯粹的典型晶体是没有的( )
(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
(4)四类晶体都有过渡型( )
(5)石墨的二维结构内,每个碳原子的配位数为3( )
(6)石墨的导电只能沿石墨平面的方向进行( )
(7)石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
2.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合),下列说法正确的是( )
A.根据:
两个反应说明金刚石比石墨稳定,石墨转变为金刚石为放热反应
B.相同质量的金刚石与石墨晶体中,所含共价键数相同
C.估计金刚石与石墨的熔、沸点均较高,硬度均较大
D.现代科技已经实现了石墨制取金刚石,该过程属于化学变化
课堂练习
课堂练习
3.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A. 8 B. 12 C. 24 D. 60
课堂练习
4. 下列各组物质的沸点按由低到高的顺序排列的是( )
A.NH3、CH4、NaCl、Na
B.H2O、H2S、MgSO4、SO2
C.CH4、H2O、NaCl、SiO2
D.Li、Na、K、Rb、Cs
5. 下列氧化物中所含离子键成分的百分数最小的是( )
A.N2O3 B.P2O3
C.As2O3 D.Bi2O3
课堂练习参考答案
× × √ √ √ √ ×
D
A
C
A
