人教版九年级化学下册课件:8.2 金属的化学性质(第一课时)(共41张PPT)
文档属性
| 名称 | 人教版九年级化学下册课件:8.2 金属的化学性质(第一课时)(共41张PPT) | 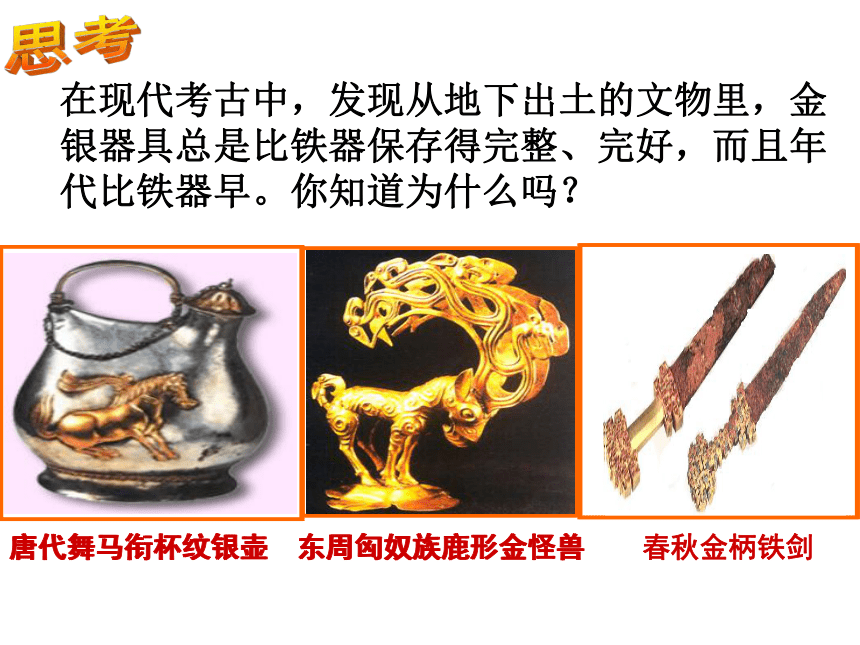 | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-11 14:31:37 | ||
图片预览










文档简介
课件41张PPT。在现代考古中,发现从地下出土的文物里,金银器具总是比铁器保存得完整、完好,而且年代比铁器早。你知道为什么吗? 东周匈奴族鹿形金怪兽唐代舞马衔杯纹银壶思考请阅读P9第一自然段并结合如下图片思考:为什么铝具有这么好的抗腐蚀性能呢?阅读课题2 金属的化学性质 第八单元 金属和金属材料(第1课时)一、金属的化学性质
1、金属与氧气的反应 回顾与讨论:
请同学们回忆在学过的知识中,我们已经研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象并写出化学方程式吗?铁丝在空气中红热,在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体----四氧化三铁知识回顾 点燃
3Fe+2O2=Fe3O4
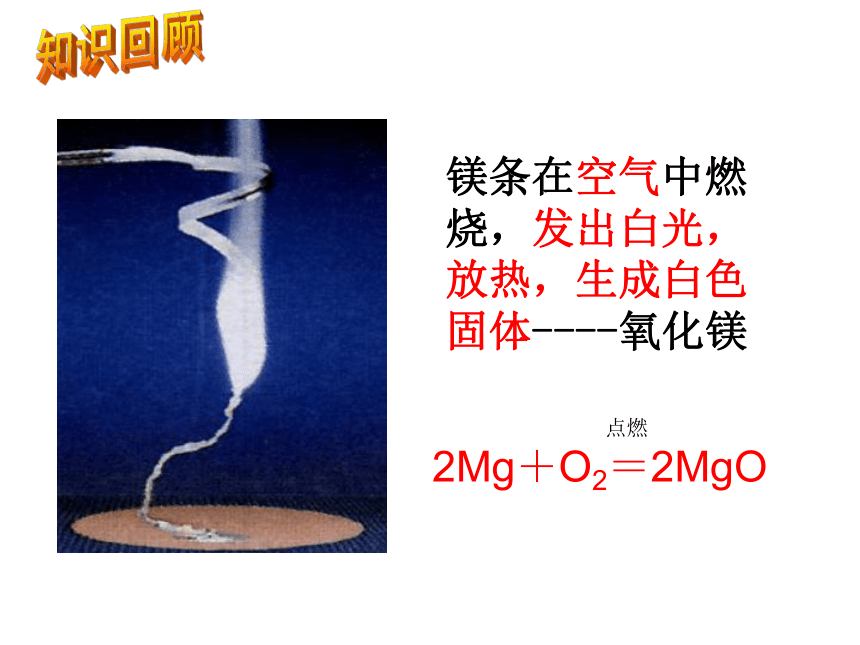
镁条在空气中燃烧,发出白光,放热,生成白色固体----氧化镁知识回顾 点燃
2Mg+O2=2MgO
用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化。
现象:
化学方程式:固体由紫红色变成黑色。补充实验(记在书上P9)(1)铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3
铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易破坏氧化铝薄膜,从而起不到保护作用。金在高温下也不能和氧气反应
(3)真金不怕火炼?(划书上P9)阅读与思考这也是判断金属活动性的方法之一。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。(比较活泼)
铁、铜在常温下几乎不与氧气反应,但在高温时能与氧气反应。 (较不活泼)
金即使在高温时不能与氧气反应。(最不活泼)
活动性:镁、铝 > 铁、铜 > 金(划书上P9)(划书上P9)一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。
请你猜想这种气体是什么?(Henry Cavendish,
1731~1810年)科学家的故事很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸和稀硫酸能否反应以及反应的剧烈程度,亦可反映出金属的活泼程度,即活动性。下面我们就来研究金属与酸的反应.....一、金属的化学性质
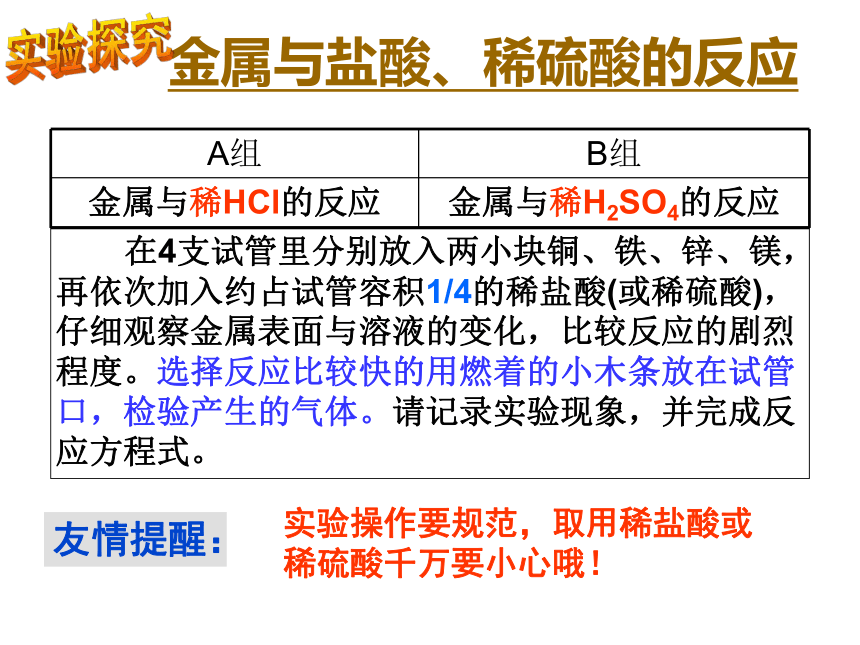
2、金属与酸的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象,并完成反应方程式。金属与盐酸、稀硫酸的反应友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!实验探究A:金属与稀盐酸的反应+2课本笔记溶液呈浅绿色,这是Fe2+的颜色(记在书上P10)B:金属与稀硫酸的反应+2课本笔记(记在书上P10)1.哪些金属能与稀盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与稀盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
另外,由图8-12的漫画你可以得到什么启示?交流与讨论MgZnFeCu小黑点表示产生的气泡 由此推出 ,金属活动性顺序:
___________________________ Mg > Zn > Fe > Cu结论:分析与结论(记在书上P10)⑴铁、镁、锌能和稀盐酸或稀硫酸反应,反应后生成了氢气,铜不能和稀盐酸或稀硫酸反应 ⑵铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。 _____反应最剧烈,其次是_____ ,然后是 _____ 镁锌铁⑶根据反应时是否有氢气产生,将金属分为活泼金属和不活泼金属.交流与讨论分析与结论(记在书上P10) 2.对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。交流与讨论Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
镁、锌、铁与盐酸、稀硫酸反应的化学方程式比较特点:单质 + 化合物==另一化合物 + 另一单质 置 换 反 应交流与讨论分析与结论二、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
交流与讨论分析与结论特点:单质 + 化合物==另一化合物 + 另一单质 置换反应:A + BC → AC + B 记法:单换单(划在书上P11)(记在书上P11)(1)化合反应:A + B + … → AB…(多合一)
(2)分解反应:AB →A + B + … (一分多)
(3)置换反应:A + BC → AC + B (单换单)
已学过的化学反应的基本类型:回顾与小结(记在书上P11)C思路:从反应物和生成物的物质类别和数量的角度分析置换反应。1、反应前后均为两种物质
2、反应前后均为一种单质和一种化合物例题2.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。3.根据金属与氧气、盐酸或稀硫酸能否反应以及反应的剧烈程度,可以判断金属的活泼程度(即金属活动性)。如:Mg、Zn、Fe的金属活动性依次增强,且都比Cu强,能置换出盐酸或稀硫酸中的氢。置换反应不相同本节回顾1.大多数金属都能与氧气反应,但反应的难易和剧烈程度不同2、据福建《三明日报》报道:2006年5月12日,宁化县公安局抓获一流窜江西、福建等地实施诈骗的团伙。自2006年4月底以来,他们随身携带一枚真黄金戒指,若干枚用黄铜(铜锌合金)制作的,与黄金外观极为相似的假黄金戒指在全国各地分头行骗。诈骗三十余起,骗取金额2万余元。
请你识别真假黄金戒指。要求:不少于三种方法。解:1.灼烧法 2.加酸法 3. 测密度 4.比较硬度…例题3、相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。 (相对原子质量:Mg 24 Fe 56 Zn 65)MgFeZn例题Mg + 2 HCl = MgCl2 + H2↑
24 2
M x =2M/24
Zn + 2HCl = ZnCl2 + H2 ↑
65 2
M x =2M/65
Fe + 2HCl = FeCl2 + H2 ↑
56 2
M x =2M/56 分析所以相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量由大到小依次为Mg、 Fe、Zn。且斜线越陡,反应速度越快,金属越活泼,依次为Mg、Zn、Fe,也符合三种金属的活动性顺序。分析规律:
1、斜线越陡,金属越活泼则反应速度越快。
2、金属相同质量时,相对原子质量越小则产生的氢气越多。即m(H2)与Ar(金属)成反比。(记在书上P11)1、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C 、FeCl3 D 、Al2(SO4)3B C练习2、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C练习AlCuSO4CuAl2(SO4)3铝丝表面覆盖一层红色物质,溶液由蓝色逐渐变为无色。无明显变化Al>CuCu—铜丝表面有银白色物质析出,溶液颜色由无色变为蓝色。铝丝表面有红色物质析
出,溶液由蓝色变为无色2Al+ 3 CuSO4—Al2(SO4)3+3Cu—判断常见金属活泼性的方法三:金属与金属化合物的溶液能否反应+AgCu(NO3)2?
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。2.在金属活动性顺序中,位于H前面的金属能置换出
盐酸、稀硫酸中的氢。3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。常见金属的活动性顺序:
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au.
钾 钙 钠 镁 铝, 锌 铁 锡 铅 (氢), 铜 汞 银 铂 金.金属活动性由强逐渐减弱金属活动性顺序的应用含义: 判断下列各组物质能否发生反应?
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au不反应不反应能反应难溶物不反应你能参考上述实验设计一个实验来比较Zn、Cu、Ag三种金属的活动性顺序吗?各小组比赛,看哪个小组设计的实验操作简单,方案合理。金属的活动性顺序
1.金属具有哪些化学性质?这些反应的难易程度或剧烈程度与什么有关?2.根据金属的化学性质你知道判断金属活动性顺序的方法有哪些吗?试设计实验说明铁、铜、镁的金属活动性强弱。(2)为什么不能用铁桶盛装波尔多液(由硫酸铜、生石灰加水配制而成)?★学习小结1.若金属表面有“锈”或“氧化膜”,应先用砂纸打磨干净,再做实验。
2.金属与酸反应时“氢前金属能置氢,氢后金属则不能”;金属与某些化合物溶液反应时“前置后,化合物要可溶”。★误区警示
1.K、Ca、Na一般不与金属的化合物溶液发生置换反应。因太活泼而先和水反应生成氢气。
2.铁与酸或金属的化合物溶液发生置换时,生成的含铁的化合物中铁元素显+2价。 金属的化学性质
1.金属的化学性质;
(1)大多数金属能与O2反应;
(2)大多数金属能与稀HCl或稀H2SO4反应;
(3)部分金属能与金属化合物的溶液反应。
2、置换反应
特点: 单质+化合物 → 新单质+新化合物
3、常见金属的活动性顺序
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au置换反应中固体和溶液质量变化归纳1.金属与酸反应后金属质量减少,溶液质量增加。
2.金属与金属化合物溶液反应后,金属质量和溶液质量的变化与两种金属的相对原子质量大小有关:
(1)当单质金属的相对原子质量大于化合物中金属的相对原子质量时,反应后金属单质的质量减少,溶液质量增加。
(2)当单质金属的相对原子质量小于化合物中金属的相对原子质量时,反应后金属单质的质量增加,溶液质量减少。
请同学们回忆在学过的知识中,我们已经研究了哪几种金属和氧气的反应?你还能回忆起这些反应的现象并写出化学方程式吗?铁丝在空气中红热,在氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体----四氧化三铁知识回顾 点燃
3Fe+2O2=Fe3O4
镁条在空气中燃烧,发出白光,放热,生成白色固体----氧化镁知识回顾 点燃
2Mg+O2=2MgO
用坩埚钳夹持铜片在酒精灯上加热。仔细观察金属表面的变化。
现象:
化学方程式:固体由紫红色变成黑色。补充实验(记在书上P9)(1)铝的化学性质很活泼,在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?为什么却很耐腐蚀?铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3
铝制品表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢?若用钢刷擦洗铝制品,容易破坏氧化铝薄膜,从而起不到保护作用。金在高温下也不能和氧气反应
(3)真金不怕火炼?(划书上P9)阅读与思考这也是判断金属活动性的方法之一。实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。(比较活泼)
铁、铜在常温下几乎不与氧气反应,但在高温时能与氧气反应。 (较不活泼)
金即使在高温时不能与氧气反应。(最不活泼)
活动性:镁、铝 > 铁、铜 > 金(划书上P9)(划书上P9)一种可燃性气体的发现
16世纪中叶,瑞士化学家帕拉塞斯和17世纪英国化学家卡文迪许以及其他一些化学家,都发现有些金属与酸反应可以生成一种可燃性气体,并且发现不同金属反应的剧烈程度不一样。
请你猜想这种气体是什么?(Henry Cavendish,
1731~1810年)科学家的故事很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸和稀硫酸能否反应以及反应的剧烈程度,亦可反映出金属的活泼程度,即活动性。下面我们就来研究金属与酸的反应.....一、金属的化学性质
2、金属与酸的反应 在4支试管里分别放入两小块铜、铁、锌、镁,再依次加入约占试管容积1/4的稀盐酸(或稀硫酸),仔细观察金属表面与溶液的变化,比较反应的剧烈程度。选择反应比较快的用燃着的小木条放在试管口,检验产生的气体。请记录实验现象,并完成反应方程式。金属与盐酸、稀硫酸的反应友情提醒:实验操作要规范,取用稀盐酸或稀硫酸千万要小心哦!实验探究A:金属与稀盐酸的反应+2课本笔记溶液呈浅绿色,这是Fe2+的颜色(记在书上P10)B:金属与稀硫酸的反应+2课本笔记(记在书上P10)1.哪些金属能与稀盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与稀盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
另外,由图8-12的漫画你可以得到什么启示?交流与讨论MgZnFeCu小黑点表示产生的气泡 由此推出 ,金属活动性顺序:
___________________________ Mg > Zn > Fe > Cu结论:分析与结论(记在书上P10)⑴铁、镁、锌能和稀盐酸或稀硫酸反应,反应后生成了氢气,铜不能和稀盐酸或稀硫酸反应 ⑵铁、镁、锌和稀盐酸或稀硫酸反应时剧烈程度不同。 _____反应最剧烈,其次是_____ ,然后是 _____ 镁锌铁⑶根据反应时是否有氢气产生,将金属分为活泼金属和不活泼金属.交流与讨论分析与结论(记在书上P10) 2.对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。交流与讨论Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
镁、锌、铁与盐酸、稀硫酸反应的化学方程式比较特点:单质 + 化合物==另一化合物 + 另一单质 置 换 反 应交流与讨论分析与结论二、置换反应:
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
交流与讨论分析与结论特点:单质 + 化合物==另一化合物 + 另一单质 置换反应:A + BC → AC + B 记法:单换单(划在书上P11)(记在书上P11)(1)化合反应:A + B + … → AB…(多合一)
(2)分解反应:AB →A + B + … (一分多)
(3)置换反应:A + BC → AC + B (单换单)
已学过的化学反应的基本类型:回顾与小结(记在书上P11)C思路:从反应物和生成物的物质类别和数量的角度分析置换反应。1、反应前后均为两种物质
2、反应前后均为一种单质和一种化合物例题2.很多金属都能与盐酸或稀硫酸发生 ,但反应的剧烈程度 。3.根据金属与氧气、盐酸或稀硫酸能否反应以及反应的剧烈程度,可以判断金属的活泼程度(即金属活动性)。如:Mg、Zn、Fe的金属活动性依次增强,且都比Cu强,能置换出盐酸或稀硫酸中的氢。置换反应不相同本节回顾1.大多数金属都能与氧气反应,但反应的难易和剧烈程度不同2、据福建《三明日报》报道:2006年5月12日,宁化县公安局抓获一流窜江西、福建等地实施诈骗的团伙。自2006年4月底以来,他们随身携带一枚真黄金戒指,若干枚用黄铜(铜锌合金)制作的,与黄金外观极为相似的假黄金戒指在全国各地分头行骗。诈骗三十余起,骗取金额2万余元。
请你识别真假黄金戒指。要求:不少于三种方法。解:1.灼烧法 2.加酸法 3. 测密度 4.比较硬度…例题3、相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。 (相对原子质量:Mg 24 Fe 56 Zn 65)MgFeZn例题Mg + 2 HCl = MgCl2 + H2↑
24 2
M x =2M/24
Zn + 2HCl = ZnCl2 + H2 ↑
65 2
M x =2M/65
Fe + 2HCl = FeCl2 + H2 ↑
56 2
M x =2M/56 分析所以相同质量的Mg、Zn、Fe和足量的稀盐酸反应,产生氢气的总质量由大到小依次为Mg、 Fe、Zn。且斜线越陡,反应速度越快,金属越活泼,依次为Mg、Zn、Fe,也符合三种金属的活动性顺序。分析规律:
1、斜线越陡,金属越活泼则反应速度越快。
2、金属相同质量时,相对原子质量越小则产生的氢气越多。即m(H2)与Ar(金属)成反比。(记在书上P11)1、下列物质不能由金属和酸反应直接生成的是 ( )
A、 ZnCl2 B、 CuSO4
C 、FeCl3 D 、Al2(SO4)3B C练习2、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C练习AlCuSO4CuAl2(SO4)3铝丝表面覆盖一层红色物质,溶液由蓝色逐渐变为无色。无明显变化Al>CuCu
出,溶液由蓝色变为无色2Al+ 3 CuSO4—Al2(SO4)3+3Cu—判断常见金属活泼性的方法三:金属与金属化合物的溶液能否反应+AgCu(NO3)2?
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。2.在金属活动性顺序中,位于H前面的金属能置换出
盐酸、稀硫酸中的氢。3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。常见金属的活动性顺序:
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au.
钾 钙 钠 镁 铝, 锌 铁 锡 铅 (氢), 铜 汞 银 铂 金.金属活动性由强逐渐减弱金属活动性顺序的应用含义: 判断下列各组物质能否发生反应?
(1)铜和硫酸锌溶液
(2)锌和硫酸铜溶液
(3)金和硫酸铜溶液
(4)铁和氯化银
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au不反应不反应能反应难溶物不反应你能参考上述实验设计一个实验来比较Zn、Cu、Ag三种金属的活动性顺序吗?各小组比赛,看哪个小组设计的实验操作简单,方案合理。金属的活动性顺序
1.金属具有哪些化学性质?这些反应的难易程度或剧烈程度与什么有关?2.根据金属的化学性质你知道判断金属活动性顺序的方法有哪些吗?试设计实验说明铁、铜、镁的金属活动性强弱。(2)为什么不能用铁桶盛装波尔多液(由硫酸铜、生石灰加水配制而成)?★学习小结1.若金属表面有“锈”或“氧化膜”,应先用砂纸打磨干净,再做实验。
2.金属与酸反应时“氢前金属能置氢,氢后金属则不能”;金属与某些化合物溶液反应时“前置后,化合物要可溶”。★误区警示
1.K、Ca、Na一般不与金属的化合物溶液发生置换反应。因太活泼而先和水反应生成氢气。
2.铁与酸或金属的化合物溶液发生置换时,生成的含铁的化合物中铁元素显+2价。 金属的化学性质
1.金属的化学性质;
(1)大多数金属能与O2反应;
(2)大多数金属能与稀HCl或稀H2SO4反应;
(3)部分金属能与金属化合物的溶液反应。
2、置换反应
特点: 单质+化合物 → 新单质+新化合物
3、常见金属的活动性顺序
K Ca Na Mg Al, Zn Fe Sn Pb (H) , Cu Hg Ag Pt Au置换反应中固体和溶液质量变化归纳1.金属与酸反应后金属质量减少,溶液质量增加。
2.金属与金属化合物溶液反应后,金属质量和溶液质量的变化与两种金属的相对原子质量大小有关:
(1)当单质金属的相对原子质量大于化合物中金属的相对原子质量时,反应后金属单质的质量减少,溶液质量增加。
(2)当单质金属的相对原子质量小于化合物中金属的相对原子质量时,反应后金属单质的质量增加,溶液质量减少。
同课章节目录
