【核心素养】4.1.2元素周期表 课件 (共23张PPT)2024-2025学年高一上学期化学人教版(2019)必修一
文档属性
| 名称 | 【核心素养】4.1.2元素周期表 课件 (共23张PPT)2024-2025学年高一上学期化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 20:11:01 | ||
图片预览




文档简介
(共23张PPT)
第四章 物质结构 元素周期表
第一节 原子结构与元素周期律
第1课时 原子结构
1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、 的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
核心素养学习目标
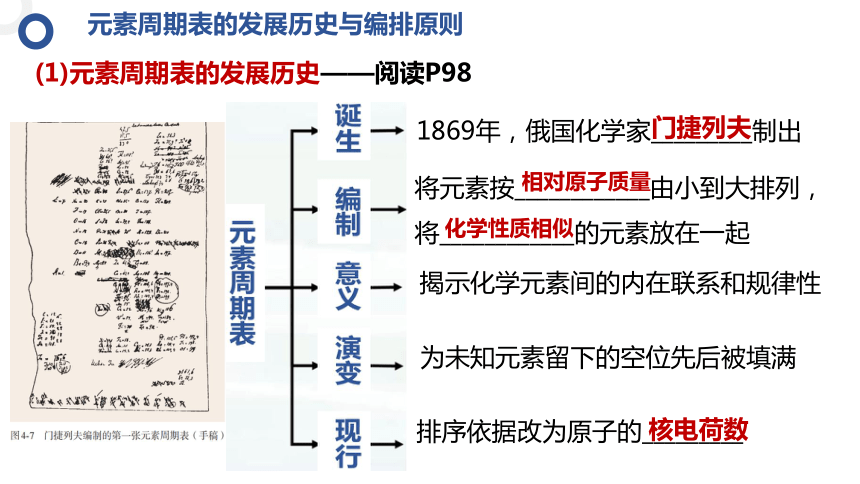
(1)元素周期表的发展历史——阅读P98
揭示化学元素间的内在联系和规律性
为未知元素留下的空位先后被填满
1869年,俄国化学家_________制出
门捷列夫
将元素按____________由小到大排列,将____________的元素放在一起
相对原子质量
化学性质相似
排序依据改为原子的_________
核电荷数
元素周期表的发展历史与编排原则
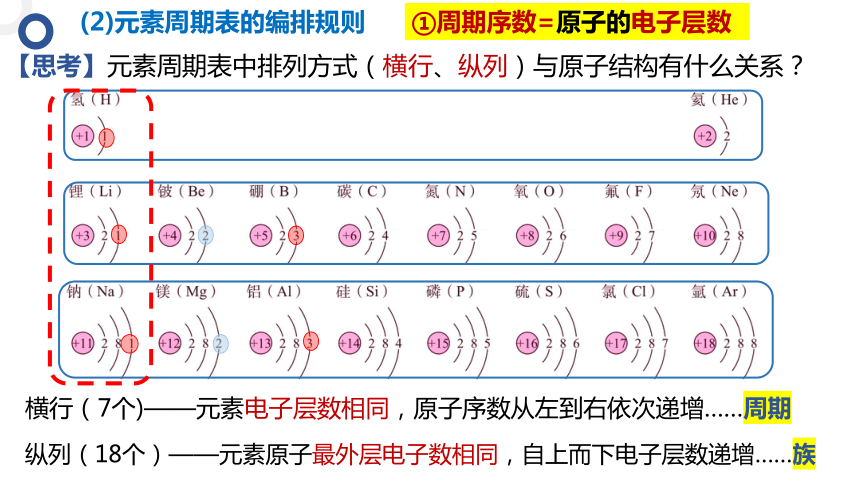
【思考】元素周期表中排列方式(横行、纵列)与原子结构有什么关系?
(2)元素周期表的编排规则
横行(7个)——元素电子层数相同,原子序数从左到右依次递增……周期
纵列(18个)——元素原子最外层电子数相同,自上而下电子层数递增……族
①周期序数=原子的电子层数
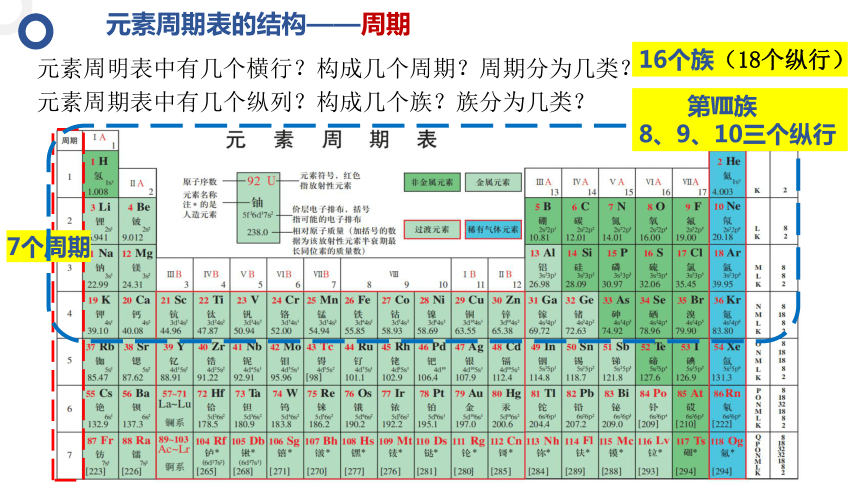
元素周期表的结构——周期
元素周明表中有几个横行?构成几个周期?周期分为几类?
元素周期表中有几个纵列?构成几个族?族分为几类?
7个周期
16个族(18个纵行)
第Ⅷ族
8、9、10三个纵行
周期的分类
Li~Ne 8
Na~Ar 8
K~Kr 18
Rb~Xe 18
Cs~Rn 32
2
3
4
5
6
①周期序数=原子的电子层数
短周期
长周期
2
10
18
36
54
86
118
推测0族稀有气体序数
32
元素周期表在元素推断中的应用
(1)0族定位法
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
差值 2 8 8 18 18 32
86-84=2,第六周期第ⅥA族。
如45号元素,
如88号元素,
如84号元素,
36<45<54,第五周期。
88-86=4,第七周期第ⅡA族。
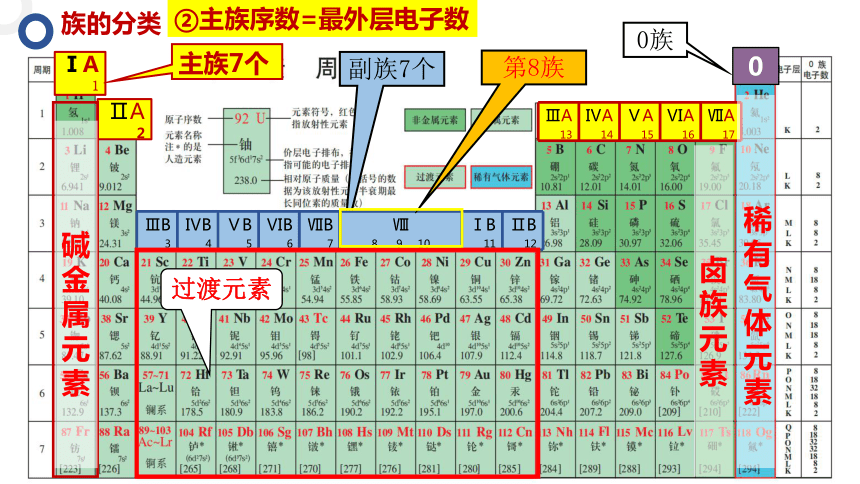
族的分类
ⅠA1
ⅡA2
0
ⅢA13 ⅣA14 ⅤA15 ⅥA16 ⅦA17
主族7个
0族
副族7个
ⅢB3 ⅣB4 ⅤB5 ⅥB6 ⅦB7
Ⅷ 8 9 10 ⅠB11 ⅡB12
②主族序数=最外层电子数
碱金属元素
过渡元素
卤族元素
稀有气体元素
第8族
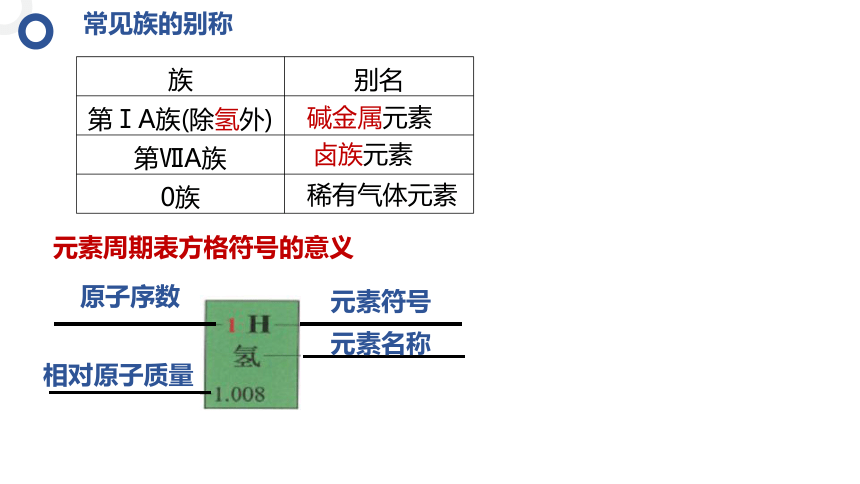
常见族的别称
族 别名
第ⅠA族(除氢外)
第ⅦA族
0族
碱金属元素
卤族元素
稀有气体元素
元素周期表方格符号的意义
元素符号
元素名称
原子序数
相对原子质量
【自主检测】1.元素周期表中,第2、3、4周期元素的数目分别是( )
A.2、8、8 B.8、8、8 C.8、8、18 D.8、18、32
【自主检测】2.下列关于元素周期表的说法正确的是( )
A.每一周期都从碱金属元素开始,最后以稀有气体元素结束
B.第35号元素的单质在常温常压下是气体
C.元素周期表有7个横行,即7个周期,16个纵列,即16个族
D.元素周期表中第9列没有非金属元素
√
√
第2课时 元素周期表
Br2深红棕色液体
第一周期除外
18个纵列,16个族
元素周期表在元素推断中的应用
(2)元素的位置与原子结构的互相推断——原子序数≤20的元素。
①周期序数=电子层数
②主族序数=最外层电子数
③原子序数=核电荷数=质子数=原子的核外电子数
【例题】
则该元素原子有___个电子层,最外层电子数是___,即___元素。
②Y元素的原子序数是16,则该元素的原子结构示意图是
①X元素是第三周期第ⅠA族元素
3
1
钠
第三周期第ⅥA族
其在周期表中的位置是_____________________。
3.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
C
35
37
38
27
32
原子序数 差值
2
10
18
36
54
86
118
2
8
8
18
18
32
针对训练
4.下列关于元素周期表的说法中正确的是( )
A.金属元素都是过渡元素
B.X2-的核外电子数为18,则X位于第4周期IIA族
C.第4周期IIA族与IIIA族元素原子序数相差1
D.IA族元素都是碱金属元素
B
5.在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的原子序数之和为( )
A.5Z B.5Z+18 C.5Z+10 D.5Z+8
C
元素周期表在元素推断中的应用
(2)利用“阴上阳下”推断原子序数的关系
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为
…
…
cZ
dM
bY
aX
则它们的原子序数关系为a>b>d>c
a-(n+1)=b-n=c+(n+1)=d+n
元素周期表小结
元素周期表
编排
按照核电荷数(质子数)由小到大排列
横行:周期
七个周期
短周期:1、2、3
长周期4、5、6、7
纵族:列
16个族
主族:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、ⅧA、
副族:ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ
0族:稀有气体
①周期序数=电子层数
②主族序数=最外层电子数
元素的化学性质与其原子的最外层电子数有关
(原子最外层电子数相同,其化学性质相似,氢和氟除外)
第3课时 核素
元素:具有相同质子数(核电荷数)的同一类原子的总称
核素:具有一定数目的质子数和一定数目的中子数的一种原子
1
1
1
0
1
2
第3课时 核素
同位素:质子数相同,中子数不同的同一元素的不同原子的互称为同位素
(同一元素的不同核素互称为同位素)
同位素
氢元素
核素1
核素n
同位素
元 素
…
特征:同位素在元素周期表中占有相同的位置。化学性质几乎完全相同
,物理性质略有差异。
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,没有个数
化学反应中的最小微粒
化学性质几乎完全相同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
O2、O3互为同素异形体
项目
内容
四素——区别
核素、元素、同位素、同素异形体相互联系
2.已知氮原子的质量数为14,在NH3D+中,电子数、质子数、中子数之比为( )
A.10∶7∶11 B.11∶11∶8
C.11∶10∶8 D.10∶11∶8
D
1. 在 中:
(1)________和________互为同位素。
(2)________和________质量数相等,但不能互称同位素。
(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素。
课后训练
3.医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同
B.与12C的质子数与中子数相等
C.14C与14N是同种元素
D.与12C、13C互为同位素
D
4.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互为同位素
C.H2O与D2O互为同素异形体 D.1H218O与D216O的相对分子质量相同
C
5. 36 g H2O与80 g D2O的物质的量之比是________,分子中所含质子数之比是________,所含中子数之比是________。
1:2
2:5
1:2
小结
第四章 物质结构 元素周期表
第一节 原子结构与元素周期律
第1课时 原子结构
1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、 的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
核心素养学习目标
(1)元素周期表的发展历史——阅读P98
揭示化学元素间的内在联系和规律性
为未知元素留下的空位先后被填满
1869年,俄国化学家_________制出
门捷列夫
将元素按____________由小到大排列,将____________的元素放在一起
相对原子质量
化学性质相似
排序依据改为原子的_________
核电荷数
元素周期表的发展历史与编排原则
【思考】元素周期表中排列方式(横行、纵列)与原子结构有什么关系?
(2)元素周期表的编排规则
横行(7个)——元素电子层数相同,原子序数从左到右依次递增……周期
纵列(18个)——元素原子最外层电子数相同,自上而下电子层数递增……族
①周期序数=原子的电子层数
元素周期表的结构——周期
元素周明表中有几个横行?构成几个周期?周期分为几类?
元素周期表中有几个纵列?构成几个族?族分为几类?
7个周期
16个族(18个纵行)
第Ⅷ族
8、9、10三个纵行
周期的分类
Li~Ne 8
Na~Ar 8
K~Kr 18
Rb~Xe 18
Cs~Rn 32
2
3
4
5
6
①周期序数=原子的电子层数
短周期
长周期
2
10
18
36
54
86
118
推测0族稀有气体序数
32
元素周期表在元素推断中的应用
(1)0族定位法
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 一 二 三 四 五 六 七
原子序数 2 10 18 36 54 86 118
差值 2 8 8 18 18 32
86-84=2,第六周期第ⅥA族。
如45号元素,
如88号元素,
如84号元素,
36<45<54,第五周期。
88-86=4,第七周期第ⅡA族。
族的分类
ⅠA1
ⅡA2
0
ⅢA13 ⅣA14 ⅤA15 ⅥA16 ⅦA17
主族7个
0族
副族7个
ⅢB3 ⅣB4 ⅤB5 ⅥB6 ⅦB7
Ⅷ 8 9 10 ⅠB11 ⅡB12
②主族序数=最外层电子数
碱金属元素
过渡元素
卤族元素
稀有气体元素
第8族
常见族的别称
族 别名
第ⅠA族(除氢外)
第ⅦA族
0族
碱金属元素
卤族元素
稀有气体元素
元素周期表方格符号的意义
元素符号
元素名称
原子序数
相对原子质量
【自主检测】1.元素周期表中,第2、3、4周期元素的数目分别是( )
A.2、8、8 B.8、8、8 C.8、8、18 D.8、18、32
【自主检测】2.下列关于元素周期表的说法正确的是( )
A.每一周期都从碱金属元素开始,最后以稀有气体元素结束
B.第35号元素的单质在常温常压下是气体
C.元素周期表有7个横行,即7个周期,16个纵列,即16个族
D.元素周期表中第9列没有非金属元素
√
√
第2课时 元素周期表
Br2深红棕色液体
第一周期除外
18个纵列,16个族
元素周期表在元素推断中的应用
(2)元素的位置与原子结构的互相推断——原子序数≤20的元素。
①周期序数=电子层数
②主族序数=最外层电子数
③原子序数=核电荷数=质子数=原子的核外电子数
【例题】
则该元素原子有___个电子层,最外层电子数是___,即___元素。
②Y元素的原子序数是16,则该元素的原子结构示意图是
①X元素是第三周期第ⅠA族元素
3
1
钠
第三周期第ⅥA族
其在周期表中的位置是_____________________。
3.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
C
35
37
38
27
32
原子序数 差值
2
10
18
36
54
86
118
2
8
8
18
18
32
针对训练
4.下列关于元素周期表的说法中正确的是( )
A.金属元素都是过渡元素
B.X2-的核外电子数为18,则X位于第4周期IIA族
C.第4周期IIA族与IIIA族元素原子序数相差1
D.IA族元素都是碱金属元素
B
5.在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的原子序数之和为( )
A.5Z B.5Z+18 C.5Z+10 D.5Z+8
C
元素周期表在元素推断中的应用
(2)利用“阴上阳下”推断原子序数的关系
具有相同电子层结构的离子,如aX(n+1)+、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为
…
…
cZ
dM
bY
aX
则它们的原子序数关系为a>b>d>c
a-(n+1)=b-n=c+(n+1)=d+n
元素周期表小结
元素周期表
编排
按照核电荷数(质子数)由小到大排列
横行:周期
七个周期
短周期:1、2、3
长周期4、5、6、7
纵族:列
16个族
主族:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、ⅧA、
副族:ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ
0族:稀有气体
①周期序数=电子层数
②主族序数=最外层电子数
元素的化学性质与其原子的最外层电子数有关
(原子最外层电子数相同,其化学性质相似,氢和氟除外)
第3课时 核素
元素:具有相同质子数(核电荷数)的同一类原子的总称
核素:具有一定数目的质子数和一定数目的中子数的一种原子
1
1
1
0
1
2
第3课时 核素
同位素:质子数相同,中子数不同的同一元素的不同原子的互称为同位素
(同一元素的不同核素互称为同位素)
同位素
氢元素
核素1
核素n
同位素
元 素
…
特征:同位素在元素周期表中占有相同的位置。化学性质几乎完全相同
,物理性质略有差异。
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,没有个数
化学反应中的最小微粒
化学性质几乎完全相同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
O2、O3互为同素异形体
项目
内容
四素——区别
核素、元素、同位素、同素异形体相互联系
2.已知氮原子的质量数为14,在NH3D+中,电子数、质子数、中子数之比为( )
A.10∶7∶11 B.11∶11∶8
C.11∶10∶8 D.10∶11∶8
D
1. 在 中:
(1)________和________互为同位素。
(2)________和________质量数相等,但不能互称同位素。
(3)________和________的中子数相等,但质子数不相等,所以不是同一种元素。
课后训练
3.医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60中的碳原子化学性质不同
B.与12C的质子数与中子数相等
C.14C与14N是同种元素
D.与12C、13C互为同位素
D
4.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互为同位素
C.H2O与D2O互为同素异形体 D.1H218O与D216O的相对分子质量相同
C
5. 36 g H2O与80 g D2O的物质的量之比是________,分子中所含质子数之比是________,所含中子数之比是________。
1:2
2:5
1:2
小结
