【核心素养】3.1.3铁盐和亚铁盐 课件 (共17张PPT) 2024-2025学年高一上学期化学人教版(2019)必修一
文档属性
| 名称 | 【核心素养】3.1.3铁盐和亚铁盐 课件 (共17张PPT) 2024-2025学年高一上学期化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 39.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 20:15:35 | ||
图片预览





文档简介
(共17张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第3课时 铁盐和亚铁盐
1. 掌握铁盐和亚铁盐的相关性质及亚铁盐的检验,并能书写相关化学反应方程式。
2. 利用“价-类二维图”,构建“铁三角”转化关系,掌握Fe、Fe2+、Fe3+相互转化的途径,强化变化观念,并结合转化关系解决实际问题。
3. 结合应用实例,将铁的重要化合物的性质知识运用于实际生产生活。
/核心素养学习目标/
创设情景一
【分享交流】你知道为什么人体需要补铁吗?补的几价铁?
铁是人体必需的微量元素中含量最多的一种,是红细胞的组成成分之一,也是生物酶的组成成分。
【问题】如何检测Fe3+和Fe2+?
一、检测Fe3+和Fe2+
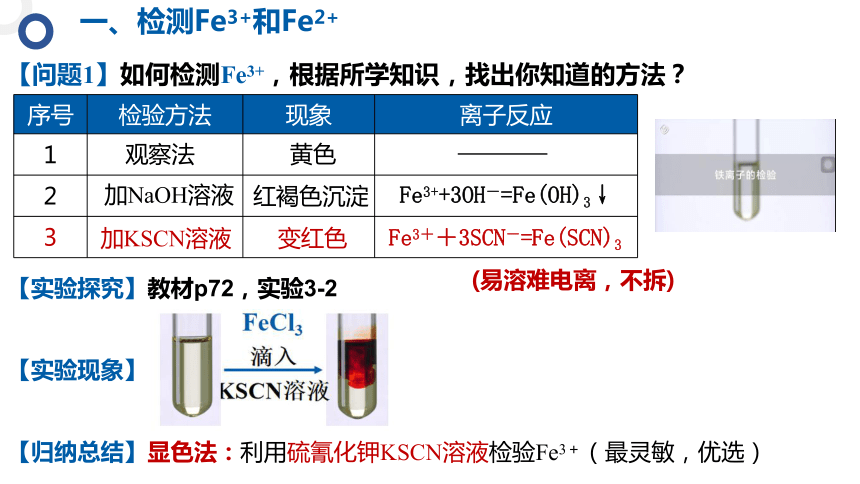
【问题1】如何检测Fe3+,根据所学知识,找出你知道的方法?
序号 检验方法 现象 离子反应
1
2
3
观察法
黄色
【实验探究】教材p72,实验3-2
加NaOH溶液
红褐色沉淀
加KSCN溶液
变红色
Fe3++3SCN-=Fe(SCN)3
Fe3++3OH-=Fe(OH)3↓
【归纳总结】显色法:利用硫氰化钾KSCN溶液检验Fe3+(最灵敏,优选)
(易溶难电离,不拆)
【实验现象】
一、检测Fe3+和Fe2+
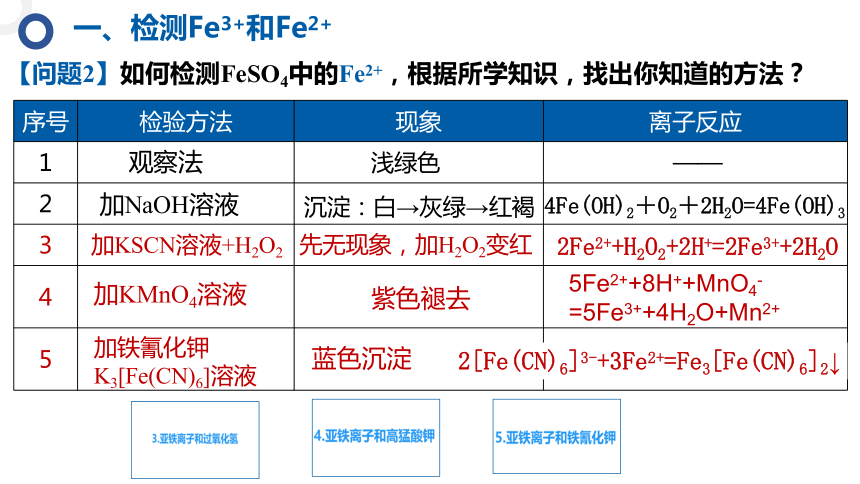
【问题2】如何检测FeSO4中的Fe2+,根据所学知识,找出你知道的方法?
序号 检验方法 现象 离子反应
1
2
3
4
5
观察法
加NaOH溶液
加KSCN溶液+H2O2
加KMnO4溶液
加铁氰化钾K3[Fe(CN)6]溶液
浅绿色
沉淀:白→灰绿→红褐
4Fe(OH)2+O2+2H2O=4Fe(OH)3
——
先无现象,加H2O2变红
2Fe2++H2O2+2H+=2Fe3++2H2O
紫色褪去
5Fe2++8H++MnO4-=5Fe3++4H2O+Mn2+
蓝色沉淀
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
【典例1】下列说法正确的是( )
A.FeCl2不能通过化合反应制得
B.Fe(OH)3可能由对应的碱性氧化物和水反应制得
C.溶液中加入NaOH溶液,生成红褐色沉淀,则溶液中一定含有Fe2+
D.除去FeCl2溶液中少量的CuCl2杂质,可向溶液中加入过量铁粉,
然后过滤
D
【解析】A.Fe与FeCl3反应产生FeCl2,A错误;B.氧化铁难溶于水,不能与水反应,B错误;C.向溶液中加入NaOH溶液,生成红褐色沉淀,则溶液中一定含有Fe3+,可能存在Fe2+,C错误;D.Fe可与CuCl2发生置换反应生成FeCl2和Cu,因此加入过量铁粉,能达到除杂、净化的目的,D正确;故合理选项是D。
对应训练
创设情景二
【提出问题】补铁剂中搭配维生素C,效果更佳,推测其原因。
【预测转化】
Fe2+
Fe3+
①被氧化
②维生素C(还原性)
加入FeSO4片溶解后静置15分钟,颜色变黄,且逐渐加深
加入FeSO4片刚刚溶解
二、Fe2+和Fe3+转化
【实验3-3】课本p73
操作步骤 现象 离子方程式 结论
①FeCl3溶液中加过量铁粉,振荡,后滴入几滴KSCN溶液 加铁粉振荡后,溶液变成 色,再加KSCN溶液,溶液颜色 。 Fe3+遇到较强的还原剂时,会被还原成 。
②把上层清液倒入另一支试管,再滴入几滴氯水 溶液显 色 Fe2+在较强的氧化剂作用下会被氧化成 。
2Fe3++Fe=3Fe2+
浅绿
无变化
红
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN- =Fe(SCN)3
Fe3+
Fe2+
小 结
思考:可以选用什么试剂实现Fe2+和Fe3+的相互转化?
氧化剂(O2、 Cl2、H2O2、HNO3、KMnO4 等)
还原剂(Zn、Fe、Cu、S2-、I-等)
温故知新
转化
鉴别
Fe3+
Fe2+
1、观察法
2、加NaOH溶液
3、加KSCN溶液
Fe3++3SCN-=Fe(SCN)3
1、观察法
2、加NaOH溶液
3、加KSCN+H2O2
4、加KMnO4
5、加K3[Fe(CN)6]
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe2++H2O2+2H+=2Fe3++2H2O
5Fe2++8H++MnO4=5Fe3++4H2O+Mn2+
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
对应训练
2、要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作,顺序为( )
①加入足量氯水 ②加入足量酸性KMnO4溶液
③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
3、证明某溶液只含有Fe2+而不含Fe3+最佳的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D.加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色
C
B
三、“铁三角”应用解题
【1】根据“铁三角”转化关系,找出分离、除杂方法。
括号内为杂质 除杂方法
Fe2+(Fe3+)
FeCl3(FeCl2)
Fe2+(Cu2+)
加过量铁粉后过滤
加氯水或通入Cl2
加过量铁粉后过滤
【2】利用覆铜板制作图案(课本74-75页),写出化学式和离子方程式
2FeCl3+Cu=2FeCl2+CuCl2
(2Fe3++Cu=2Fe2++Cu2+)
【共存问题】
①Fe2+、Fe3+与OH-生成沉淀不共存。
②Fe2+与HNO3、Mn(H+)等氧化剂,发生氧化还原反应不共存。
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不共存。
三、“铁三角”应用解题
【3】判断下列离子能否共存,并指出原因
A. Na+、Fe2+、OH-、NO3- B. Fe3+、OH-、SO42-、Cl-
C. Fe3+、SCN-、OH-、I- D. H+、K+、NO3-、Fe2+ E. H+、Fe2+、Cl- 、MnO4-
四、构建铁元素价类二维图
【构建模型】从元素价态和物质类别两个角度构建铁元素价类二维图
3.化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确是( )
A.工业上用CO还原Fe2O3炼铁,
该反应为置换反应
B.Fe3O4中铁元素为+4价
C.维生素C能将Fe3+转化为Fe2+,
该过程中维生素C是还原剂
D.Fe(OH)2浊液露置于空气中,由白色立即变为红褐色
评价训练
C
铁三角
【思考讨论】用图示归纳Fe、Fe2+、Fe3+相互转化(课本73页)
Fe2+
Fe3+
Fe
还原性
氧化性/还原性
氧化性
强氧化剂:
Cl2、H2O2、O2、HNO3、KMnO4(H+)
还原剂:Fe、Zn、Cu、H2S、KI等
Cl2、HNO3、H2SO4(浓)等
(强氧化剂)
Al 、CO等
Cu2+、H+、S、I2等
(较弱氧化剂)
Zn、Al等
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
KNO3
AgCl
KCl
FeCl2
KOH
Fe
H2
(2)写出E转变成F的化学方程式:__________________________
(3)向G溶液中加入A,写出反应的离子方程式:_________________________________
KCl
(1)写出B和D的化学式:B ;D
【思维建模】热点考题——物质转化(课本P72页)
第三章 铁 金属材料
第一节 铁及其化合物
第3课时 铁盐和亚铁盐
1. 掌握铁盐和亚铁盐的相关性质及亚铁盐的检验,并能书写相关化学反应方程式。
2. 利用“价-类二维图”,构建“铁三角”转化关系,掌握Fe、Fe2+、Fe3+相互转化的途径,强化变化观念,并结合转化关系解决实际问题。
3. 结合应用实例,将铁的重要化合物的性质知识运用于实际生产生活。
/核心素养学习目标/
创设情景一
【分享交流】你知道为什么人体需要补铁吗?补的几价铁?
铁是人体必需的微量元素中含量最多的一种,是红细胞的组成成分之一,也是生物酶的组成成分。
【问题】如何检测Fe3+和Fe2+?
一、检测Fe3+和Fe2+
【问题1】如何检测Fe3+,根据所学知识,找出你知道的方法?
序号 检验方法 现象 离子反应
1
2
3
观察法
黄色
【实验探究】教材p72,实验3-2
加NaOH溶液
红褐色沉淀
加KSCN溶液
变红色
Fe3++3SCN-=Fe(SCN)3
Fe3++3OH-=Fe(OH)3↓
【归纳总结】显色法:利用硫氰化钾KSCN溶液检验Fe3+(最灵敏,优选)
(易溶难电离,不拆)
【实验现象】
一、检测Fe3+和Fe2+
【问题2】如何检测FeSO4中的Fe2+,根据所学知识,找出你知道的方法?
序号 检验方法 现象 离子反应
1
2
3
4
5
观察法
加NaOH溶液
加KSCN溶液+H2O2
加KMnO4溶液
加铁氰化钾K3[Fe(CN)6]溶液
浅绿色
沉淀:白→灰绿→红褐
4Fe(OH)2+O2+2H2O=4Fe(OH)3
——
先无现象,加H2O2变红
2Fe2++H2O2+2H+=2Fe3++2H2O
紫色褪去
5Fe2++8H++MnO4-=5Fe3++4H2O+Mn2+
蓝色沉淀
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
【典例1】下列说法正确的是( )
A.FeCl2不能通过化合反应制得
B.Fe(OH)3可能由对应的碱性氧化物和水反应制得
C.溶液中加入NaOH溶液,生成红褐色沉淀,则溶液中一定含有Fe2+
D.除去FeCl2溶液中少量的CuCl2杂质,可向溶液中加入过量铁粉,
然后过滤
D
【解析】A.Fe与FeCl3反应产生FeCl2,A错误;B.氧化铁难溶于水,不能与水反应,B错误;C.向溶液中加入NaOH溶液,生成红褐色沉淀,则溶液中一定含有Fe3+,可能存在Fe2+,C错误;D.Fe可与CuCl2发生置换反应生成FeCl2和Cu,因此加入过量铁粉,能达到除杂、净化的目的,D正确;故合理选项是D。
对应训练
创设情景二
【提出问题】补铁剂中搭配维生素C,效果更佳,推测其原因。
【预测转化】
Fe2+
Fe3+
①被氧化
②维生素C(还原性)
加入FeSO4片溶解后静置15分钟,颜色变黄,且逐渐加深
加入FeSO4片刚刚溶解
二、Fe2+和Fe3+转化
【实验3-3】课本p73
操作步骤 现象 离子方程式 结论
①FeCl3溶液中加过量铁粉,振荡,后滴入几滴KSCN溶液 加铁粉振荡后,溶液变成 色,再加KSCN溶液,溶液颜色 。 Fe3+遇到较强的还原剂时,会被还原成 。
②把上层清液倒入另一支试管,再滴入几滴氯水 溶液显 色 Fe2+在较强的氧化剂作用下会被氧化成 。
2Fe3++Fe=3Fe2+
浅绿
无变化
红
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN- =Fe(SCN)3
Fe3+
Fe2+
小 结
思考:可以选用什么试剂实现Fe2+和Fe3+的相互转化?
氧化剂(O2、 Cl2、H2O2、HNO3、KMnO4 等)
还原剂(Zn、Fe、Cu、S2-、I-等)
温故知新
转化
鉴别
Fe3+
Fe2+
1、观察法
2、加NaOH溶液
3、加KSCN溶液
Fe3++3SCN-=Fe(SCN)3
1、观察法
2、加NaOH溶液
3、加KSCN+H2O2
4、加KMnO4
5、加K3[Fe(CN)6]
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe2++H2O2+2H+=2Fe3++2H2O
5Fe2++8H++MnO4=5Fe3++4H2O+Mn2+
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓
对应训练
2、要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作,顺序为( )
①加入足量氯水 ②加入足量酸性KMnO4溶液
③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
3、证明某溶液只含有Fe2+而不含Fe3+最佳的实验方法是( )
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后显红褐色
D.加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色
C
B
三、“铁三角”应用解题
【1】根据“铁三角”转化关系,找出分离、除杂方法。
括号内为杂质 除杂方法
Fe2+(Fe3+)
FeCl3(FeCl2)
Fe2+(Cu2+)
加过量铁粉后过滤
加氯水或通入Cl2
加过量铁粉后过滤
【2】利用覆铜板制作图案(课本74-75页),写出化学式和离子方程式
2FeCl3+Cu=2FeCl2+CuCl2
(2Fe3++Cu=2Fe2++Cu2+)
【共存问题】
①Fe2+、Fe3+与OH-生成沉淀不共存。
②Fe2+与HNO3、Mn(H+)等氧化剂,发生氧化还原反应不共存。
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不共存。
三、“铁三角”应用解题
【3】判断下列离子能否共存,并指出原因
A. Na+、Fe2+、OH-、NO3- B. Fe3+、OH-、SO42-、Cl-
C. Fe3+、SCN-、OH-、I- D. H+、K+、NO3-、Fe2+ E. H+、Fe2+、Cl- 、MnO4-
四、构建铁元素价类二维图
【构建模型】从元素价态和物质类别两个角度构建铁元素价类二维图
3.化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价—类”二维图。铁元素的“价—类”二维图如图所示,下列说法正确是( )
A.工业上用CO还原Fe2O3炼铁,
该反应为置换反应
B.Fe3O4中铁元素为+4价
C.维生素C能将Fe3+转化为Fe2+,
该过程中维生素C是还原剂
D.Fe(OH)2浊液露置于空气中,由白色立即变为红褐色
评价训练
C
铁三角
【思考讨论】用图示归纳Fe、Fe2+、Fe3+相互转化(课本73页)
Fe2+
Fe3+
Fe
还原性
氧化性/还原性
氧化性
强氧化剂:
Cl2、H2O2、O2、HNO3、KMnO4(H+)
还原剂:Fe、Zn、Cu、H2S、KI等
Cl2、HNO3、H2SO4(浓)等
(强氧化剂)
Al 、CO等
Cu2+、H+、S、I2等
(较弱氧化剂)
Zn、Al等
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
KNO3
AgCl
KCl
FeCl2
KOH
Fe
H2
(2)写出E转变成F的化学方程式:__________________________
(3)向G溶液中加入A,写出反应的离子方程式:_________________________________
KCl
(1)写出B和D的化学式:B ;D
【思维建模】热点考题——物质转化(课本P72页)
