4.1.5卤族元素 学案 (含答案) 2024-2025学年高一上学期化学人教版(2019)必修一
文档属性
| 名称 | 4.1.5卤族元素 学案 (含答案) 2024-2025学年高一上学期化学人教版(2019)必修一 | 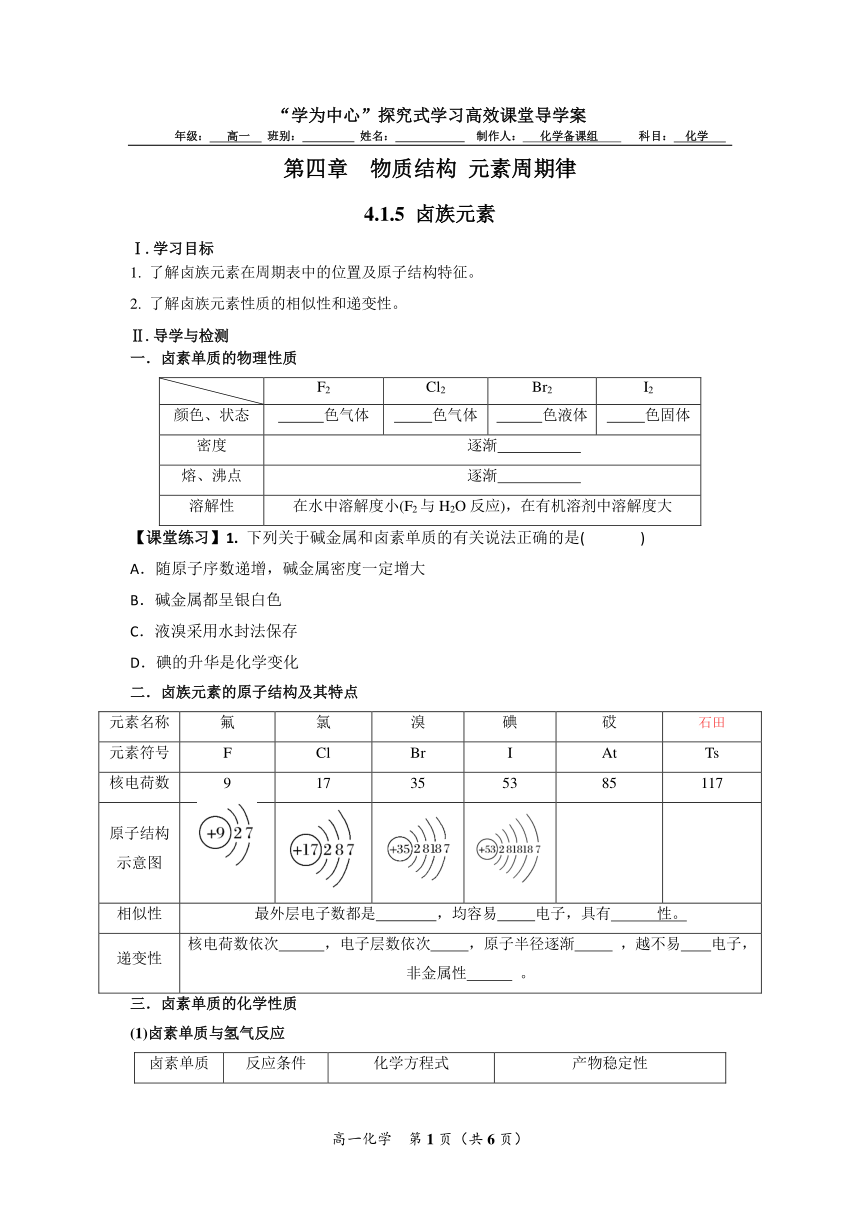 | |
| 格式 | docx | ||
| 文件大小 | 164.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 20:26:51 | ||
图片预览



文档简介
“学为中心”探究式学习高效课堂导学案
年级: 高一 班别: 姓名: 制作人: 化学备课组 科目: 化学
第四章 物质结构 元素周期律
4.1.5 卤族元素
Ⅰ.学习目标
1. 了解卤族元素在周期表中的位置及原子结构特征。
2. 了解卤族元素性质的相似性和递变性。
Ⅱ.导学与检测
一.卤素单质的物理性质
F2 Cl2 Br2 I2
颜色、状态 色气体 色气体 色液体 色固体
密度 逐渐
熔、沸点 逐渐
溶解性 在水中溶解度小(F2与H2O反应),在有机溶剂中溶解度大
【课堂练习】1. 下列关于碱金属和卤素单质的有关说法正确的是( )
A.随原子序数递增,碱金属密度一定增大
B.碱金属都呈银白色
C.液溴采用水封法保存
D.碘的升华是化学变化
二.卤族元素的原子结构及其特点
元素名称 氟 氯 溴 碘 砹 石田
元素符号 F Cl Br I At Ts
核电荷数 9 17 35 53 85 117
原子结构 示意图
相似性 最外层电子数都是 ,均容易 电子,具有 性。
递变性 核电荷数依次 ,电子层数依次 ,原子半径逐渐 ,越不易 电子,非金属性 。
三.卤素单质的化学性质
(1)卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处
Cl2 光照或点燃
Br2 加热
I2 不断加热
递变规律 从F2到I2,与H2化合越来越 ,生成的氢化物稳定性逐渐 ,元素的非金属性逐渐
【课堂练习】2.下列有关碱金属元素和卤素的说法中,错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属元素和卤素的熔、沸点都逐渐降低
(2)卤素单质间的置换反应的实验探究
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为 色 氧化性:
振荡静置后,溶液由无色变为 色
振荡静置后,溶液由无色变为 色
提醒:因为F2能与H2O发生反应(2F2 + 2H2O = 4HF + O2)
所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
【课堂练习】3.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是 ( )
A.与H2化合能力:At2>I2 B.砹在常温为白色固体
C.砹原子的最外电子层上有7个电子 D.砹能从NaCl溶液中置换出氯单质
4.下列有关卤族元素的叙述不正确的是( )
A.卤素单质从F2到I2,颜色加深,熔沸点升高
B.卤族元素从Cl到I,对应氢化物的稳定性减弱
C.卤族元素从F到I,HX水溶液酸性增强
D.卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从 它的盐溶液中置换出来
(3) 卤素单质间与水的反应
通式:X2+H2O HX+HXO X2为Cl2、Br2、I2
注意:2F2 + 2H2O === 4HF + O2
卤素单质间与碱的反应
通式:X2 +2NaOH== NaX+NaXO+H2O X2为Cl2、Br2、I2
特例:2F2+2NaOH == 2NaF+H2O+OF2
(5)卤素单质的特殊性
1Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
2I2易 ,淀粉遇I2变 ,食盐中加入的是 。
3Br2和I2都可被某些有机溶剂如四氯化碳、苯萃取。
4F无正价,F2与水剧烈反应,F无含氧酸。
元素非金属性的判断依据
(1)非金属单质与氢气化合的难易程度:越容易,非金属性越 。
(2)与氢气化合生成的气态氢化物稳定性越强,非金属性越 。
(3)最高价氧化物对应水化物酸性越强,非金属性越 。
(4)单质间的置换反应:强制弱
(5)非金属阴离子还原性越弱,元素非金属性越 。
【归纳总结】同主族最外层电子数 ,原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 。
【课堂练习】5.部分卤族元素的某种性质A随核电荷数的变化趋势如图,A可能
表示( )
A.原子半径 B.氢化物的稳定性
C.原子的电子层数 D.单质的密度
6.X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属比Y强的是 ( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
7.已知常温下氯酸钾与浓盐酸反应放出氯气,现进行氯气的性质实验(如图)。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
【巩固练习】1.依据下列说法来判断相应元素的金属性、非金属性强弱,
不合理的是( )
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物 NH3、H2O、HF的稳定性
C.碱金属单质 Li、Na、K与水反应的剧烈程度
D.1 mol Na、Mg、Al分别与足量盐酸反应时失去电子数的多少
2.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
A.钡与水反应不如钠与水反应剧烈
B.钡可以从KCl溶液中置换出钾
C.氧化性:K+>Ba2+>Na+
D.碱性:KOH>Ba(OH)2>NaOH
3.下列事实不能说明氯元素的非金属性比硫元素的非金属性强的是( )
A.氯气与氢硫酸能发生置换反应
B.HClO4的酸性比H2SO4的酸性强
C.盐酸是强酸,氢硫酸是弱酸
D.受热时,氯化氢比硫化氢稳定
“学为中心”探究式学习高效课堂导学案
年级: 高一 班别: 姓名: 制作人: 化学备课组 科目: 化学
4.1.5 卤族元素 参考答案与解析
一.卤素单质的物理性质
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 深红棕色液体 紫黑色固体
密度 逐渐增大
熔、沸点 逐渐升高
溶解性 在水中溶解度小(F2与H2O反应),在有机溶剂中溶解度大
【课堂练习】1.C
二.卤族元素的原子结构及其特点
7 得到 氧化 增大 增多 增大 得到 减弱
三.卤素单质的化学性质
(1)卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 H2+F2===2HF 很稳定
Cl2 光照或点燃 H2+Cl22HCl 较稳定
Br2 加热 H2+Br22HBr 不如氯化氢稳定
I2 不断加热 H2+I22HI 不稳定,同一条件下同时分解
递变规律 从F2到I2,与H2化合越来越难,生成的氢化物稳定性逐渐减弱,元素的非金属性逐渐减弱
【课堂练习】2.D
(2)卤素单质间的置换反应的实验探究
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为橙黄色 2Br-+Cl2===Br2+2Cl- 氧化性:Cl2>Br2>I2
振荡静置后,溶液由无色变为褐色 2I-+Cl2===I2+2Cl-
振荡静置后,溶液由无色变为褐色 2I-+Br2===I2+2Br-
【课堂练习】3.C 4.D
(5)卤素单质的特殊性: 升华 蓝色 KIO3
四.元素非金属性的判断依据:强 强 强 强
【归纳总结】相同 增多 增大 增强 减弱 增强 减弱
【课堂练习】5.B 6.C 7.C
【巩固练习】1.D
2.解析:选D 由于钡的活动性比钠强,所以钡与水反应比钠与水反应更剧烈,A错误;钡的活动性不如钾且先与水发生反应,故不能置换出钾,B错误;由于金属性:K>Ba>Na,故氧化性为Na+>Ba2+>K+,C错误;元素的金属性越强,其对应的最高价氧化物的水化物的碱性越强,则碱性KOH>Ba(OH)2>NaOH,D正确。
3.C
年级: 高一 班别: 姓名: 制作人: 化学备课组 科目: 化学
第四章 物质结构 元素周期律
4.1.5 卤族元素
Ⅰ.学习目标
1. 了解卤族元素在周期表中的位置及原子结构特征。
2. 了解卤族元素性质的相似性和递变性。
Ⅱ.导学与检测
一.卤素单质的物理性质
F2 Cl2 Br2 I2
颜色、状态 色气体 色气体 色液体 色固体
密度 逐渐
熔、沸点 逐渐
溶解性 在水中溶解度小(F2与H2O反应),在有机溶剂中溶解度大
【课堂练习】1. 下列关于碱金属和卤素单质的有关说法正确的是( )
A.随原子序数递增,碱金属密度一定增大
B.碱金属都呈银白色
C.液溴采用水封法保存
D.碘的升华是化学变化
二.卤族元素的原子结构及其特点
元素名称 氟 氯 溴 碘 砹 石田
元素符号 F Cl Br I At Ts
核电荷数 9 17 35 53 85 117
原子结构 示意图
相似性 最外层电子数都是 ,均容易 电子,具有 性。
递变性 核电荷数依次 ,电子层数依次 ,原子半径逐渐 ,越不易 电子,非金属性 。
三.卤素单质的化学性质
(1)卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处
Cl2 光照或点燃
Br2 加热
I2 不断加热
递变规律 从F2到I2,与H2化合越来越 ,生成的氢化物稳定性逐渐 ,元素的非金属性逐渐
【课堂练习】2.下列有关碱金属元素和卤素的说法中,错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属元素和卤素的熔、沸点都逐渐降低
(2)卤素单质间的置换反应的实验探究
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为 色 氧化性:
振荡静置后,溶液由无色变为 色
振荡静置后,溶液由无色变为 色
提醒:因为F2能与H2O发生反应(2F2 + 2H2O = 4HF + O2)
所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
【课堂练习】3.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是 ( )
A.与H2化合能力:At2>I2 B.砹在常温为白色固体
C.砹原子的最外电子层上有7个电子 D.砹能从NaCl溶液中置换出氯单质
4.下列有关卤族元素的叙述不正确的是( )
A.卤素单质从F2到I2,颜色加深,熔沸点升高
B.卤族元素从Cl到I,对应氢化物的稳定性减弱
C.卤族元素从F到I,HX水溶液酸性增强
D.卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从 它的盐溶液中置换出来
(3) 卤素单质间与水的反应
通式:X2+H2O HX+HXO X2为Cl2、Br2、I2
注意:2F2 + 2H2O === 4HF + O2
卤素单质间与碱的反应
通式:X2 +2NaOH== NaX+NaXO+H2O X2为Cl2、Br2、I2
特例:2F2+2NaOH == 2NaF+H2O+OF2
(5)卤素单质的特殊性
1Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
2I2易 ,淀粉遇I2变 ,食盐中加入的是 。
3Br2和I2都可被某些有机溶剂如四氯化碳、苯萃取。
4F无正价,F2与水剧烈反应,F无含氧酸。
元素非金属性的判断依据
(1)非金属单质与氢气化合的难易程度:越容易,非金属性越 。
(2)与氢气化合生成的气态氢化物稳定性越强,非金属性越 。
(3)最高价氧化物对应水化物酸性越强,非金属性越 。
(4)单质间的置换反应:强制弱
(5)非金属阴离子还原性越弱,元素非金属性越 。
【归纳总结】同主族最外层电子数 ,原子核外电子层数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 。
【课堂练习】5.部分卤族元素的某种性质A随核电荷数的变化趋势如图,A可能
表示( )
A.原子半径 B.氢化物的稳定性
C.原子的电子层数 D.单质的密度
6.X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属比Y强的是 ( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
7.已知常温下氯酸钾与浓盐酸反应放出氯气,现进行氯气的性质实验(如图)。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
【巩固练习】1.依据下列说法来判断相应元素的金属性、非金属性强弱,
不合理的是( )
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物 NH3、H2O、HF的稳定性
C.碱金属单质 Li、Na、K与水反应的剧烈程度
D.1 mol Na、Mg、Al分别与足量盐酸反应时失去电子数的多少
2.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
A.钡与水反应不如钠与水反应剧烈
B.钡可以从KCl溶液中置换出钾
C.氧化性:K+>Ba2+>Na+
D.碱性:KOH>Ba(OH)2>NaOH
3.下列事实不能说明氯元素的非金属性比硫元素的非金属性强的是( )
A.氯气与氢硫酸能发生置换反应
B.HClO4的酸性比H2SO4的酸性强
C.盐酸是强酸,氢硫酸是弱酸
D.受热时,氯化氢比硫化氢稳定
“学为中心”探究式学习高效课堂导学案
年级: 高一 班别: 姓名: 制作人: 化学备课组 科目: 化学
4.1.5 卤族元素 参考答案与解析
一.卤素单质的物理性质
F2 Cl2 Br2 I2
颜色、状态 淡黄绿色气体 黄绿色气体 深红棕色液体 紫黑色固体
密度 逐渐增大
熔、沸点 逐渐升高
溶解性 在水中溶解度小(F2与H2O反应),在有机溶剂中溶解度大
【课堂练习】1.C
二.卤族元素的原子结构及其特点
7 得到 氧化 增大 增多 增大 得到 减弱
三.卤素单质的化学性质
(1)卤素单质与氢气反应
卤素单质 反应条件 化学方程式 产物稳定性
F2 暗处 H2+F2===2HF 很稳定
Cl2 光照或点燃 H2+Cl22HCl 较稳定
Br2 加热 H2+Br22HBr 不如氯化氢稳定
I2 不断加热 H2+I22HI 不稳定,同一条件下同时分解
递变规律 从F2到I2,与H2化合越来越难,生成的氢化物稳定性逐渐减弱,元素的非金属性逐渐减弱
【课堂练习】2.D
(2)卤素单质间的置换反应的实验探究
实验操作 实验现象 离子方程式 结论
振荡静置后,溶液由无色变为橙黄色 2Br-+Cl2===Br2+2Cl- 氧化性:Cl2>Br2>I2
振荡静置后,溶液由无色变为褐色 2I-+Cl2===I2+2Cl-
振荡静置后,溶液由无色变为褐色 2I-+Br2===I2+2Br-
【课堂练习】3.C 4.D
(5)卤素单质的特殊性: 升华 蓝色 KIO3
四.元素非金属性的判断依据:强 强 强 强
【归纳总结】相同 增多 增大 增强 减弱 增强 减弱
【课堂练习】5.B 6.C 7.C
【巩固练习】1.D
2.解析:选D 由于钡的活动性比钠强,所以钡与水反应比钠与水反应更剧烈,A错误;钡的活动性不如钾且先与水发生反应,故不能置换出钾,B错误;由于金属性:K>Ba>Na,故氧化性为Na+>Ba2+>K+,C错误;元素的金属性越强,其对应的最高价氧化物的水化物的碱性越强,则碱性KOH>Ba(OH)2>NaOH,D正确。
3.C
