3.2硫的转化(共15张ppt)鲁科版高中化学必修一
文档属性
| 名称 | 3.2硫的转化(共15张ppt)鲁科版高中化学必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 475.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-27 16:00:56 | ||
图片预览




文档简介
(共15张PPT)
第三章第2节
硫的转化
自然界中的硫
PART ONE
学习目标
·含硫物质在自然界中的存在
·硫元素在自然界中的转化
·硫的物理性质、化学性质
·硫的同素异形体
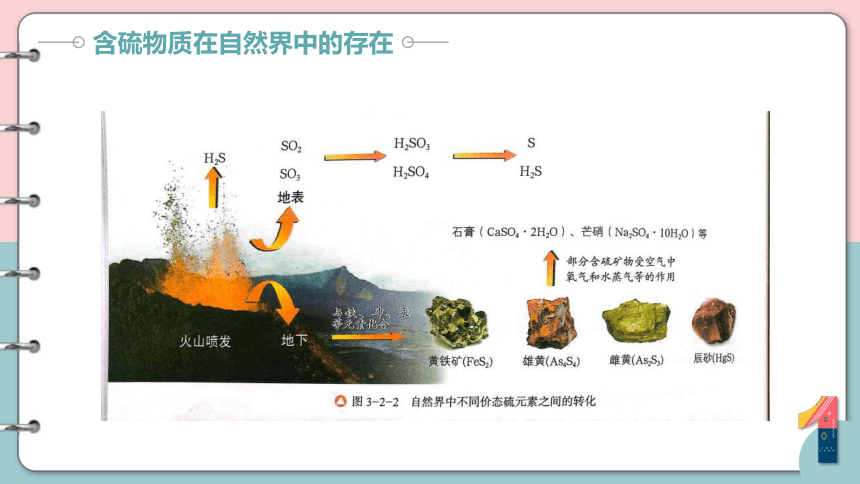
含硫物质在自然界中的存在
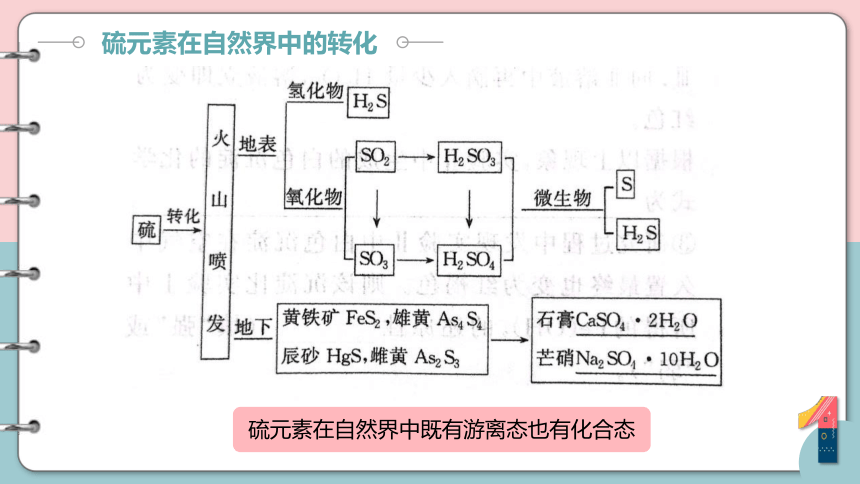
硫元素在自然界中的转化
硫元素在自然界中既有游离态也有化合态
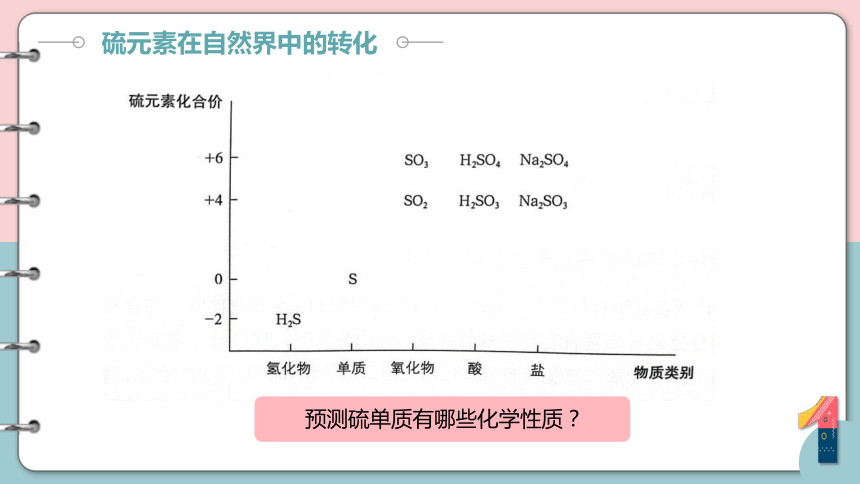
硫元素在自然界中的转化
预测硫单质有哪些化学性质?
硫单质的化学性质
S单质
物质类别
化合价
非金属单质
0价
与金属反应
与其他非金属反应
作氧化剂:与还原剂反应
作还原剂:与氧化剂反应
如:Fe、Cu、Na
如:O2、H2
如:Fe、Cu、Na
如:O2、浓HNO3
浓H2SO4
硫单质的化学性质
验证 实验 现象 方程式
硫具有 氧化性 把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状。用灼热的玻璃棒触及一端,当混合物色固体呈红热状态时移开玻璃棒 混合物一端红热,直到整混合均匀,结成黑色固体 Fe+S=FeS
硫具有还原性 取少量硫粉放入燃烧匙中,在酒精灯火焰上加热至硫粉熔化并燃烧,迅速伸入盛有氧气的集气瓶中 发出明亮的蓝紫色火焰,放出大量的热,生成一种有刺激性气味的气体 S+O2=SO2
放热反应
点燃
化学性质总结
氧化性 与金属反应 Fe+S=FeS
2Cu+S=Cu2S
2Na+S=Na2S
与非金属反应 H2+S=H2S
黑火药反应 S+2KNO3+3C=K2S+3CO2 +N2
还原性 与非金属反应 S+O2=SO2
与氧化性酸反应 S+6HNO3(浓)=H2SO4+6NO2 +2H2O
S+2H2SO4(浓)=3SO2 +2H2O
既表现氧化性 又表现还原性 与热的碱溶液反应 3S+6NaOH=2Na2S+Na2SO3+3H2O
点燃
点燃
研磨
2H2S+O2=2S +2H2O
硫单质的物理性质
实验:取少量硫粉放入试管中,观察它的颜色、状态;在酒精灯上加热,
观察发生的现象。
硫单质在常温下为淡黄色,熔点低
硫单质俗称硫磺
通常情况下,是一种淡黄色或黄色固体
很脆,易研磨成粉末
不溶于水,微溶于酒精、易溶于二硫化碳(CS2)
熔点和沸点都不高
化学性质总结
氧化性 与金属反应 Fe+S=FeS
2Cu+S=Cu2S
2Na+S=Na2S
与非金属反应 H2+S=H2S
黑火药反应 S+2KNO3+3C=K2S+3CO2 +N2
还原性 与非金属反应 S+O2=SO2
与氧化性酸反应 S+6HNO3(浓)=H2SO4+6NO2 +2H2O
S+2H2SO4(浓)=3SO2 +2H2O
既表现氧化性 又表现还原性 与热的碱溶液反应 3S+6NaOH=2Na2S+Na2SO3+3H2O
点燃
点燃
研磨
2H2S+O2=2S +2H2O
清洗硫
硫单质的同素异形体
正交硫
单斜硫
与硫有关的“颜色、气味”
① 硫单质颜色是黄色或淡黄色
② 硫在空气中燃烧是淡蓝色火焰,在纯氧中燃烧是蓝紫色火焰
③ S和Fe、Cu反应的产物FeS、Cu2S都是黑色的固体
④ SO2有刺激性气味,H2S有臭鸡蛋气味
硫单质的应用
练习
下列有关硫单质的说法中正确的是( )
A. 硫单质具有氧化性,故铁粉和硫粉共热可生成Fe2S3
B. 硫单质与金属或非金属反应时均作氧化剂
C. 黑火药中的KNO3、C、S可用水、CS2作溶剂,用过滤等操作分离
D.硫单质在充足的O2中燃烧的化学方程式为2S+3O2=2SO3
C
点燃
第三章第2节
硫的转化
自然界中的硫
PART ONE
学习目标
·含硫物质在自然界中的存在
·硫元素在自然界中的转化
·硫的物理性质、化学性质
·硫的同素异形体
含硫物质在自然界中的存在
硫元素在自然界中的转化
硫元素在自然界中既有游离态也有化合态
硫元素在自然界中的转化
预测硫单质有哪些化学性质?
硫单质的化学性质
S单质
物质类别
化合价
非金属单质
0价
与金属反应
与其他非金属反应
作氧化剂:与还原剂反应
作还原剂:与氧化剂反应
如:Fe、Cu、Na
如:O2、H2
如:Fe、Cu、Na
如:O2、浓HNO3
浓H2SO4
硫单质的化学性质
验证 实验 现象 方程式
硫具有 氧化性 把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状。用灼热的玻璃棒触及一端,当混合物色固体呈红热状态时移开玻璃棒 混合物一端红热,直到整混合均匀,结成黑色固体 Fe+S=FeS
硫具有还原性 取少量硫粉放入燃烧匙中,在酒精灯火焰上加热至硫粉熔化并燃烧,迅速伸入盛有氧气的集气瓶中 发出明亮的蓝紫色火焰,放出大量的热,生成一种有刺激性气味的气体 S+O2=SO2
放热反应
点燃
化学性质总结
氧化性 与金属反应 Fe+S=FeS
2Cu+S=Cu2S
2Na+S=Na2S
与非金属反应 H2+S=H2S
黑火药反应 S+2KNO3+3C=K2S+3CO2 +N2
还原性 与非金属反应 S+O2=SO2
与氧化性酸反应 S+6HNO3(浓)=H2SO4+6NO2 +2H2O
S+2H2SO4(浓)=3SO2 +2H2O
既表现氧化性 又表现还原性 与热的碱溶液反应 3S+6NaOH=2Na2S+Na2SO3+3H2O
点燃
点燃
研磨
2H2S+O2=2S +2H2O
硫单质的物理性质
实验:取少量硫粉放入试管中,观察它的颜色、状态;在酒精灯上加热,
观察发生的现象。
硫单质在常温下为淡黄色,熔点低
硫单质俗称硫磺
通常情况下,是一种淡黄色或黄色固体
很脆,易研磨成粉末
不溶于水,微溶于酒精、易溶于二硫化碳(CS2)
熔点和沸点都不高
化学性质总结
氧化性 与金属反应 Fe+S=FeS
2Cu+S=Cu2S
2Na+S=Na2S
与非金属反应 H2+S=H2S
黑火药反应 S+2KNO3+3C=K2S+3CO2 +N2
还原性 与非金属反应 S+O2=SO2
与氧化性酸反应 S+6HNO3(浓)=H2SO4+6NO2 +2H2O
S+2H2SO4(浓)=3SO2 +2H2O
既表现氧化性 又表现还原性 与热的碱溶液反应 3S+6NaOH=2Na2S+Na2SO3+3H2O
点燃
点燃
研磨
2H2S+O2=2S +2H2O
清洗硫
硫单质的同素异形体
正交硫
单斜硫
与硫有关的“颜色、气味”
① 硫单质颜色是黄色或淡黄色
② 硫在空气中燃烧是淡蓝色火焰,在纯氧中燃烧是蓝紫色火焰
③ S和Fe、Cu反应的产物FeS、Cu2S都是黑色的固体
④ SO2有刺激性气味,H2S有臭鸡蛋气味
硫单质的应用
练习
下列有关硫单质的说法中正确的是( )
A. 硫单质具有氧化性,故铁粉和硫粉共热可生成Fe2S3
B. 硫单质与金属或非金属反应时均作氧化剂
C. 黑火药中的KNO3、C、S可用水、CS2作溶剂,用过滤等操作分离
D.硫单质在充足的O2中燃烧的化学方程式为2S+3O2=2SO3
C
点燃
