2024-2025学年高考化学二轮专项突破卷四 化学反应与能量(含解析)
文档属性
| 名称 | 2024-2025学年高考化学二轮专项突破卷四 化学反应与能量(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 613.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-28 00:47:20 | ||
图片预览


文档简介
专项突破卷四 化学反应与能量
(90分钟 100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55 Cu 64 Zn 65
第Ⅰ卷 (选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分,请你选出一个最符合题意的答案)
1.下列过程能实现将化学能转化为电能的是
A.电池充电 B.光合作用
C.手机电池工作 D.太阳能板充电
2.下列诗句中不包含放热反应的是
A.只要功夫深,铁杵磨成针 B.煮豆燃豆萁,豆在釜中泣
C.爆竹声中一岁除,春风送暖入屠苏 D.火树银花合,星桥铁锁开
3.一定条件下,二氧化碳与氢气反应可制得甲烷。已知:
①CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
②2CO(g)+2H2(g)CO2(g)+CH4(g) ΔH=-247.1 kJ·mol-1
③常见物质的化学键的键能如下表:
化学键 CO H—H C—H H—O
键能/(kJ·mol-1) a 436 414 464
则a为
A.801.65 B.784.25 C.730.05 D.680.65
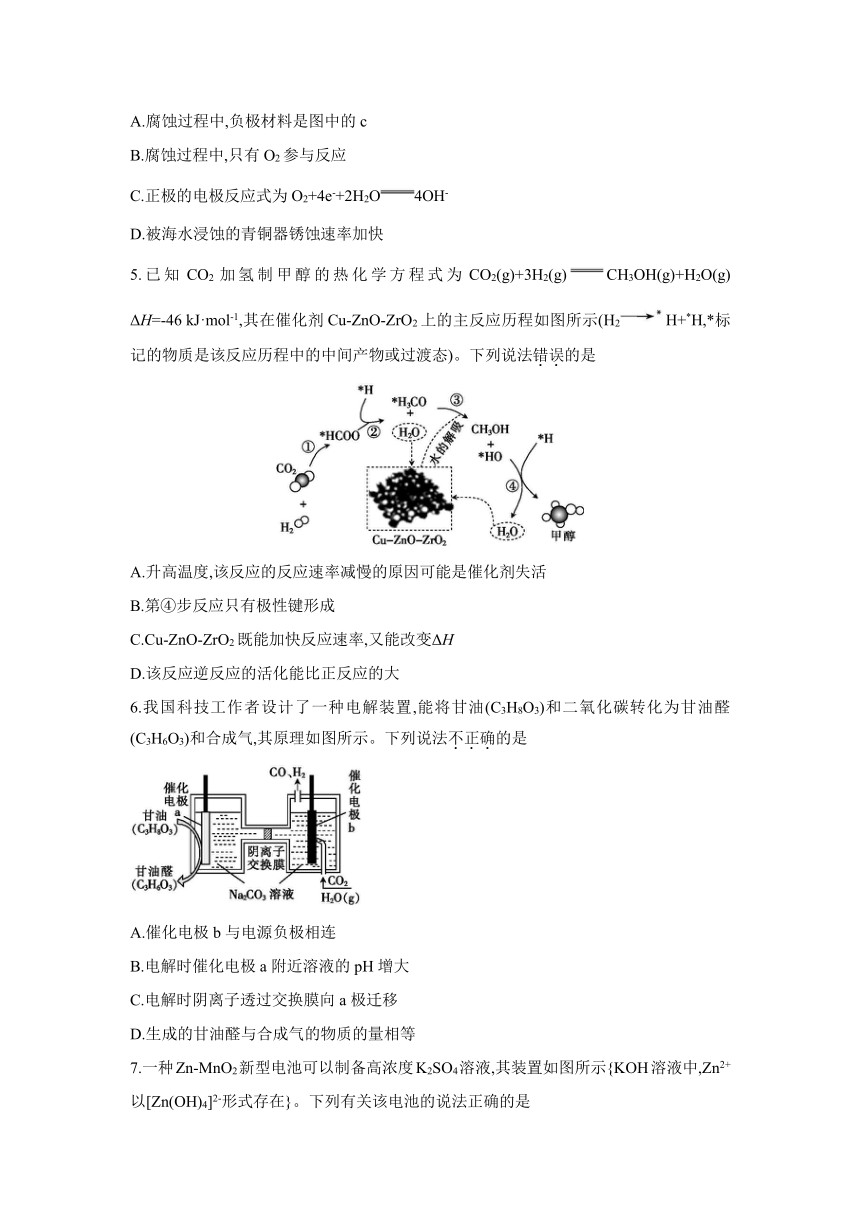
4.2021年三星堆遗址重启考古挖掘工作,“青铜神树”的面世再一次震惊世界。青铜器出土呈青色是因为在潮湿环境中青铜发生了电化学腐蚀,其原理如图所示。下列说法不正确的是
A.腐蚀过程中,负极材料是图中的c
B.腐蚀过程中,只有O2参与反应
C.正极的电极反应式为O2+4e-+2H2O4OH-
D.被海水浸蚀的青铜器锈蚀速率加快
5.已知CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-46 kJ·mol-1,其在催化剂Cu-ZnO-ZrO2上的主反应历程如图所示(H2H+*H,*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
A.升高温度,该反应的反应速率减慢的原因可能是催化剂失活
B.第④步反应只有极性键形成
C.Cu-ZnO-ZrO2既能加快反应速率,又能改变ΔH
D.该反应逆反应的活化能比正反应的大
6.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,其原理如图所示。下列说法不正确的是
A.催化电极b与电源负极相连
B.电解时催化电极a附近溶液的pH增大
C.电解时阴离子透过交换膜向a极迁移
D.生成的甘油醛与合成气的物质的量相等
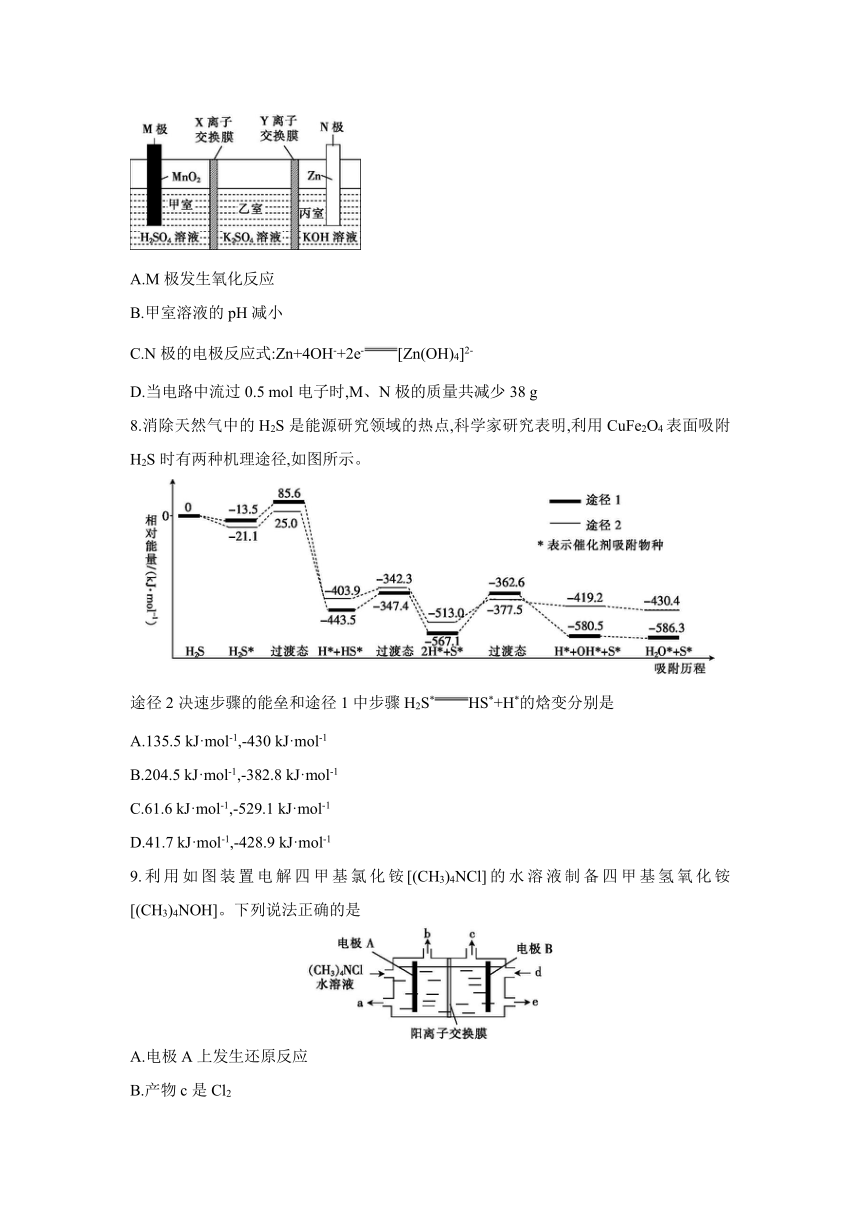
7.一种Zn-MnO2新型电池可以制备高浓度K2SO4溶液,其装置如图所示{KOH溶液中,Zn2+以[Zn(OH)4]2-形式存在}。下列有关该电池的说法正确的是
A.M极发生氧化反应
B.甲室溶液的pH减小
C.N极的电极反应式:Zn+4OH-+2e-[Zn(OH)4]2-
D.当电路中流过0.5 mol电子时,M、N极的质量共减少38 g
8.消除天然气中的H2S是能源研究领域的热点,科学家研究表明,利用CuFe2O4表面吸附H2S时有两种机理途径,如图所示。
途径2决速步骤的能垒和途径1中步骤H2S*HS*+H*的焓变分别是
A.135.5 kJ·mol-1,-430 kJ·mol-1
B.204.5 kJ·mol-1,-382.8 kJ·mol-1
C.61.6 kJ·mol-1,-529.1 kJ·mol-1
D.41.7 kJ·mol-1,-428.9 kJ·mol-1
9.利用如图装置电解四甲基氯化铵[(CH3)4NCl]的水溶液制备四甲基氢氧化铵[(CH3)4NOH]。下列说法正确的是
A.电极A上发生还原反应
B.产物c是Cl2
C.a处可收集(CH3)4NOH
D.阳离子交换膜可提高(CH3)4NOH的纯度
10.右图是以KCl、NaNO3为原料制取KNO3和NaCl的电化学装置,
A膜为阴离子交换膜,C膜为阳离子交换膜,M、N为电极。下列有关说法中错误的是
A.电源a极的电势比b极的低
B.X溶液为KNO3溶液
C.Ⅲ室中N通过膜A移向Ⅱ室,Ⅴ室中Cl-通过膜A移向Ⅳ室
D.电解总反应:2Cl-+2H2OCl2↑+H2↑+2OH-
11.以下是镍催化乙烯与氢气的反应机理示意图。下列说法正确的是
A.催化剂可加快反应速率,降低反应的能量变化
B.过程②释放能量,过程③④吸收能量
C.反应中有非极性键的断裂、极性键的形成
D.催化剂在反应过程中质量和性质均会改变
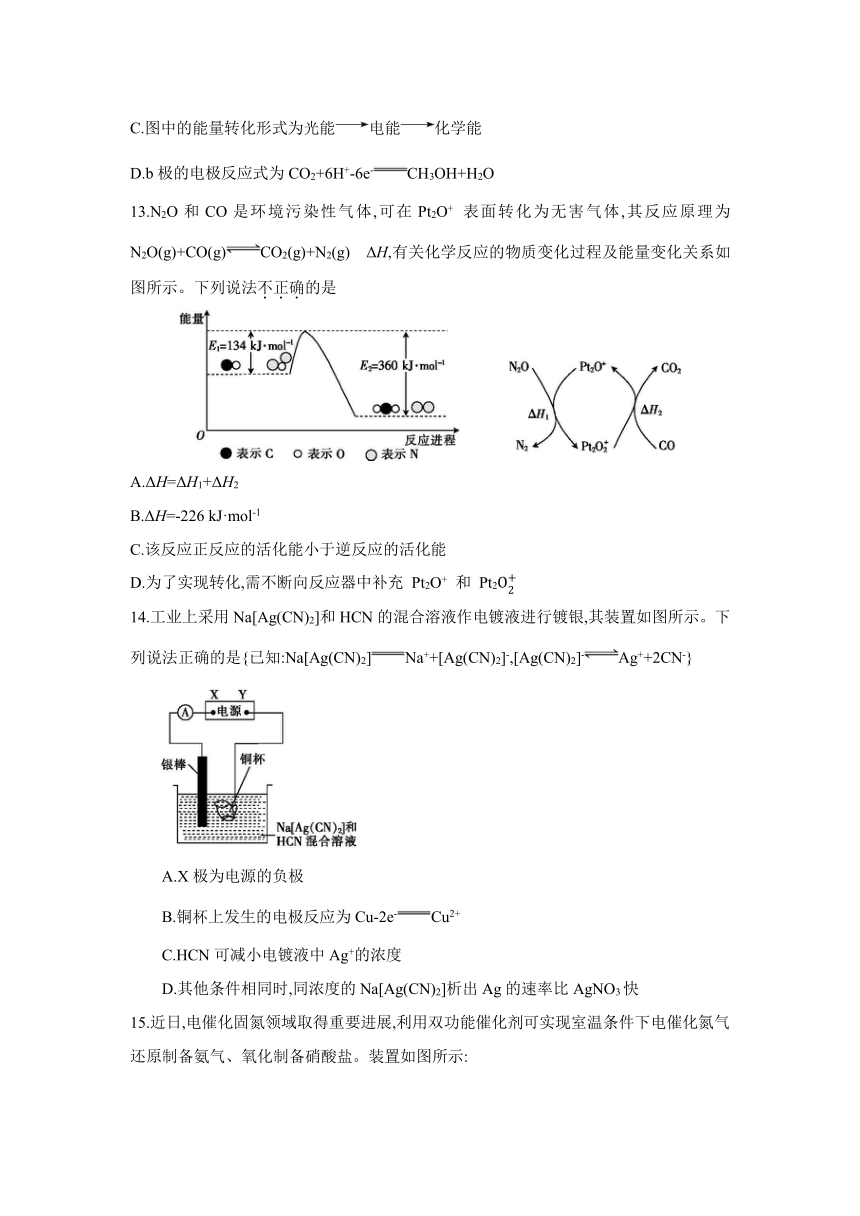
12.CO2一定条件下可转化为CH3OH,电化学装置如图所示。下列说法正确的是
A.若导线上有4 mol电子移动,则质子交换膜左侧产生22.4 L O2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图中的能量转化形式为光能电能化学能
D.b极的电极反应式为CO2+6H+-6e-CH3OH+H2O
13.N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g)+CO(g)CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化关系如图所示。下列说法不正确的是
A.ΔH=ΔH1+ΔH2
B.ΔH=-226 kJ·mol-1
C.该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充 Pt2O+ 和 Pt2
14.工业上采用Na[Ag(CN)2]和HCN的混合溶液作电镀液进行镀银,其装置如图所示。下列说法正确的是{已知:Na[Ag(CN)2]Na++[Ag(CN)2]-,[Ag(CN)2]-Ag++2CN-}
A.X极为电源的负极
B.铜杯上发生的电极反应为Cu-2e-Cu2+
C.HCN可减小电镀液中Ag+的浓度
D.其他条件相同时,同浓度的Na[Ag(CN)2]析出Ag的速率比AgNO3快
15.近日,电催化固氮领域取得重要进展,利用双功能催化剂可实现室温条件下电催化氮气还原制备氨气、氧化制备硝酸盐。装置如图所示:
下列说法错误的是
A.a极与电源负极相连
B.b极发生氧化反应
C.阴极区的电极反应为N2+3H2O+6e-2NH3+6OH-
D.H+由右室通过交换膜向左室迁移
题序 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
第Ⅱ卷 (非选择题 共55分)
二、非选择题(本题包括5小题,共55分)
16.(11分)为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置。
(1)①题给装置中,不能用来探究“钠和无水乙醇反应是吸热反应还是放热反应”的是 (填字母)。
②某同学选用装置A进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体,搅拌,U形管中可观察到的现象是 ,说明该反应为 (填“放热反应”或“吸热反应”);若换成生石灰和水,则U形管中可观察到的现象是 。
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2 L甲烷在氧气中充分燃烧生成液态水和二氧化碳时释放出445 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
②已知传统热裂解法制乙烯的反应为CH3—CH3(g)CH2CH2(g)+H2(g) ΔH1,有关化学键的键能如表所示:
化学键 C—H CC C—C H—H
键能/(kJ·mol-1) 414 615 347 435
通过计算得出该反应的焓变ΔH1= 。
③现代的氧化裂解法制乙烯的反应的热化学方程式如下:
C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH2=-110 kJ·mol-1
通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是 (任写一点)。
17.(12分)《打赢蓝天保卫战三年行动计划》如期圆满收官,氮氧化物排放量大幅度减少。
(1)已知汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 N2(g)2N(g) O2(g)2O(g) N(g)+O(g)NO(g)
反应热 ΔH1 ΔH2 ΔH3
热量值/(kJ·mol-1) 945 498 630
①ΔH1 0,ΔH3 0。(填“>”或“<”)
②N2(g)+O2(g)2NO(g) ΔH= kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染气体,其热化学方程式为4NH3 (g)+6NO(g)5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1。下列能表示该反应中能量变化的是 (填字母)。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下1.12 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
18.(8分)化学知识的学习是在不断探究的过程中形成的。下列是几组同学对电化学知识的探讨。
(1)甲小组探究电解饱和CuCl2溶液的阳极产物。用图1所示装置电解饱和CuCl2溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成。用于检验阳极产物的试剂是 。
(2)乙小组通过观察电流表的指针偏转探究电极上发生的氧化还原反应。连接装置(如图2所示),断开开关K时,将铝片和铜片同时插入稀硫酸中,Al表面产生大量无色气泡,Cu表面无明显变化;闭合开关K,电流表指针向右偏转,Al和Cu表面均产生大量无色气泡。
①该电池的负极是 (填“Al”或“Cu”)。
②用化学用语表示Cu表面产生无色气泡的原因: 。
③该小组同学将图2装置中的稀硫酸换成浓硝酸,铝电极换成铁电极,两极均产生大量红棕色气体。改进实验装置(如图3所示),闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转,此时外电路中电流方向为 。
19.(13分)人们运用原电池原理制作了多种电池,以满足不同的需求。以下各种电池广泛运用于日常生活、生产和科学技术等领域,请根据题中提供的信息填空:
(1)锂硒电池具有优异的循环稳定性。
①一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为 。
②Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是 。
(2)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作 极。比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣,则Na、Mg、Al分别作为电极时比能量由大到小的顺序为 。
(3)全钒液流电池充电时间短,续航能力强,被誉为“完美电池”。图3是钒电池基本工作原理示意图,电池总反应为VO2++V3++H2OV2++V+2H+,放电时,H+由B区通过质子交换膜移动到A区。
①放电时,A区为电池的 (填“正极”或“负极”)区,B区电解液含有的含钒离子为 。
②充电时,B区溶液pH (填“增大”、“减小”或“不变”),A区发生的电极反应为 。
20.(11分)甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)已知在常温常压下:①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1,②H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1。写出表示甲醇燃烧热的热化学方程式: 。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25 ℃、101 kPa时,0.2 mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ热量。相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是 (填“甲醇”或“辛烷”)。
(2)已知:CH3OH(g)+O2(g)CO2(g)+2H2(g) ΔH1=-192.9 kJ·mol-1;H2(g)+O2(g)H2O(g) ΔH2=-241.8 kJ·mol-1。
则甲醇与水蒸气催化重整反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)的焓变ΔH3= 。
(3)CH3OH(l)+O2(g)CO(g)+2H2O(g) ΔH=-393 kJ·mol-1,该反应相关化学键键能数据如表所示,则x= 。
化学键 OO C—O (CO) H—O C—H
E/(kJ·mol-1) 496 343 x 465 413
Ⅱ.甲醇的合成
(4)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
②H2O(l)H2O(g) ΔH3=+44.0 kJ·mol-1。
反应Ⅱ的ΔH2= kJ·mol-1。
参考答案
1.C 解析:A项,电池充电是将电能转化为化学能;B项,光合作用是将太阳能转化为化学能;D项,太阳能板充电是将太阳能转化为电能。
2.A 解析:铁杵磨成针只是物质形态发生变化,没有新物质生成,所以属于物理变化,不是放热反应,A项符合题意;“豆箕”是大豆的秸秆,主要成分为纤维素,纤维素燃烧是将化学能转化为热能,B项不符合题意;“爆竹声中一岁除,春风送暖入屠苏”中火药爆炸为氧化还原反应,生成二氧化碳、二氧化硫等物质,属于放热反应,C项不符合题意;“火树银花”描述的是灯光和焰火,发生了燃烧反应,化学能转化成热能,D项不符合题意。
3.A 解析:根据盖斯定律可得CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-164.7 kJ·mol-1,ΔH=反应物总键能-生成物总键能,可解得a=801.65,A项正确。
4.B 解析:由图示可得,铜失电子,作负极,A项正确;铜的腐蚀产物为绿色的碱式碳酸铜,氧气、水蒸气、二氧化碳均参与反应,B项错误;正极上氧气得电子,正极反应式为O2+4e-+2H2O4OH-,C项正确;海水中有电解质,使得原电池反应速率加快,锈蚀加速,D项正确。
5.C 解析:升高温度,只有催化剂失活该反应的反应速率才会减慢,A项正确;第④步反应是*H+*HOH2O,形成H—O键,B项正确;催化剂Cu-ZnO-ZrO2能加快反应速率,但不能改变ΔH,C项错误;该反应的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-46 kJ·mol-1,所以逆反应的活化能比正反应的大,D项正确。
6.B 解析:由示意图可知,催化电极b表面上CO2被还原为CO,为电解池的阴极,与电源的负极相连,A项正确;催化电极a为阳极,电极表面上甘油(C3H8O3)被氧化为甘油醛(C3H6O3),电极反应式为C3H8O3-2e-+2CC3H6O3+2HC,溶液中C的水解程度大于HC的,碳酸钠溶液的碱性强于碳酸氢钠溶液,则电极a附近溶液的pH减小,B项错误;电解池工作时,阴离子向阳极区移动,即阴离子透过交换膜向a极迁移,C项正确;阳极上生成1 mol C3H6O3转移2 mol e-,阴极上生成1 mol CO和H2的混合气体转移2 mol e-,电解池工作时,阴、阳极转移电子的物质的量相等,则生成的甘油醛与合成气的物质的量相等,D项正确。
7.D 解析:根据图示的电池结构和题目所给信息可知,N极为电池的负极,电极反应式为Zn-2e-+4OH-[Zn(OH)4]2-。M极为电池的正极,电极反应式为MnO2+2e-+4H+Mn2++2H2O。M极为电池的正极,发生还原反应,A项错误;甲室电极反应式为MnO2+2e-+4H+Mn2++2H2O,消耗H+,溶液的pH增大,B项错误;N极的电极反应式为Zn-2e-+4OH-[Zn(OH)4]2-,C项错误;根据两极反应式可知,当电路中流过0.5 mol电子时,M极减少的质量为87 g·mol-1×0.25 mol=21.75 g,N极减少的质量为65 g·mol-1×0.25 mol=16.25 g,即总共减少的质量为21.75 g+16.25 g=38 g,D项正确。
8.A 解析:活化能越大,反应速率越慢,反应速率最慢的反应制约反应速率,由图可知途径2最大能垒为[-377.5-(-513.0)] kJ·mol-1=135.5 kJ·mol-1,途径1中步骤H2S*HS*+H*的焓变为[-443.5-(-13.5)] kJ·mol-1=-430 kJ·mol-1,A项正确。
9.D 解析:该电解池中,阳极反应式为2Cl--2e-Cl2↑,阴极反应式为2H2O+2e-H2↑+2OH-,中间为阳离子交换膜,则四甲基铵根离子通过交换膜进入阴极区生成(CH3)4NOH,所以B为阴极,生成的c是氢气,A为阳极,生成的b为氯气。综上所述,D项正确。
10.A 解析:M极通入KCl溶液,N极通入NaNO3溶液,整个过程电解制取KNO3和NaCl,则M极上Cl-放电,故M极为阳极,N极为阴极,阴极反应式为2H2O+2e-H2↑+2OH-,阳极反应式为2Cl--2e-Cl2↑,Ⅰ室与Ⅴ室均通入KCl溶液,Ⅶ室与Ⅲ室均通入NaNO3溶液,由于阳离子向阴极移动,阴离子向阳极移动,Ⅲ室中N通过膜A移向Ⅱ室,Na+通过膜C移向中间室(Ⅳ室),Ⅴ室中Cl-通过膜A移向中间室(Ⅳ室),K+通过膜C移向Ⅵ室,在Ⅳ室获得NaCl,则Ⅱ室、Ⅵ室获得KNO3。a为电源的正极,b为电源的负极,所以a极电势比b极高,A项错误;根据分析,可知X溶液为KNO3溶液,B项正确;根据分析,可知Ⅲ室中N通过膜A移向Ⅱ室,Ⅴ室中Cl-通过膜A移向Ⅳ室,C项正确;电解总反应:2Cl-+2H2OCl2↑+H2↑+2OH-,D项正确。
11.C 解析:催化剂可改变反应的活化能,但不能降低能量变化,A项错误;过程②断裂化学键吸收能量,过程③④形成化学键释放能量,B项错误;H—H是非极性键,C—H是极性键,因此反应中有非极性键的断裂、极性键的形成,C项正确;催化剂在化学反应中质量和化学性质均没有改变,D项错误。
12.C 解析:若导线上有4 mol电子移动,根据原电池的正极2H2O~O2~4e-,质子交换膜左侧产生1 mol O2,没有指明状态,无法计算体积,A项错误;装置中进行的反应是通过光能完成的,不是自发的氧化还原反应,B项错误;图中的能量转化形式为光能电能化学能,C项正确;b极为原电池的正极,其电极反应式为CO2+6H++6e-CH3OH+H2O,D项错误。
13.D 解析:①N2O+Pt2O+Pt2+N2 ΔH1,②Pt2+COPt2O++CO2 ΔH2,结合盖斯定律由①+②得到N2O(g)+CO(g)CO2(g)+N2(g) ΔH=ΔH1+ΔH2,A项正确;由图示分析可知,反应物的能量高于生成物,反应为放热反应,反应焓变ΔH=生成物总焓-反应物总焓=134 kJ·mol-1-360 kJ·mol-1=-226 kJ·mol-1,B项正确;正反应活化能E1=134 kJ·mol-1小于逆反应活化能E2=360 kJ·mol-1, C项正确;①N2O+Pt2O+Pt2+N2 ΔH1,②Pt2+COPt2O++CO2 ΔH2,反应过程中Pt2O+和Pt2 参与反应,后又生成,不需要补充,D项错误。
14.C 解析:银棒作电镀池的阳极,发生的电极反应为Ag-e-Ag+,故X极为电源的正极,A项错误;铜杯表面实现镀银,表面发生的电极反应为Ag++e-Ag,B项错误;由于HCNH++CN-,抑制反应[Ag(CN)2]-Ag++2CN-正向进行,C项正确;相同浓度时,[Ag(CN)2]-比AgNO3更难电离,溶液中Ag+的浓度相对较小,D项错误。
15.C 解析:根据图示可知,a极为阴极,b极为阳极,b极发生氧化反应,a极与负极相连,A、B两项均正确;阴极区的电极反应为N2+6H++6e-2NH3,C项错误;H+由右室通过交换膜向左室迁移,D项正确。
16.(1)①C(2分)
②左端液面升高,右端液面降低(1分);吸热反应(1分);左端液面降低,右端液面升高(1分)
(2)①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1(2分)
②+125 kJ·mol-1(2分)
③氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大)(2分)
解析:(2)②CH3—CH3(g)CH2CH2(g)+H2(g) ΔH=反应物的总键能-生成物的总键能=6×414 kJ·mol-1+347 kJ·mol-1-(4×414 kJ·mol-1+615 kJ·mol-1+435 kJ·mol-1)=+125 kJ·mol-1。
17.(1)①>(2分);<(2分)
②+183(2分)
(2)C(2分)
(3)0.1(2分);(2a+b)/80(2分)
解析:(1)①N2(g)2N(g)是断裂化学键的过程,吸收能量,ΔH1>0,N(g)+O(g)NO(g)是形成化学键的过程,放出能量,ΔH3<0。
②Ⅰ.N2(g)2N(g) ΔH1=+945 kJ·mol-1;
Ⅱ.O2(g)2O(g) ΔH2=+498 kJ·mol-1;
Ⅲ.N(g)+O(g)NO(g) ΔH3=-630 kJ·mol-1;
根据盖斯定律,由Ⅰ+Ⅱ+2×Ⅲ得到N2(g)+O2(g)2NO(g) ΔH=+183 kJ·mol-1。
(2)4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值,为-1807.98 kJ·mol-1。
(3)假设两个反应分别为①②,由①×2+②可得:4CO(g)+2NO2(g)N2(g)+4CO2(g)
ΔH=-(2a+b) kJ·mol-1,反应中转移8个电子。因此标准状况下1.12 L CO还原NO2时,转移电子的物质的量为×2=0.1 mol,放出的热量为×(2a+b) kJ=(2a+b)/80 kJ。
18.(1)湿润的淀粉-KI试纸(2分)
(2)①Al(2分)
②2H++2e-H2↑(2分)
③由Cu电极流向铁电极(2分)
19.(1)①2Li++xSe+2e-Li2Sex(2分)
②Li2Se6>Li2Se4>Li2Se(2分)
(2)负(1分);Al>Mg>Na(2分)
(3)①正极(1分);V2+、V3+(2分)
②减小(1分);VO2++H2O-e-V+2H+(2分)
解析:(1)①锂硒电池放电时,锂作负极,硒作正极,正极的电极反应式为2Li++xSe+2e-Li2Sex。
②Li2Se6、Li2Se4、Li2Se分别与正极碳基体结合时,能量依次降低,所以3种Li2Sex与碳基体的结合能力由大到小的顺序是Li2Se6>Li2Se4>Li2Se。
(2)Li-CuO二次电池中,Li失去电子,金属锂作负极,比能量是指消耗单位质量的电极所释放的电量,设三种电极的质量均为m,则×3>×2>,故Na、Mg、Al分别作为电极时比能量由大到小的顺序为Al>Mg>Na。
(3)①根据分析,正极区阳离子浓度减小,H+向正极区移动,且题目中已知H+由B区通过隔膜向A区移动,说明A区为正极区,B区为负极区;B区含有的含钒离子为V2+和V3+。
②根据分析,A区电极发生失电子的反应,A区阳离子浓度增大,H+向B区移动,B区溶液pH减小;A区的电极反应式为VO2++H2O-e-V+2H+。
20.(1)CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1(2分);辛烷(1分)
(2)+48.9 kJ·mol-1(2分)
(3)1076(3分)
(4)+41.2(3分)
解析:(1)①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1,②H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1,根据盖斯定律,①×-②×2得CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1;25 ℃、101 kPa时,0.2 mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ热量,则1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ×5=5518 kJ热量,热化学方程式为C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5518 kJ·mol-1;物质的量与热量成正比,等质量时放热多的为C8H18,热量用于煅烧石灰石制备CaO,则得到CaO多的是辛烷。
(2)根据盖斯定律和已知方程式,可得甲醇和水蒸气催化重整的方程式为①-②,所以焓变ΔH3=ΔH1-ΔH2=-192.9 kJ·mol-1+241.8 kJ·mol-1=+48.9 kJ·mol-1。
(3)ΔH=反应物的键能总和-生成物的键能总和,即-393=(3×413+343+496+465)-(x+4×465),解得x=1076。
(90分钟 100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55 Cu 64 Zn 65
第Ⅰ卷 (选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分,请你选出一个最符合题意的答案)
1.下列过程能实现将化学能转化为电能的是
A.电池充电 B.光合作用
C.手机电池工作 D.太阳能板充电
2.下列诗句中不包含放热反应的是
A.只要功夫深,铁杵磨成针 B.煮豆燃豆萁,豆在釜中泣
C.爆竹声中一岁除,春风送暖入屠苏 D.火树银花合,星桥铁锁开
3.一定条件下,二氧化碳与氢气反应可制得甲烷。已知:
①CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
②2CO(g)+2H2(g)CO2(g)+CH4(g) ΔH=-247.1 kJ·mol-1
③常见物质的化学键的键能如下表:
化学键 CO H—H C—H H—O
键能/(kJ·mol-1) a 436 414 464
则a为
A.801.65 B.784.25 C.730.05 D.680.65
4.2021年三星堆遗址重启考古挖掘工作,“青铜神树”的面世再一次震惊世界。青铜器出土呈青色是因为在潮湿环境中青铜发生了电化学腐蚀,其原理如图所示。下列说法不正确的是
A.腐蚀过程中,负极材料是图中的c
B.腐蚀过程中,只有O2参与反应
C.正极的电极反应式为O2+4e-+2H2O4OH-
D.被海水浸蚀的青铜器锈蚀速率加快
5.已知CO2加氢制甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-46 kJ·mol-1,其在催化剂Cu-ZnO-ZrO2上的主反应历程如图所示(H2H+*H,*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
A.升高温度,该反应的反应速率减慢的原因可能是催化剂失活
B.第④步反应只有极性键形成
C.Cu-ZnO-ZrO2既能加快反应速率,又能改变ΔH
D.该反应逆反应的活化能比正反应的大
6.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,其原理如图所示。下列说法不正确的是
A.催化电极b与电源负极相连
B.电解时催化电极a附近溶液的pH增大
C.电解时阴离子透过交换膜向a极迁移
D.生成的甘油醛与合成气的物质的量相等
7.一种Zn-MnO2新型电池可以制备高浓度K2SO4溶液,其装置如图所示{KOH溶液中,Zn2+以[Zn(OH)4]2-形式存在}。下列有关该电池的说法正确的是
A.M极发生氧化反应
B.甲室溶液的pH减小
C.N极的电极反应式:Zn+4OH-+2e-[Zn(OH)4]2-
D.当电路中流过0.5 mol电子时,M、N极的质量共减少38 g
8.消除天然气中的H2S是能源研究领域的热点,科学家研究表明,利用CuFe2O4表面吸附H2S时有两种机理途径,如图所示。
途径2决速步骤的能垒和途径1中步骤H2S*HS*+H*的焓变分别是
A.135.5 kJ·mol-1,-430 kJ·mol-1
B.204.5 kJ·mol-1,-382.8 kJ·mol-1
C.61.6 kJ·mol-1,-529.1 kJ·mol-1
D.41.7 kJ·mol-1,-428.9 kJ·mol-1
9.利用如图装置电解四甲基氯化铵[(CH3)4NCl]的水溶液制备四甲基氢氧化铵[(CH3)4NOH]。下列说法正确的是
A.电极A上发生还原反应
B.产物c是Cl2
C.a处可收集(CH3)4NOH
D.阳离子交换膜可提高(CH3)4NOH的纯度
10.右图是以KCl、NaNO3为原料制取KNO3和NaCl的电化学装置,
A膜为阴离子交换膜,C膜为阳离子交换膜,M、N为电极。下列有关说法中错误的是
A.电源a极的电势比b极的低
B.X溶液为KNO3溶液
C.Ⅲ室中N通过膜A移向Ⅱ室,Ⅴ室中Cl-通过膜A移向Ⅳ室
D.电解总反应:2Cl-+2H2OCl2↑+H2↑+2OH-
11.以下是镍催化乙烯与氢气的反应机理示意图。下列说法正确的是
A.催化剂可加快反应速率,降低反应的能量变化
B.过程②释放能量,过程③④吸收能量
C.反应中有非极性键的断裂、极性键的形成
D.催化剂在反应过程中质量和性质均会改变
12.CO2一定条件下可转化为CH3OH,电化学装置如图所示。下列说法正确的是
A.若导线上有4 mol电子移动,则质子交换膜左侧产生22.4 L O2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图中的能量转化形式为光能电能化学能
D.b极的电极反应式为CO2+6H+-6e-CH3OH+H2O
13.N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g)+CO(g)CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化关系如图所示。下列说法不正确的是
A.ΔH=ΔH1+ΔH2
B.ΔH=-226 kJ·mol-1
C.该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充 Pt2O+ 和 Pt2
14.工业上采用Na[Ag(CN)2]和HCN的混合溶液作电镀液进行镀银,其装置如图所示。下列说法正确的是{已知:Na[Ag(CN)2]Na++[Ag(CN)2]-,[Ag(CN)2]-Ag++2CN-}
A.X极为电源的负极
B.铜杯上发生的电极反应为Cu-2e-Cu2+
C.HCN可减小电镀液中Ag+的浓度
D.其他条件相同时,同浓度的Na[Ag(CN)2]析出Ag的速率比AgNO3快
15.近日,电催化固氮领域取得重要进展,利用双功能催化剂可实现室温条件下电催化氮气还原制备氨气、氧化制备硝酸盐。装置如图所示:
下列说法错误的是
A.a极与电源负极相连
B.b极发生氧化反应
C.阴极区的电极反应为N2+3H2O+6e-2NH3+6OH-
D.H+由右室通过交换膜向左室迁移
题序 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
第Ⅱ卷 (非选择题 共55分)
二、非选择题(本题包括5小题,共55分)
16.(11分)为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置。
(1)①题给装置中,不能用来探究“钠和无水乙醇反应是吸热反应还是放热反应”的是 (填字母)。
②某同学选用装置A进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体,搅拌,U形管中可观察到的现象是 ,说明该反应为 (填“放热反应”或“吸热反应”);若换成生石灰和水,则U形管中可观察到的现象是 。
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2 L甲烷在氧气中充分燃烧生成液态水和二氧化碳时释放出445 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
②已知传统热裂解法制乙烯的反应为CH3—CH3(g)CH2CH2(g)+H2(g) ΔH1,有关化学键的键能如表所示:
化学键 C—H CC C—C H—H
键能/(kJ·mol-1) 414 615 347 435
通过计算得出该反应的焓变ΔH1= 。
③现代的氧化裂解法制乙烯的反应的热化学方程式如下:
C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH2=-110 kJ·mol-1
通过比较ΔH1和ΔH2,说明和热裂解法相比,氧化裂解法的优点是 (任写一点)。
17.(12分)《打赢蓝天保卫战三年行动计划》如期圆满收官,氮氧化物排放量大幅度减少。
(1)已知汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 N2(g)2N(g) O2(g)2O(g) N(g)+O(g)NO(g)
反应热 ΔH1 ΔH2 ΔH3
热量值/(kJ·mol-1) 945 498 630
①ΔH1 0,ΔH3 0。(填“>”或“<”)
②N2(g)+O2(g)2NO(g) ΔH= kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染气体,其热化学方程式为4NH3 (g)+6NO(g)5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1。下列能表示该反应中能量变化的是 (填字母)。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下1.12 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
18.(8分)化学知识的学习是在不断探究的过程中形成的。下列是几组同学对电化学知识的探讨。
(1)甲小组探究电解饱和CuCl2溶液的阳极产物。用图1所示装置电解饱和CuCl2溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成。用于检验阳极产物的试剂是 。
(2)乙小组通过观察电流表的指针偏转探究电极上发生的氧化还原反应。连接装置(如图2所示),断开开关K时,将铝片和铜片同时插入稀硫酸中,Al表面产生大量无色气泡,Cu表面无明显变化;闭合开关K,电流表指针向右偏转,Al和Cu表面均产生大量无色气泡。
①该电池的负极是 (填“Al”或“Cu”)。
②用化学用语表示Cu表面产生无色气泡的原因: 。
③该小组同学将图2装置中的稀硫酸换成浓硝酸,铝电极换成铁电极,两极均产生大量红棕色气体。改进实验装置(如图3所示),闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转,此时外电路中电流方向为 。
19.(13分)人们运用原电池原理制作了多种电池,以满足不同的需求。以下各种电池广泛运用于日常生活、生产和科学技术等领域,请根据题中提供的信息填空:
(1)锂硒电池具有优异的循环稳定性。
①一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为 。
②Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是 。
(2)Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,金属锂作 极。比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣,则Na、Mg、Al分别作为电极时比能量由大到小的顺序为 。
(3)全钒液流电池充电时间短,续航能力强,被誉为“完美电池”。图3是钒电池基本工作原理示意图,电池总反应为VO2++V3++H2OV2++V+2H+,放电时,H+由B区通过质子交换膜移动到A区。
①放电时,A区为电池的 (填“正极”或“负极”)区,B区电解液含有的含钒离子为 。
②充电时,B区溶液pH (填“增大”、“减小”或“不变”),A区发生的电极反应为 。
20.(11分)甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)已知在常温常压下:①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1,②H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1。写出表示甲醇燃烧热的热化学方程式: 。汽油的主要成分之一是辛烷[C8H18(l)]。已知:25 ℃、101 kPa时,0.2 mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ热量。相同质量的甲醇和辛烷分别燃烧时释放的热量用于煅烧石灰石制备CaO,则得到CaO多的是 (填“甲醇”或“辛烷”)。
(2)已知:CH3OH(g)+O2(g)CO2(g)+2H2(g) ΔH1=-192.9 kJ·mol-1;H2(g)+O2(g)H2O(g) ΔH2=-241.8 kJ·mol-1。
则甲醇与水蒸气催化重整反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)的焓变ΔH3= 。
(3)CH3OH(l)+O2(g)CO(g)+2H2O(g) ΔH=-393 kJ·mol-1,该反应相关化学键键能数据如表所示,则x= 。
化学键 OO C—O (CO) H—O C—H
E/(kJ·mol-1) 496 343 x 465 413
Ⅱ.甲醇的合成
(4)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
②H2O(l)H2O(g) ΔH3=+44.0 kJ·mol-1。
反应Ⅱ的ΔH2= kJ·mol-1。
参考答案
1.C 解析:A项,电池充电是将电能转化为化学能;B项,光合作用是将太阳能转化为化学能;D项,太阳能板充电是将太阳能转化为电能。
2.A 解析:铁杵磨成针只是物质形态发生变化,没有新物质生成,所以属于物理变化,不是放热反应,A项符合题意;“豆箕”是大豆的秸秆,主要成分为纤维素,纤维素燃烧是将化学能转化为热能,B项不符合题意;“爆竹声中一岁除,春风送暖入屠苏”中火药爆炸为氧化还原反应,生成二氧化碳、二氧化硫等物质,属于放热反应,C项不符合题意;“火树银花”描述的是灯光和焰火,发生了燃烧反应,化学能转化成热能,D项不符合题意。
3.A 解析:根据盖斯定律可得CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-164.7 kJ·mol-1,ΔH=反应物总键能-生成物总键能,可解得a=801.65,A项正确。
4.B 解析:由图示可得,铜失电子,作负极,A项正确;铜的腐蚀产物为绿色的碱式碳酸铜,氧气、水蒸气、二氧化碳均参与反应,B项错误;正极上氧气得电子,正极反应式为O2+4e-+2H2O4OH-,C项正确;海水中有电解质,使得原电池反应速率加快,锈蚀加速,D项正确。
5.C 解析:升高温度,只有催化剂失活该反应的反应速率才会减慢,A项正确;第④步反应是*H+*HOH2O,形成H—O键,B项正确;催化剂Cu-ZnO-ZrO2能加快反应速率,但不能改变ΔH,C项错误;该反应的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-46 kJ·mol-1,所以逆反应的活化能比正反应的大,D项正确。
6.B 解析:由示意图可知,催化电极b表面上CO2被还原为CO,为电解池的阴极,与电源的负极相连,A项正确;催化电极a为阳极,电极表面上甘油(C3H8O3)被氧化为甘油醛(C3H6O3),电极反应式为C3H8O3-2e-+2CC3H6O3+2HC,溶液中C的水解程度大于HC的,碳酸钠溶液的碱性强于碳酸氢钠溶液,则电极a附近溶液的pH减小,B项错误;电解池工作时,阴离子向阳极区移动,即阴离子透过交换膜向a极迁移,C项正确;阳极上生成1 mol C3H6O3转移2 mol e-,阴极上生成1 mol CO和H2的混合气体转移2 mol e-,电解池工作时,阴、阳极转移电子的物质的量相等,则生成的甘油醛与合成气的物质的量相等,D项正确。
7.D 解析:根据图示的电池结构和题目所给信息可知,N极为电池的负极,电极反应式为Zn-2e-+4OH-[Zn(OH)4]2-。M极为电池的正极,电极反应式为MnO2+2e-+4H+Mn2++2H2O。M极为电池的正极,发生还原反应,A项错误;甲室电极反应式为MnO2+2e-+4H+Mn2++2H2O,消耗H+,溶液的pH增大,B项错误;N极的电极反应式为Zn-2e-+4OH-[Zn(OH)4]2-,C项错误;根据两极反应式可知,当电路中流过0.5 mol电子时,M极减少的质量为87 g·mol-1×0.25 mol=21.75 g,N极减少的质量为65 g·mol-1×0.25 mol=16.25 g,即总共减少的质量为21.75 g+16.25 g=38 g,D项正确。
8.A 解析:活化能越大,反应速率越慢,反应速率最慢的反应制约反应速率,由图可知途径2最大能垒为[-377.5-(-513.0)] kJ·mol-1=135.5 kJ·mol-1,途径1中步骤H2S*HS*+H*的焓变为[-443.5-(-13.5)] kJ·mol-1=-430 kJ·mol-1,A项正确。
9.D 解析:该电解池中,阳极反应式为2Cl--2e-Cl2↑,阴极反应式为2H2O+2e-H2↑+2OH-,中间为阳离子交换膜,则四甲基铵根离子通过交换膜进入阴极区生成(CH3)4NOH,所以B为阴极,生成的c是氢气,A为阳极,生成的b为氯气。综上所述,D项正确。
10.A 解析:M极通入KCl溶液,N极通入NaNO3溶液,整个过程电解制取KNO3和NaCl,则M极上Cl-放电,故M极为阳极,N极为阴极,阴极反应式为2H2O+2e-H2↑+2OH-,阳极反应式为2Cl--2e-Cl2↑,Ⅰ室与Ⅴ室均通入KCl溶液,Ⅶ室与Ⅲ室均通入NaNO3溶液,由于阳离子向阴极移动,阴离子向阳极移动,Ⅲ室中N通过膜A移向Ⅱ室,Na+通过膜C移向中间室(Ⅳ室),Ⅴ室中Cl-通过膜A移向中间室(Ⅳ室),K+通过膜C移向Ⅵ室,在Ⅳ室获得NaCl,则Ⅱ室、Ⅵ室获得KNO3。a为电源的正极,b为电源的负极,所以a极电势比b极高,A项错误;根据分析,可知X溶液为KNO3溶液,B项正确;根据分析,可知Ⅲ室中N通过膜A移向Ⅱ室,Ⅴ室中Cl-通过膜A移向Ⅳ室,C项正确;电解总反应:2Cl-+2H2OCl2↑+H2↑+2OH-,D项正确。
11.C 解析:催化剂可改变反应的活化能,但不能降低能量变化,A项错误;过程②断裂化学键吸收能量,过程③④形成化学键释放能量,B项错误;H—H是非极性键,C—H是极性键,因此反应中有非极性键的断裂、极性键的形成,C项正确;催化剂在化学反应中质量和化学性质均没有改变,D项错误。
12.C 解析:若导线上有4 mol电子移动,根据原电池的正极2H2O~O2~4e-,质子交换膜左侧产生1 mol O2,没有指明状态,无法计算体积,A项错误;装置中进行的反应是通过光能完成的,不是自发的氧化还原反应,B项错误;图中的能量转化形式为光能电能化学能,C项正确;b极为原电池的正极,其电极反应式为CO2+6H++6e-CH3OH+H2O,D项错误。
13.D 解析:①N2O+Pt2O+Pt2+N2 ΔH1,②Pt2+COPt2O++CO2 ΔH2,结合盖斯定律由①+②得到N2O(g)+CO(g)CO2(g)+N2(g) ΔH=ΔH1+ΔH2,A项正确;由图示分析可知,反应物的能量高于生成物,反应为放热反应,反应焓变ΔH=生成物总焓-反应物总焓=134 kJ·mol-1-360 kJ·mol-1=-226 kJ·mol-1,B项正确;正反应活化能E1=134 kJ·mol-1小于逆反应活化能E2=360 kJ·mol-1, C项正确;①N2O+Pt2O+Pt2+N2 ΔH1,②Pt2+COPt2O++CO2 ΔH2,反应过程中Pt2O+和Pt2 参与反应,后又生成,不需要补充,D项错误。
14.C 解析:银棒作电镀池的阳极,发生的电极反应为Ag-e-Ag+,故X极为电源的正极,A项错误;铜杯表面实现镀银,表面发生的电极反应为Ag++e-Ag,B项错误;由于HCNH++CN-,抑制反应[Ag(CN)2]-Ag++2CN-正向进行,C项正确;相同浓度时,[Ag(CN)2]-比AgNO3更难电离,溶液中Ag+的浓度相对较小,D项错误。
15.C 解析:根据图示可知,a极为阴极,b极为阳极,b极发生氧化反应,a极与负极相连,A、B两项均正确;阴极区的电极反应为N2+6H++6e-2NH3,C项错误;H+由右室通过交换膜向左室迁移,D项正确。
16.(1)①C(2分)
②左端液面升高,右端液面降低(1分);吸热反应(1分);左端液面降低,右端液面升高(1分)
(2)①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1(2分)
②+125 kJ·mol-1(2分)
③氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大)(2分)
解析:(2)②CH3—CH3(g)CH2CH2(g)+H2(g) ΔH=反应物的总键能-生成物的总键能=6×414 kJ·mol-1+347 kJ·mol-1-(4×414 kJ·mol-1+615 kJ·mol-1+435 kJ·mol-1)=+125 kJ·mol-1。
17.(1)①>(2分);<(2分)
②+183(2分)
(2)C(2分)
(3)0.1(2分);(2a+b)/80(2分)
解析:(1)①N2(g)2N(g)是断裂化学键的过程,吸收能量,ΔH1>0,N(g)+O(g)NO(g)是形成化学键的过程,放出能量,ΔH3<0。
②Ⅰ.N2(g)2N(g) ΔH1=+945 kJ·mol-1;
Ⅱ.O2(g)2O(g) ΔH2=+498 kJ·mol-1;
Ⅲ.N(g)+O(g)NO(g) ΔH3=-630 kJ·mol-1;
根据盖斯定律,由Ⅰ+Ⅱ+2×Ⅲ得到N2(g)+O2(g)2NO(g) ΔH=+183 kJ·mol-1。
(2)4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值,为-1807.98 kJ·mol-1。
(3)假设两个反应分别为①②,由①×2+②可得:4CO(g)+2NO2(g)N2(g)+4CO2(g)
ΔH=-(2a+b) kJ·mol-1,反应中转移8个电子。因此标准状况下1.12 L CO还原NO2时,转移电子的物质的量为×2=0.1 mol,放出的热量为×(2a+b) kJ=(2a+b)/80 kJ。
18.(1)湿润的淀粉-KI试纸(2分)
(2)①Al(2分)
②2H++2e-H2↑(2分)
③由Cu电极流向铁电极(2分)
19.(1)①2Li++xSe+2e-Li2Sex(2分)
②Li2Se6>Li2Se4>Li2Se(2分)
(2)负(1分);Al>Mg>Na(2分)
(3)①正极(1分);V2+、V3+(2分)
②减小(1分);VO2++H2O-e-V+2H+(2分)
解析:(1)①锂硒电池放电时,锂作负极,硒作正极,正极的电极反应式为2Li++xSe+2e-Li2Sex。
②Li2Se6、Li2Se4、Li2Se分别与正极碳基体结合时,能量依次降低,所以3种Li2Sex与碳基体的结合能力由大到小的顺序是Li2Se6>Li2Se4>Li2Se。
(2)Li-CuO二次电池中,Li失去电子,金属锂作负极,比能量是指消耗单位质量的电极所释放的电量,设三种电极的质量均为m,则×3>×2>,故Na、Mg、Al分别作为电极时比能量由大到小的顺序为Al>Mg>Na。
(3)①根据分析,正极区阳离子浓度减小,H+向正极区移动,且题目中已知H+由B区通过隔膜向A区移动,说明A区为正极区,B区为负极区;B区含有的含钒离子为V2+和V3+。
②根据分析,A区电极发生失电子的反应,A区阳离子浓度增大,H+向B区移动,B区溶液pH减小;A区的电极反应式为VO2++H2O-e-V+2H+。
20.(1)CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1(2分);辛烷(1分)
(2)+48.9 kJ·mol-1(2分)
(3)1076(3分)
(4)+41.2(3分)
解析:(1)①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1,②H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1,根据盖斯定律,①×-②×2得CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1;25 ℃、101 kPa时,0.2 mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ热量,则1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出1103.6 kJ×5=5518 kJ热量,热化学方程式为C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5518 kJ·mol-1;物质的量与热量成正比,等质量时放热多的为C8H18,热量用于煅烧石灰石制备CaO,则得到CaO多的是辛烷。
(2)根据盖斯定律和已知方程式,可得甲醇和水蒸气催化重整的方程式为①-②,所以焓变ΔH3=ΔH1-ΔH2=-192.9 kJ·mol-1+241.8 kJ·mol-1=+48.9 kJ·mol-1。
(3)ΔH=反应物的键能总和-生成物的键能总和,即-393=(3×413+343+496+465)-(x+4×465),解得x=1076。
同课章节目录
