第四单元 元素周期律 课件 (共24张PPT)人教版2019高中化学
文档属性
| 名称 | 第四单元 元素周期律 课件 (共24张PPT)人教版2019高中化学 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-28 00:57:21 | ||
图片预览





文档简介
(共24张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
课时1 元素性质的周期性变化规律
壹
贰
元素性质的周期性变化
同周期元素性质的递变规律
知识导航
本节重点
本节难点
课堂导入
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
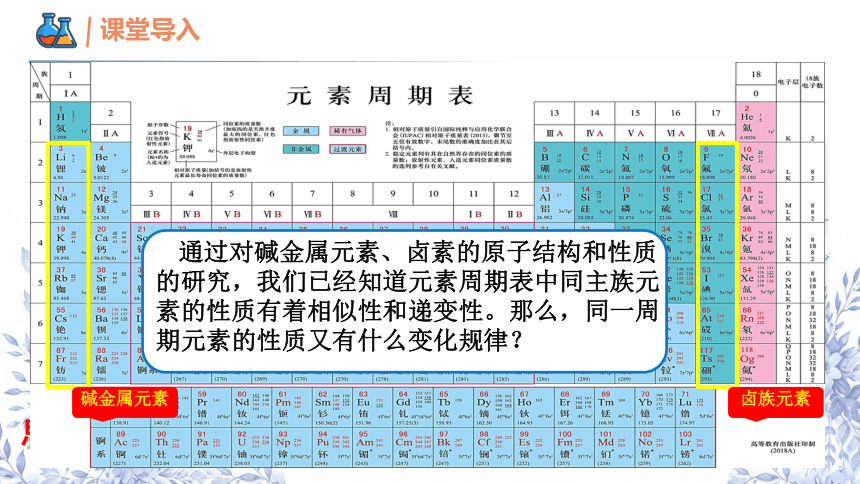
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
探究课堂
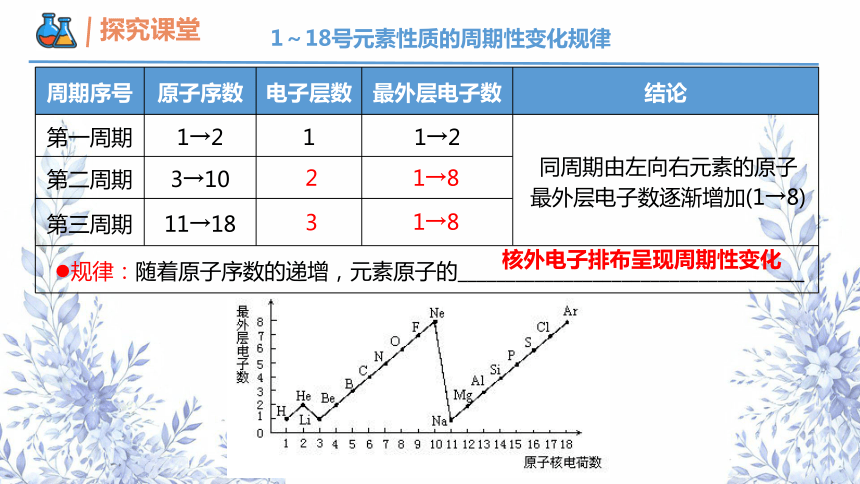
1~18号元素性质的周期性变化规律
周期序号 原子序数 电子层数 最外层电子数 结论
第一周期 1→2 1 1→2 同周期由左向右元素的原子
最外层电子数逐渐增加(1→8)
第二周期 3→10 第三周期 11→18 规律:随着原子序数的递增,元素原子的____________________________________ 1→8
1→8
核外电子排布呈现周期性变化
2
3
探究课堂
周期序号 原子序数 原子半径(nm) 结论
第一周期 1→2 …… 同周期由左向右元素的____________________
(不包括稀有气体)
第二周期 3→9 0.152→0.071_______ 第三周期 11→17 0.186→0.099 _______ 规律:随着原子序数的递增,元素的原子______________________ 大→小
大→小
原子半径逐渐减小
半径呈现周期性变化
原子半径的变化规律(稀有气体除外)
探究课堂
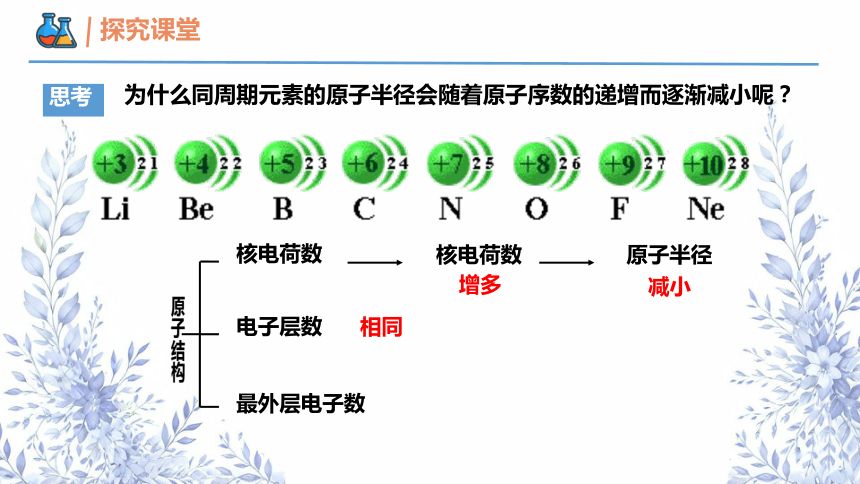
为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
思考
核电荷数
电子层数
最外层电子数
核电荷数
增多
原子半径
减小
相同
探究课堂
电子层数多的元素原子半径一定大于电子层数少的元素吗?
思考2
不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
粒子半径大小比较
探究课堂
【例】判断下列粒子半径大小(用“ ”或“ ”表示。
(1)Cl Br,S Si Al。
(2)O2- F- ,Na+ Mg2+。
(3)Cl- Cl,Mg Mg2+。
(4)K Na,S F。
(5)Mg S,Mg2+ S2-。
(6)Ca2+ Cl-,Al N。
>
<
探究课堂
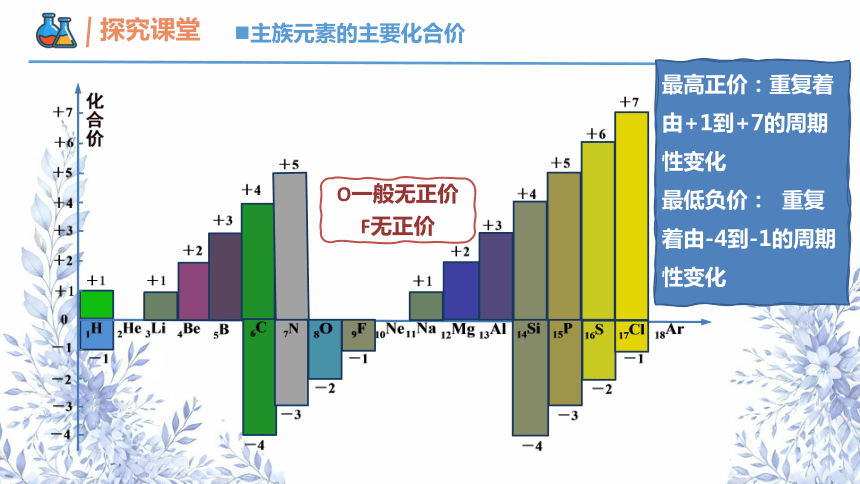
主族元素的主要化合价
O一般无正价
F无正价
最高正价:重复着由+1到+7的周期性变化
最低负价: 重复着由-4到-1的周期性变化
探究课堂
主族元素的主要化合价
O一般无正价
F无正价
最高正价=最外层电子数=主族序数
│最低负价│+最高正价=8
(除O、F外)
(除金属、O、F、H外)
探究课堂
【例】某主族元素的最高正化合价与最低负化合价的代数和为4,则该
元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
C
探究课堂
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗
电子层数相同,核电荷数增大,
失电子能力减弱,得电子能力增强
原子半径逐渐减小
原子核对最外层电子的引力逐渐增强
结构
性质
决定
性质预测
同周期元素金属性和非金属性的递变规律
探究课堂
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
金属性:Na>Mg>Al
金属性:Na>Mg
金属性:Mg>Al
实验验证
判断元素金属性强弱:
最高价氧化物对应的水化物——氢氧化物的碱性强弱。
比较Mg(OH)2和Al(OH)3的碱性强弱
探究课堂
实验验证
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = [Al(OH)4]-
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
结论:金属性Na>Mg>Al
探究课堂
元素金属性强弱的判断依据
(3)置换反应
(1)单质与水或酸反应置换出氢气的难易程度。
置换出氢气越容易,则元素金属性越强
(2)元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
验证方法
探究课堂
Si P S Cl
与氢气 反应 条件 高温 磷蒸气与H2能反应 需加热 光照或点燃时
发生爆炸
变化规律 随着核电荷数增加,与氢气化合越来越________ 气态 氢化物 热稳定性 SiH4很不稳定 PH3不稳定 H2S受热分解 HCl稳定
变化规律 随着核电荷数增加,气态氢化物越来越________ 最高价氧化物对应水化物 酸性 H2SiO3弱酸 H3PO4中强酸 H2SO4强酸 HClO4(最强的无机含氧酸)
变化规律 随着核电荷数增加,最高价氧化物对应水化物的酸性越来越___ 结论 非金属性:_________________ 容易
稳定
强
Cl>S>P>Si
Si、P、S、Cl非金属性强弱比较
探究课堂
(4)置换反应
(1)非金属单质与氢气化合的难易程度。
越容易化合,则非金属性越强
(2)形成气态氢化物的稳定性。
稳定性:HF>HCl ,非金属性: F > Cl
(3)元素最高价氧化物对应水化物酸性强弱。
酸性:H2SO4>H2CO3 ,非金属性: S > C
元素非金属性强弱的判断依据
验证方法
探究课堂
原子结构的周期性变化
元素性质的周期性变化
元素周期律
原子核外电子排布
原子半径
主要化合价
元素性质的周期性变化是 呈周期性变化的必然结果。
元素金属性和非金属性
内容
随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。
归纳
决定
实质
随着原子序数的递增
呈周期性变化
元素的性质
内容
11~17号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
金属性逐渐减弱
非金属性逐渐增强
最高价氧化物对应水化物
碱性逐渐减弱
酸性逐渐增强
探究课堂
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
探究课堂
【例】下列能说明氯的非金属性比硫强的事实是( )
① HCl比H2S稳定
② HCl和H2S的水溶液前者的酸性强
③ HClO4酸性比H2SO4强
④ Cl2能与H2S反应生成S
⑤ 氯原子能得1个电子变成稳定离子,而硫原子能得两个电子
⑥ Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
B
A.①②④ B.①③④⑥ C.①②③⑤ D.①②③④⑥
探究课堂
【例】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( )
A. 最简单的氢化物的还原性:XB. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:YD
S
O
P
Cl
X
Y
Z
W
W
X
Y
Z
X
Z
W
Y
探究课堂
【例】 在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是_________(填元素符号,下同)。
(2)金属性最强的元素是________。
(3)最高价氧化物对应水化物的酸性最强的是___________(填化学式,下同)。
(4)最不稳定的气态氢化物是_________。
(5)最高价氧化物对应水化物的碱性最强的是_________。
(6)氧化物中具有两性的是__________。
探究课堂
【例】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A. 原子序数:D>C>B>A
B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+
D. 氧化性:A2+>B+,还原性:C3-<D-
B
Mg2+
Na+
N3-
F-
THANKS
第四章 物质结构 元素周期律
第二节 元素周期律
课时1 元素性质的周期性变化规律
壹
贰
元素性质的周期性变化
同周期元素性质的递变规律
知识导航
本节重点
本节难点
课堂导入
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
探究课堂
1~18号元素性质的周期性变化规律
周期序号 原子序数 电子层数 最外层电子数 结论
第一周期 1→2 1 1→2 同周期由左向右元素的原子
最外层电子数逐渐增加(1→8)
第二周期 3→10 第三周期 11→18 规律:随着原子序数的递增,元素原子的____________________________________ 1→8
1→8
核外电子排布呈现周期性变化
2
3
探究课堂
周期序号 原子序数 原子半径(nm) 结论
第一周期 1→2 …… 同周期由左向右元素的____________________
(不包括稀有气体)
第二周期 3→9 0.152→0.071_______ 第三周期 11→17 0.186→0.099 _______ 规律:随着原子序数的递增,元素的原子______________________ 大→小
大→小
原子半径逐渐减小
半径呈现周期性变化
原子半径的变化规律(稀有气体除外)
探究课堂
为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
思考
核电荷数
电子层数
最外层电子数
核电荷数
增多
原子半径
减小
相同
探究课堂
电子层数多的元素原子半径一定大于电子层数少的元素吗?
思考2
不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。
粒子半径大小比较
探究课堂
【例】判断下列粒子半径大小(用“ ”或“ ”表示。
(1)Cl Br,S Si Al。
(2)O2- F- ,Na+ Mg2+。
(3)Cl- Cl,Mg Mg2+。
(4)K Na,S F。
(5)Mg S,Mg2+ S2-。
(6)Ca2+ Cl-,Al N。
>
<
探究课堂
主族元素的主要化合价
O一般无正价
F无正价
最高正价:重复着由+1到+7的周期性变化
最低负价: 重复着由-4到-1的周期性变化
探究课堂
主族元素的主要化合价
O一般无正价
F无正价
最高正价=最外层电子数=主族序数
│最低负价│+最高正价=8
(除O、F外)
(除金属、O、F、H外)
探究课堂
【例】某主族元素的最高正化合价与最低负化合价的代数和为4,则该
元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
C
探究课堂
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗
电子层数相同,核电荷数增大,
失电子能力减弱,得电子能力增强
原子半径逐渐减小
原子核对最外层电子的引力逐渐增强
结构
性质
决定
性质预测
同周期元素金属性和非金属性的递变规律
探究课堂
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
金属性:Na>Mg>Al
金属性:Na>Mg
金属性:Mg>Al
实验验证
判断元素金属性强弱:
最高价氧化物对应的水化物——氢氧化物的碱性强弱。
比较Mg(OH)2和Al(OH)3的碱性强弱
探究课堂
实验验证
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = [Al(OH)4]-
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
结论:金属性Na>Mg>Al
探究课堂
元素金属性强弱的判断依据
(3)置换反应
(1)单质与水或酸反应置换出氢气的难易程度。
置换出氢气越容易,则元素金属性越强
(2)元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
验证方法
探究课堂
Si P S Cl
与氢气 反应 条件 高温 磷蒸气与H2能反应 需加热 光照或点燃时
发生爆炸
变化规律 随着核电荷数增加,与氢气化合越来越________ 气态 氢化物 热稳定性 SiH4很不稳定 PH3不稳定 H2S受热分解 HCl稳定
变化规律 随着核电荷数增加,气态氢化物越来越________ 最高价氧化物对应水化物 酸性 H2SiO3弱酸 H3PO4中强酸 H2SO4强酸 HClO4(最强的无机含氧酸)
变化规律 随着核电荷数增加,最高价氧化物对应水化物的酸性越来越___ 结论 非金属性:_________________ 容易
稳定
强
Cl>S>P>Si
Si、P、S、Cl非金属性强弱比较
探究课堂
(4)置换反应
(1)非金属单质与氢气化合的难易程度。
越容易化合,则非金属性越强
(2)形成气态氢化物的稳定性。
稳定性:HF>HCl ,非金属性: F > Cl
(3)元素最高价氧化物对应水化物酸性强弱。
酸性:H2SO4>H2CO3 ,非金属性: S > C
元素非金属性强弱的判断依据
验证方法
探究课堂
原子结构的周期性变化
元素性质的周期性变化
元素周期律
原子核外电子排布
原子半径
主要化合价
元素性质的周期性变化是 呈周期性变化的必然结果。
元素金属性和非金属性
内容
随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。
归纳
决定
实质
随着原子序数的递增
呈周期性变化
元素的性质
内容
11~17号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
金属性逐渐减弱
非金属性逐渐增强
最高价氧化物对应水化物
碱性逐渐减弱
酸性逐渐增强
探究课堂
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
探究课堂
【例】下列能说明氯的非金属性比硫强的事实是( )
① HCl比H2S稳定
② HCl和H2S的水溶液前者的酸性强
③ HClO4酸性比H2SO4强
④ Cl2能与H2S反应生成S
⑤ 氯原子能得1个电子变成稳定离子,而硫原子能得两个电子
⑥ Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
B
A.①②④ B.①③④⑥ C.①②③⑤ D.①②③④⑥
探究课堂
【例】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( )
A. 最简单的氢化物的还原性:X
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y
S
O
P
Cl
X
Y
Z
W
W
X
Y
Z
X
Z
W
Y
探究课堂
【例】 在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是_________(填元素符号,下同)。
(2)金属性最强的元素是________。
(3)最高价氧化物对应水化物的酸性最强的是___________(填化学式,下同)。
(4)最不稳定的气态氢化物是_________。
(5)最高价氧化物对应水化物的碱性最强的是_________。
(6)氧化物中具有两性的是__________。
探究课堂
【例】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A. 原子序数:D>C>B>A
B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+
D. 氧化性:A2+>B+,还原性:C3-<D-
B
Mg2+
Na+
N3-
F-
THANKS
