7.2 第2课时 碱的化学性质 课件 (共19张PPT) 2024-2025学年化学鲁教版九年级下册
文档属性
| 名称 | 7.2 第2课时 碱的化学性质 课件 (共19张PPT) 2024-2025学年化学鲁教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 988.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 22:19:19 | ||
图片预览



文档简介
(共19张PPT)
第七单元 认识酸和碱
第二节 碱及其性质
第2课时 碱的化学性质
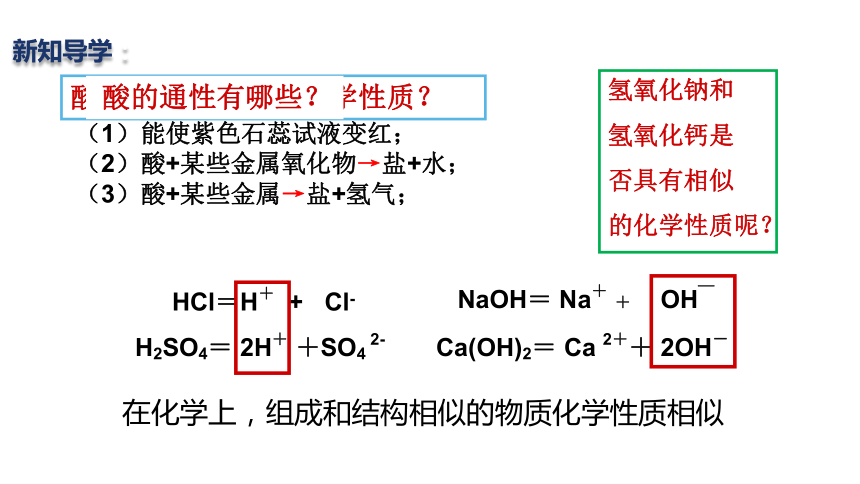
酸为什么具有相似化学性质?
NaOH= Na+ + OH_
Ca(OH)2= Ca 2++ 2OH-
HCl=H+ + Cl-
H2SO4= 2H+ +SO4 2-
酸的通性有哪些?
(1)能使紫色石蕊试液变红;
(2)酸+某些金属氧化物→盐+水;
(3)酸+某些金属→盐+氢气;
氢氧化钠和
氢氧化钙是
否具有相似
的化学性质呢?
在化学上,组成和结构相似的物质化学性质相似
新知导学:
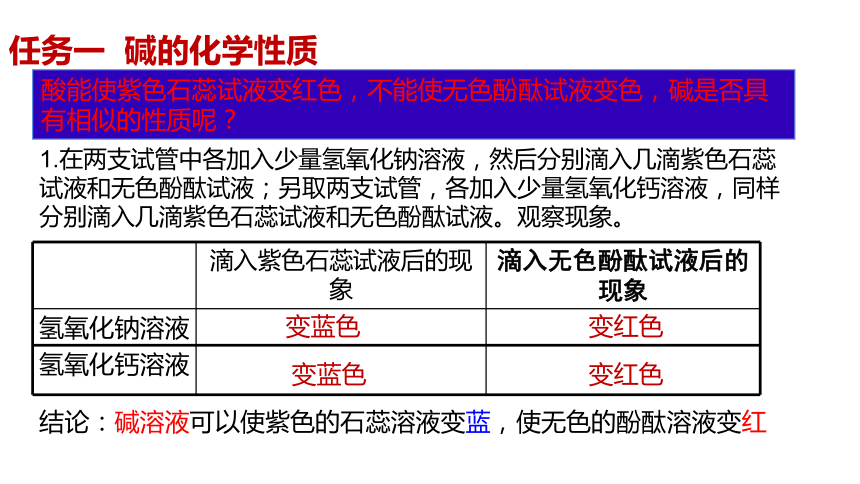
任务一 碱的化学性质
酸能使紫色石蕊试液变红色,不能使无色酚酞试液变色,碱是否具有相似的性质呢?
滴入紫色石蕊试液后的现象 滴入无色酚酞试液后的现象
氢氧化钠溶液
氢氧化钙溶液
变蓝色
变红色
结论:碱溶液可以使紫色的石蕊溶液变蓝,使无色的酚酞溶液变红
1.在两支试管中各加入少量氢氧化钠溶液,然后分别滴入几滴紫色石蕊试液和无色酚酞试液;另取两支试管,各加入少量氢氧化钙溶液,同样分别滴入几滴紫色石蕊试液和无色酚酞试液。观察现象。
变蓝色
变红色
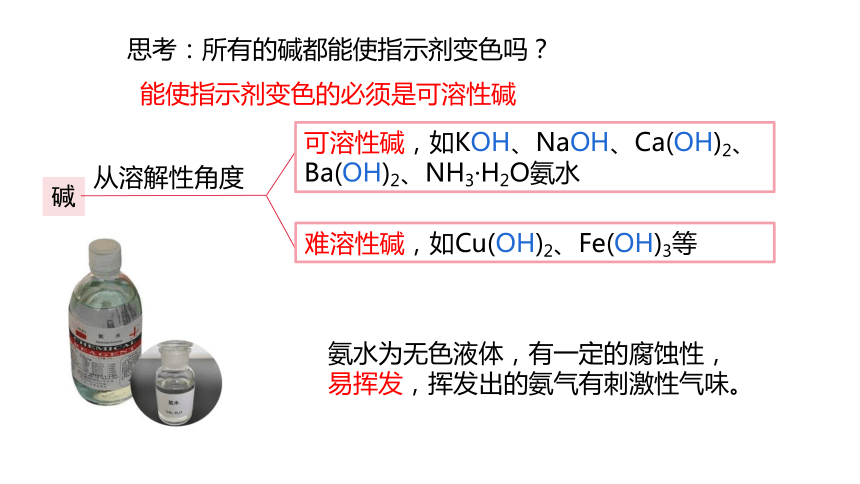
思考:所有的碱都能使指示剂变色吗?
能使指示剂变色的必须是可溶性碱
碱
可溶性碱,如KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O氨水
难溶性碱,如Cu(OH)2、Fe(OH)3等
从溶解性角度
氨水为无色液体,有一定的腐蚀性,易挥发,挥发出的氨气有刺激性气味。
实验步骤
向两个盛满二氧化碳气体的矿泉水瓶中分别加入5mL氢氧化钠溶液和5mL氢氧化钙溶液,立即拧紧瓶盖,振荡,观察现象。
实验现象
实验现象
氢氧化钠溶液
氢氧化钙溶液
矿泉水瓶变瘪
矿泉水瓶变瘪,溶液变浑浊
Ca(OH)2 + CO2 = CaCO3↓+ H2O
思考讨论
矿泉水瓶变瘪能不能证明氢氧化钠或氢氧化钙与二氧化碳发生了反应?为什么?
实验步骤
向两个盛满二氧化碳气体的矿泉水瓶中分别加入5mL氢氧化钠溶液和5mL蒸馏水,立即拧紧瓶盖,振荡,观察现象。
实验现象
实验现象
氢氧化钠溶液
蒸馏水
加入氢氧化钠的矿泉水瓶变瘪程度大
2NaOH + CO2 =Na2CO3 + H2O
实验结论
加入蒸馏水的矿泉水瓶变瘪程度小
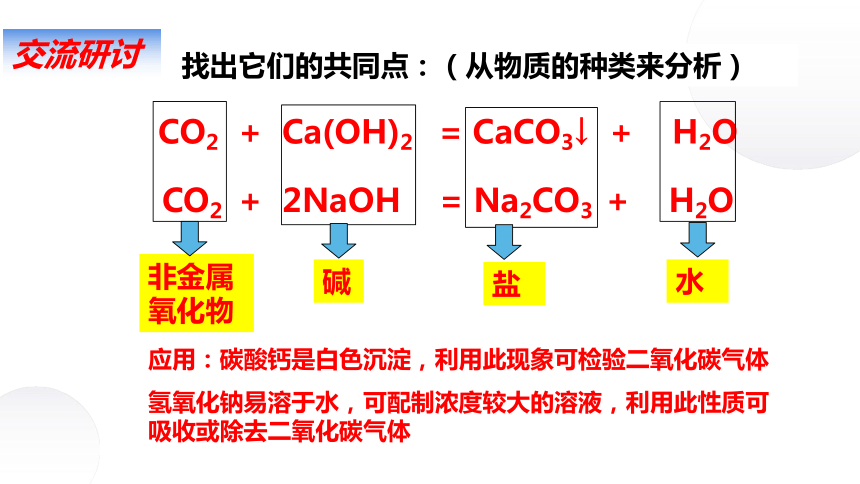
找出它们的共同点:(从物质的种类来分析)
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + 2NaOH = Na2CO3 + H2O
非金属氧化物
碱
盐
水
交流研讨
应用:碳酸钙是白色沉淀,利用此现象可检验二氧化碳气体
氢氧化钠易溶于水,可配制浓度较大的溶液,利用此性质可吸收或除去二氧化碳气体
小结:碱的通性
1.碱跟酸碱指示剂的反应
2.碱 + 非金属氧化物---盐+水
能使紫色石蕊试液变成蓝色;能使无色酚酞试液变成红色
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2 =CaCO3↓+H2O
实验内容 实验现象 实验结论
向碳酸钠溶液加入氢氧化钠溶液
向碳酸钠溶液加入氢氧化钙溶液
无明显现象
产生白色沉淀
氢氧化钠不能与碳酸钠发生反应
Ca(OH)2+Na2CO3
2NaOH+CaCO3 ↓
拓展探究:碱的化学性质完全相同吗?
思考讨论
碱都有相似的化学性质?但是不同的碱之间的化学性质也存在差异,这是为什么?
NaOH=Na++OH- Ca(OH)2=Ca2++2OH-
化学性质相似
氢氧根离子
化学性质存在差异
碱与碱之间也存在着差异,例如氢氧化钙可以与碳酸钠溶液生成白色沉淀,而氢氧化钠却不反应,这是因为他们溶于水时,都解离出不同的阳离子。
碱都具有相似的化学性质,因为它们溶于水时,都解离出相同的阴离子--- 。
氢氧化钠的用途
造 纸
印 染
炼 油
制造化学纤维
生产橡胶
任务二 碱的用途
生产农药
漂白剂
土木建筑
改良土壤
氢氧化钙的用途
碱的化学性质
1.碱能与酸碱指示剂反应:
使紫色石蕊试液变蓝色,使无色酚酞试液变红色
2.碱能与非金属氧化物反应:
非金属氧化物+碱→盐+水
课堂小结
1.物质的性质决定其保存方法。固体氢氧化钠具有以下性质:①白色固体,②有腐蚀性,③易吸收水分,④能与空气中的二氧化碳反应。由此可知,氢氧化钠固体必须密封保存的主要原因是( )
A.①② B.②③ C.①③ D.③④
D
课堂练习
2.下列关于NaOH和Ca(OH)2的用途中错误的是( )
A.用Ca(OH)2制农药
B.用Ca(OH)2改良酸性土壤
C.用NaOH溶液检验CO2
D.用NaOH固体干燥某些气体
C
课堂练习
3.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用
B.溶于水时都能解离出氢氧根离子
C.溶于水时都能解离出金属阳离子
D.都含有氢元素和氧元素
B
4.下列物质露置在空气中,质量增加且变质的是( )
A.浓硫酸 B.火碱 C.水 D.浓盐酸
B
课堂练习
5.某溶液能使紫色石蕊试液变蓝色,则该溶液能使无色酚酞试液变( )
A.无色 B.蓝色 C.紫色 D.红色
D
课堂练习
谢 谢 观 看
第七单元 认识酸和碱
第二节 碱及其性质
第2课时 碱的化学性质
酸为什么具有相似化学性质?
NaOH= Na+ + OH_
Ca(OH)2= Ca 2++ 2OH-
HCl=H+ + Cl-
H2SO4= 2H+ +SO4 2-
酸的通性有哪些?
(1)能使紫色石蕊试液变红;
(2)酸+某些金属氧化物→盐+水;
(3)酸+某些金属→盐+氢气;
氢氧化钠和
氢氧化钙是
否具有相似
的化学性质呢?
在化学上,组成和结构相似的物质化学性质相似
新知导学:
任务一 碱的化学性质
酸能使紫色石蕊试液变红色,不能使无色酚酞试液变色,碱是否具有相似的性质呢?
滴入紫色石蕊试液后的现象 滴入无色酚酞试液后的现象
氢氧化钠溶液
氢氧化钙溶液
变蓝色
变红色
结论:碱溶液可以使紫色的石蕊溶液变蓝,使无色的酚酞溶液变红
1.在两支试管中各加入少量氢氧化钠溶液,然后分别滴入几滴紫色石蕊试液和无色酚酞试液;另取两支试管,各加入少量氢氧化钙溶液,同样分别滴入几滴紫色石蕊试液和无色酚酞试液。观察现象。
变蓝色
变红色
思考:所有的碱都能使指示剂变色吗?
能使指示剂变色的必须是可溶性碱
碱
可溶性碱,如KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O氨水
难溶性碱,如Cu(OH)2、Fe(OH)3等
从溶解性角度
氨水为无色液体,有一定的腐蚀性,易挥发,挥发出的氨气有刺激性气味。
实验步骤
向两个盛满二氧化碳气体的矿泉水瓶中分别加入5mL氢氧化钠溶液和5mL氢氧化钙溶液,立即拧紧瓶盖,振荡,观察现象。
实验现象
实验现象
氢氧化钠溶液
氢氧化钙溶液
矿泉水瓶变瘪
矿泉水瓶变瘪,溶液变浑浊
Ca(OH)2 + CO2 = CaCO3↓+ H2O
思考讨论
矿泉水瓶变瘪能不能证明氢氧化钠或氢氧化钙与二氧化碳发生了反应?为什么?
实验步骤
向两个盛满二氧化碳气体的矿泉水瓶中分别加入5mL氢氧化钠溶液和5mL蒸馏水,立即拧紧瓶盖,振荡,观察现象。
实验现象
实验现象
氢氧化钠溶液
蒸馏水
加入氢氧化钠的矿泉水瓶变瘪程度大
2NaOH + CO2 =Na2CO3 + H2O
实验结论
加入蒸馏水的矿泉水瓶变瘪程度小
找出它们的共同点:(从物质的种类来分析)
CO2 + Ca(OH)2 = CaCO3↓ + H2O
CO2 + 2NaOH = Na2CO3 + H2O
非金属氧化物
碱
盐
水
交流研讨
应用:碳酸钙是白色沉淀,利用此现象可检验二氧化碳气体
氢氧化钠易溶于水,可配制浓度较大的溶液,利用此性质可吸收或除去二氧化碳气体
小结:碱的通性
1.碱跟酸碱指示剂的反应
2.碱 + 非金属氧化物---盐+水
能使紫色石蕊试液变成蓝色;能使无色酚酞试液变成红色
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2 =CaCO3↓+H2O
实验内容 实验现象 实验结论
向碳酸钠溶液加入氢氧化钠溶液
向碳酸钠溶液加入氢氧化钙溶液
无明显现象
产生白色沉淀
氢氧化钠不能与碳酸钠发生反应
Ca(OH)2+Na2CO3
2NaOH+CaCO3 ↓
拓展探究:碱的化学性质完全相同吗?
思考讨论
碱都有相似的化学性质?但是不同的碱之间的化学性质也存在差异,这是为什么?
NaOH=Na++OH- Ca(OH)2=Ca2++2OH-
化学性质相似
氢氧根离子
化学性质存在差异
碱与碱之间也存在着差异,例如氢氧化钙可以与碳酸钠溶液生成白色沉淀,而氢氧化钠却不反应,这是因为他们溶于水时,都解离出不同的阳离子。
碱都具有相似的化学性质,因为它们溶于水时,都解离出相同的阴离子--- 。
氢氧化钠的用途
造 纸
印 染
炼 油
制造化学纤维
生产橡胶
任务二 碱的用途
生产农药
漂白剂
土木建筑
改良土壤
氢氧化钙的用途
碱的化学性质
1.碱能与酸碱指示剂反应:
使紫色石蕊试液变蓝色,使无色酚酞试液变红色
2.碱能与非金属氧化物反应:
非金属氧化物+碱→盐+水
课堂小结
1.物质的性质决定其保存方法。固体氢氧化钠具有以下性质:①白色固体,②有腐蚀性,③易吸收水分,④能与空气中的二氧化碳反应。由此可知,氢氧化钠固体必须密封保存的主要原因是( )
A.①② B.②③ C.①③ D.③④
D
课堂练习
2.下列关于NaOH和Ca(OH)2的用途中错误的是( )
A.用Ca(OH)2制农药
B.用Ca(OH)2改良酸性土壤
C.用NaOH溶液检验CO2
D.用NaOH固体干燥某些气体
C
课堂练习
3.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用
B.溶于水时都能解离出氢氧根离子
C.溶于水时都能解离出金属阳离子
D.都含有氢元素和氧元素
B
4.下列物质露置在空气中,质量增加且变质的是( )
A.浓硫酸 B.火碱 C.水 D.浓盐酸
B
课堂练习
5.某溶液能使紫色石蕊试液变蓝色,则该溶液能使无色酚酞试液变( )
A.无色 B.蓝色 C.紫色 D.红色
D
课堂练习
谢 谢 观 看
同课章节目录
