7.4 酸碱中和反应 课件 (共22张PPT内嵌视频) 2024-2025学年化学鲁教版九年级下册
文档属性
| 名称 | 7.4 酸碱中和反应 课件 (共22张PPT内嵌视频) 2024-2025学年化学鲁教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 25.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 22:32:21 | ||
图片预览




文档简介
(共22张PPT)
第七单元 认识酸和碱
第四节 酸碱中和反应
生活中,我们被蚊虫叮咬的后,涂上肥皂水,就可以减轻皮肤的痒痛,这是为什么?
涂点肥皂水就好了。
因为肥皂中的碱与蚊虫分泌物中的酸发生了化学反应。那么,其他的酸和碱之间是否也能发生化学反应呢?
新知导学:
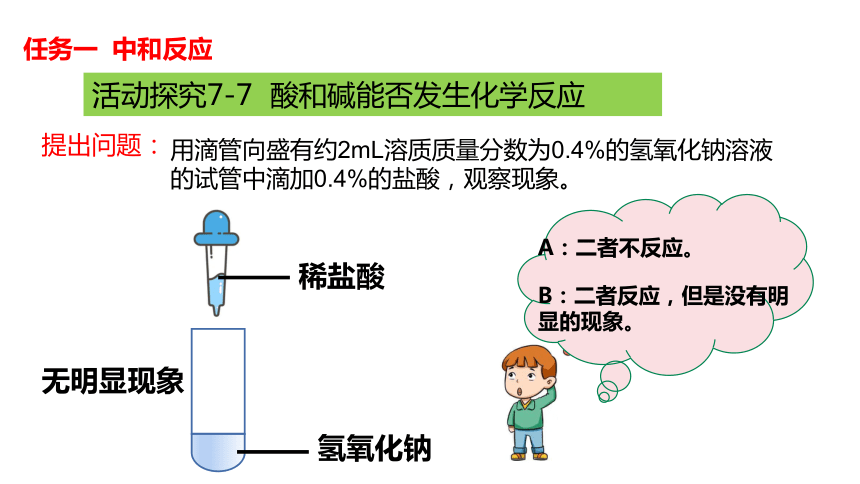
活动探究7-7 酸和碱能否发生化学反应
提出问题:
用滴管向盛有约2mL溶质质量分数为0.4%的氢氧化钠溶液的试管中滴加0.4%的盐酸,观察现象。
任务一 中和反应
稀盐酸
氢氧化钠
无明显现象
A:二者不反应。
B:二者反应,但是没有明显的现象。
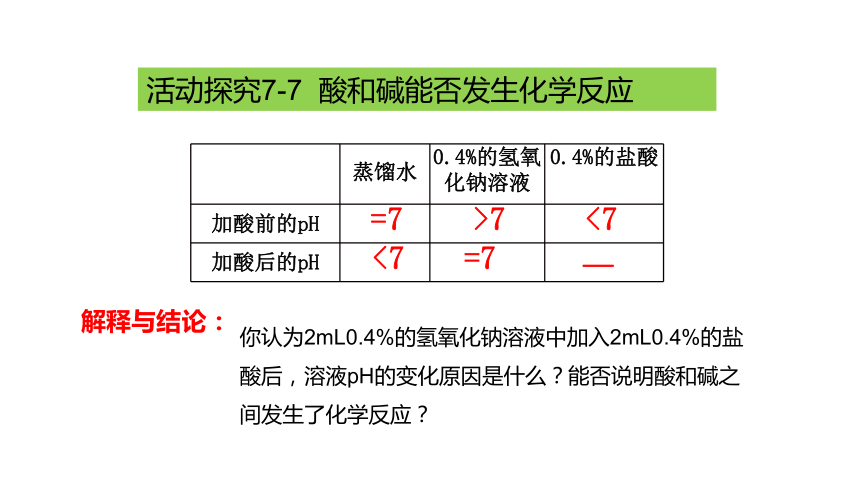
活动探究7-7 酸和碱能否发生化学反应
收集证据:
(1)用pH试纸分别测定水、0.4%的氢氧化钠溶液和0.4%的盐酸的pH,观察并记录数据。
(2)分别量取2mL蒸馏水和2mL0.4%的氢氧化钠溶液于两支试管中,然后分别加入2mL0.4%的盐酸,充分振荡后,测定所得溶液的pH,观察并记录数据。
任务一 中和反应
你认为盐酸和氢氧化钠溶液发生化学反应了吗?
蒸馏水 0.4%的氢氧化钠溶液 0.4%的盐酸
加酸前的pH
加酸后的pH
=7
>7
<7
<7
=7
—
解释与结论:
你认为2mL0.4%的氢氧化钠溶液中加入2mL0.4%的盐酸后,溶液pH的变化原因是什么?能否说明酸和碱之间发生了化学反应?
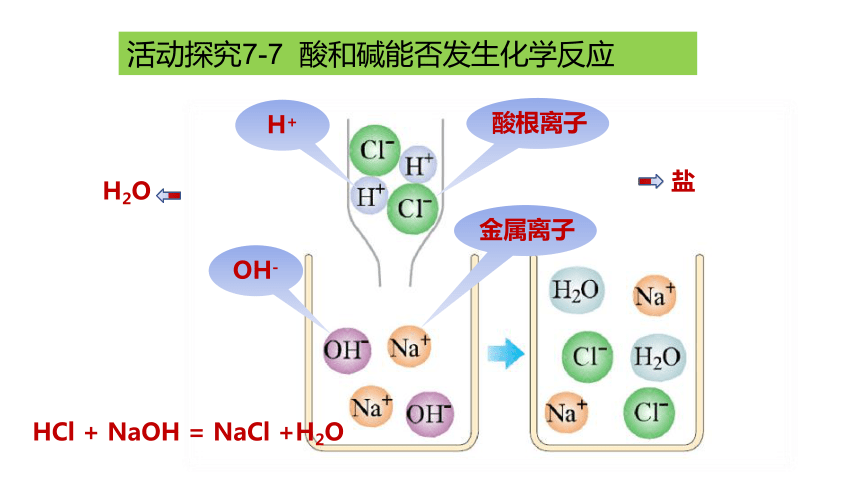
活动探究7-7 酸和碱能否发生化学反应
解释与结论:
上述实验中,盐酸与氢氧化钠溶液混合后,溶液的pH发生了明显的变化,这显然不是由于溶液混合时相互稀释造成的,而是溶液中的氢离子(H+)和氢氧根离子(OH-)结合成了水分子(H2O),导致溶液原有的酸碱性相互“中和”的结果。
活动探究7-7 酸和碱能否发生化学反应
酸根离子
H+
OH-
金属离子
盐
H2O
HCl + NaOH = NaCl +H2O
活动探究7-7 酸和碱能否发生化学反应
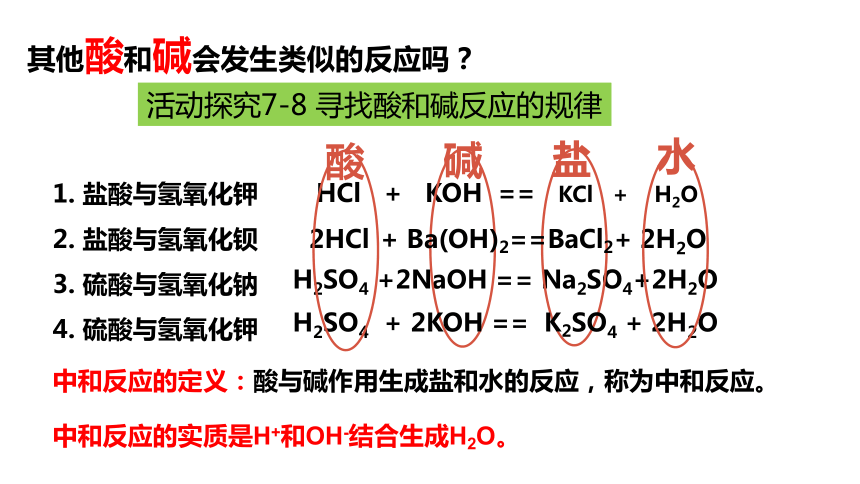
活动探究7-8 寻找酸和碱反应的规律
其他酸和碱会发生类似的反应吗?
1. 盐酸与氢氧化钾
2. 盐酸与氢氧化钡
3. 硫酸与氢氧化钠
4. 硫酸与氢氧化钾
H2SO4 +2NaOH == Na2SO4+2H2O
HCl + KOH == KCl + H2O
酸
水
H2SO4 + 2KOH == K2SO4 + 2H2O
2HCl + Ba(OH)2==BaCl2+ 2H2O
碱
盐
中和反应的定义:酸与碱作用生成盐和水的反应,称为中和反应。
中和反应的实质是H+和OH-结合生成H2O。
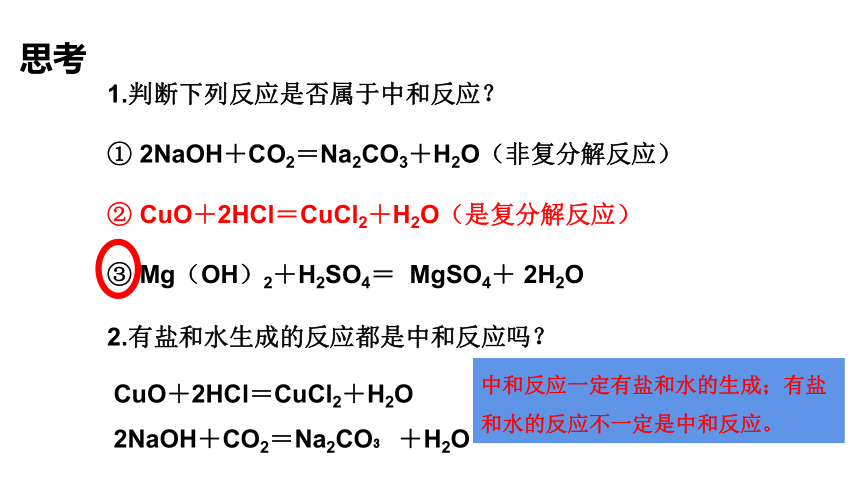
1.判断下列反应是否属于中和反应?
① 2NaOH+CO2=Na2CO3+H2O(非复分解反应)
② CuO+2HCl=CuCl2+H2O(是复分解反应)
③ Mg(OH)2+H2SO4= MgSO4+ 2H2O
2.有盐和水生成的反应都是中和反应吗?
CuO+2HCl=CuCl2+H2O
2NaOH+CO2=Na2CO +H2O
中和反应一定有盐和水的生成;有盐和水的反应不一定是中和反应。
思考
某同学利用图Ⅰ装置,向20mL0.4%的氢氧化钠溶液中逐滴滴入0.4%的盐酸,连接在传感器上的计算机随即绘制出了溶液pH(纵坐标)随所加盐酸体积(横坐标)变化的曲线(图Ⅱ)。
讨论:在向氢氧化钠溶液中滴加稀盐酸时,溶液的pH是怎样变化的 你能说出曲线上坐标为(18,7)的点所表示的意义吗
任务二 中和反应的应用
活动探究7-9 酸碱中和反应过程中溶液pH的变化
从“溶液pH随所加盐酸体积变化的曲线”图可知,曲线上坐标为(18,7)的点表示向“20mL0.4%的氢氧化钠溶液中逐滴滴入0.4%的盐酸的体积为18mL时,溶液pH为7。且溶液pH与滴入盐酸体积的关系为:
当滴入的盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈碱性,pH>7;当滴入的盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈中性,pH=7;当滴入的盐酸过量时,溶液中盐酸有剩余,溶液呈酸性,pH<7。
活动探究7-9 酸碱中和反应过程中溶液pH的变化
(18,7)
A
B
C
7
溶液的pH
滴加稀盐酸的体积(ml)
HCl+NaOH=NaCl+H2O
A点表示HCl和NaOH恰好完全反应
A点溶液中的溶质是NaCl
B点表示NaOH有剩余
B点溶液中的溶质是NaCl和NaOH
C点表示HCl有剩余
C点溶液中的溶质是NaCl和HCl
拓展延伸
HCl+NaOH=NaCl+H2O
滴加NaOH溶液的体积(mL)
A点:pH<7,
此时溶液中的离子为_________
Cl-、H+
A~B段:pH逐渐增大,仍小于7,此时溶液中的离子为____________
Na+、Cl-、H+
B点:pH=7(反应结束),此时溶液中的离子为___________
Na+、Cl-
B~C段:pH逐渐增大,pH>7,此时溶液中的离子为________
Na+、Cl-、OH-
拓展延伸
温度最高,恰好完全反应。
中和反应是一个放热反应。
拓展延伸
中和反应在生产、生活中的应用
1.应用于医药卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
中 和 反 应
定义:酸和碱作用生成盐和水的反应叫做中和反应表达式:酸 + 碱 = 盐 + 水
实质:H+ + OH- = H2O
中和反应的应用:①应用于医药卫生;②改变土壤的酸碱性;③处理工业废水;④调节溶液的酸碱性
课堂小结
1.下列反应,属于中和反应的是( )
A. Ca(OH)2+ CO2==== CaCO3↓+H2O
B. CuO + 2HCl ==== CuCl2 + H2O
C. Cu(OH)2 + H2SO4 ==== CuSO4 + 2H2O
D. AgNO3 + HCl ==== AgCl↓+ HNO3
C
课堂练习
2.下表为常见物质的pH:
蚊虫叮咬人的皮肤分泌出蚁酸,涂哪种物质可减轻痛痒( )
A.牙膏或肥皂水 B.食盐水
C.盐酸 D.食醋
物质 食醋 牙膏 食盐水 肥皂水 盐酸
pH 3 9 7 10 2
A
课堂练习
3.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸
②用稀硫酸除铁锈
③用熟石灰改良酸性土壤
④用氢氧化镁治疗胃酸过多
A.①②③ B.②③④ C.①②④ D.①③④
D
课堂练习
4.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质
是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸
和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚
酞,溶液不变色
D.该实验是将盐酸逐滴滴入盛有氢氧化钠溶液的烧杯中
B
课堂练习
5.氢氧化钠溶液与盐酸反应的化学方程式为 。
如图是该反应的微观示意图,则该反应
前后没有发生变化的离子有 ;
从微观角度看,该化学反应的实质是 。
氢离子与氢氧根离子结合生成水分子
Na+、Cl﹣
NaOH+HCl=NaCl+ H2O
课堂练习
谢 谢 观 看
第七单元 认识酸和碱
第四节 酸碱中和反应
生活中,我们被蚊虫叮咬的后,涂上肥皂水,就可以减轻皮肤的痒痛,这是为什么?
涂点肥皂水就好了。
因为肥皂中的碱与蚊虫分泌物中的酸发生了化学反应。那么,其他的酸和碱之间是否也能发生化学反应呢?
新知导学:
活动探究7-7 酸和碱能否发生化学反应
提出问题:
用滴管向盛有约2mL溶质质量分数为0.4%的氢氧化钠溶液的试管中滴加0.4%的盐酸,观察现象。
任务一 中和反应
稀盐酸
氢氧化钠
无明显现象
A:二者不反应。
B:二者反应,但是没有明显的现象。
活动探究7-7 酸和碱能否发生化学反应
收集证据:
(1)用pH试纸分别测定水、0.4%的氢氧化钠溶液和0.4%的盐酸的pH,观察并记录数据。
(2)分别量取2mL蒸馏水和2mL0.4%的氢氧化钠溶液于两支试管中,然后分别加入2mL0.4%的盐酸,充分振荡后,测定所得溶液的pH,观察并记录数据。
任务一 中和反应
你认为盐酸和氢氧化钠溶液发生化学反应了吗?
蒸馏水 0.4%的氢氧化钠溶液 0.4%的盐酸
加酸前的pH
加酸后的pH
=7
>7
<7
<7
=7
—
解释与结论:
你认为2mL0.4%的氢氧化钠溶液中加入2mL0.4%的盐酸后,溶液pH的变化原因是什么?能否说明酸和碱之间发生了化学反应?
活动探究7-7 酸和碱能否发生化学反应
解释与结论:
上述实验中,盐酸与氢氧化钠溶液混合后,溶液的pH发生了明显的变化,这显然不是由于溶液混合时相互稀释造成的,而是溶液中的氢离子(H+)和氢氧根离子(OH-)结合成了水分子(H2O),导致溶液原有的酸碱性相互“中和”的结果。
活动探究7-7 酸和碱能否发生化学反应
酸根离子
H+
OH-
金属离子
盐
H2O
HCl + NaOH = NaCl +H2O
活动探究7-7 酸和碱能否发生化学反应
活动探究7-8 寻找酸和碱反应的规律
其他酸和碱会发生类似的反应吗?
1. 盐酸与氢氧化钾
2. 盐酸与氢氧化钡
3. 硫酸与氢氧化钠
4. 硫酸与氢氧化钾
H2SO4 +2NaOH == Na2SO4+2H2O
HCl + KOH == KCl + H2O
酸
水
H2SO4 + 2KOH == K2SO4 + 2H2O
2HCl + Ba(OH)2==BaCl2+ 2H2O
碱
盐
中和反应的定义:酸与碱作用生成盐和水的反应,称为中和反应。
中和反应的实质是H+和OH-结合生成H2O。
1.判断下列反应是否属于中和反应?
① 2NaOH+CO2=Na2CO3+H2O(非复分解反应)
② CuO+2HCl=CuCl2+H2O(是复分解反应)
③ Mg(OH)2+H2SO4= MgSO4+ 2H2O
2.有盐和水生成的反应都是中和反应吗?
CuO+2HCl=CuCl2+H2O
2NaOH+CO2=Na2CO +H2O
中和反应一定有盐和水的生成;有盐和水的反应不一定是中和反应。
思考
某同学利用图Ⅰ装置,向20mL0.4%的氢氧化钠溶液中逐滴滴入0.4%的盐酸,连接在传感器上的计算机随即绘制出了溶液pH(纵坐标)随所加盐酸体积(横坐标)变化的曲线(图Ⅱ)。
讨论:在向氢氧化钠溶液中滴加稀盐酸时,溶液的pH是怎样变化的 你能说出曲线上坐标为(18,7)的点所表示的意义吗
任务二 中和反应的应用
活动探究7-9 酸碱中和反应过程中溶液pH的变化
从“溶液pH随所加盐酸体积变化的曲线”图可知,曲线上坐标为(18,7)的点表示向“20mL0.4%的氢氧化钠溶液中逐滴滴入0.4%的盐酸的体积为18mL时,溶液pH为7。且溶液pH与滴入盐酸体积的关系为:
当滴入的盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈碱性,pH>7;当滴入的盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈中性,pH=7;当滴入的盐酸过量时,溶液中盐酸有剩余,溶液呈酸性,pH<7。
活动探究7-9 酸碱中和反应过程中溶液pH的变化
(18,7)
A
B
C
7
溶液的pH
滴加稀盐酸的体积(ml)
HCl+NaOH=NaCl+H2O
A点表示HCl和NaOH恰好完全反应
A点溶液中的溶质是NaCl
B点表示NaOH有剩余
B点溶液中的溶质是NaCl和NaOH
C点表示HCl有剩余
C点溶液中的溶质是NaCl和HCl
拓展延伸
HCl+NaOH=NaCl+H2O
滴加NaOH溶液的体积(mL)
A点:pH<7,
此时溶液中的离子为_________
Cl-、H+
A~B段:pH逐渐增大,仍小于7,此时溶液中的离子为____________
Na+、Cl-、H+
B点:pH=7(反应结束),此时溶液中的离子为___________
Na+、Cl-
B~C段:pH逐渐增大,pH>7,此时溶液中的离子为________
Na+、Cl-、OH-
拓展延伸
温度最高,恰好完全反应。
中和反应是一个放热反应。
拓展延伸
中和反应在生产、生活中的应用
1.应用于医药卫生
2.改变土壤的酸碱性
3.处理工业废水
4.调节溶液的酸碱性
中 和 反 应
定义:酸和碱作用生成盐和水的反应叫做中和反应表达式:酸 + 碱 = 盐 + 水
实质:H+ + OH- = H2O
中和反应的应用:①应用于医药卫生;②改变土壤的酸碱性;③处理工业废水;④调节溶液的酸碱性
课堂小结
1.下列反应,属于中和反应的是( )
A. Ca(OH)2+ CO2==== CaCO3↓+H2O
B. CuO + 2HCl ==== CuCl2 + H2O
C. Cu(OH)2 + H2SO4 ==== CuSO4 + 2H2O
D. AgNO3 + HCl ==== AgCl↓+ HNO3
C
课堂练习
2.下表为常见物质的pH:
蚊虫叮咬人的皮肤分泌出蚁酸,涂哪种物质可减轻痛痒( )
A.牙膏或肥皂水 B.食盐水
C.盐酸 D.食醋
物质 食醋 牙膏 食盐水 肥皂水 盐酸
pH 3 9 7 10 2
A
课堂练习
3.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸
②用稀硫酸除铁锈
③用熟石灰改良酸性土壤
④用氢氧化镁治疗胃酸过多
A.①②③ B.②③④ C.①②④ D.①③④
D
课堂练习
4.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质
是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸
和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚
酞,溶液不变色
D.该实验是将盐酸逐滴滴入盛有氢氧化钠溶液的烧杯中
B
课堂练习
5.氢氧化钠溶液与盐酸反应的化学方程式为 。
如图是该反应的微观示意图,则该反应
前后没有发生变化的离子有 ;
从微观角度看,该化学反应的实质是 。
氢离子与氢氧根离子结合生成水分子
Na+、Cl﹣
NaOH+HCl=NaCl+ H2O
课堂练习
谢 谢 观 看
同课章节目录
