第八单元 第三节 第2课时 盐的化学性质及复分解反应 课件(共25张PPT) 2024-2025学年化学鲁教版九年级下册
文档属性
| 名称 | 第八单元 第三节 第2课时 盐的化学性质及复分解反应 课件(共25张PPT) 2024-2025学年化学鲁教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 413.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 22:34:35 | ||
图片预览






文档简介
(共25张PPT)
第八单元 海洋化学资源的利用
第三节 碳酸氢钠和碳酸钠
第2课时 盐的化学性质及复分解反应
新知导学
新知导学:
回顾:碳酸钠的化学性质有哪些?
1.碳酸钠的水溶液呈碱性。
2.碳酸钠能与酸反应。
3.碳酸钠能与某些碱溶液反应。
4.碳酸钠能与某些盐溶液反应。
新知导学
新知导学:
你能写出相关的化学方程式吗?
Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
Na2CO3 +H2SO4= Na2SO4+ H2O + CO2↑
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓
Na2CO3+ CaCl2 = 2NaCl+CaCO3↓
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐 + 盐 → 新盐 + 新盐
盐的化学性质
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐1 + 盐2 → 新盐1 + 新盐2
任务一 盐的化学性质
新知导学
Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
Na2CO3 +H2SO4= Na2SO4+ H2O + CO2↑
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓
Na2CO3+ CaCl2 = 2NaCl+CaCO3↓
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
观察下列化学方程式,你发现它们有何特点?
有人说这些反应像是“交换舞伴的舞蹈”,你能否解释其原因?
+1 +1
HCl + NaOH = H2O + NaCl
AD + CB
AB + CD
定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2.特点: 双交换,价不变。
1.表达式:
任务二 复分解反应
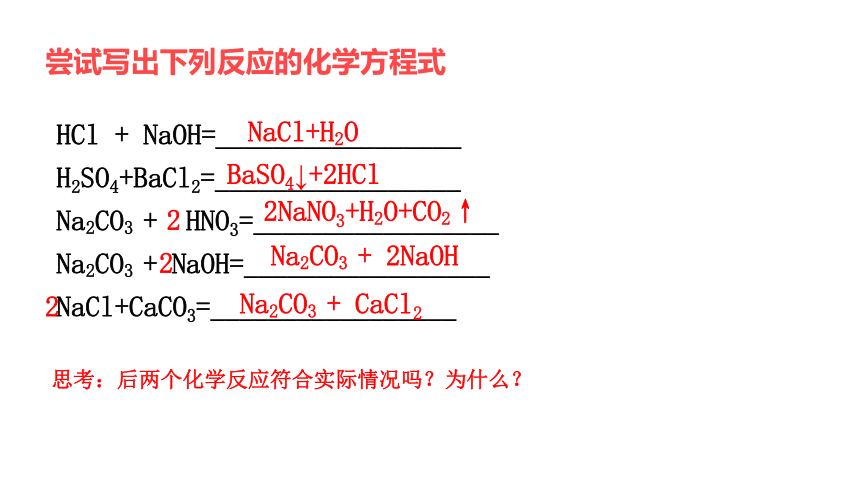
尝试写出下列反应的化学方程式
HCl + NaOH=_________________
H2SO4+BaCl2=_________________
Na2CO3 + HNO3=_________________
Na2CO3 + NaOH=_________________
NaCl+CaCO3=_________________
NaCl+H2O
BaSO4↓+2HCl
2NaNO3+H2O+CO2↑
2
Na2CO3 + 2NaOH
2
Na2CO3 + CaCl2
2
思考:后两个化学反应符合实际情况吗?为什么?
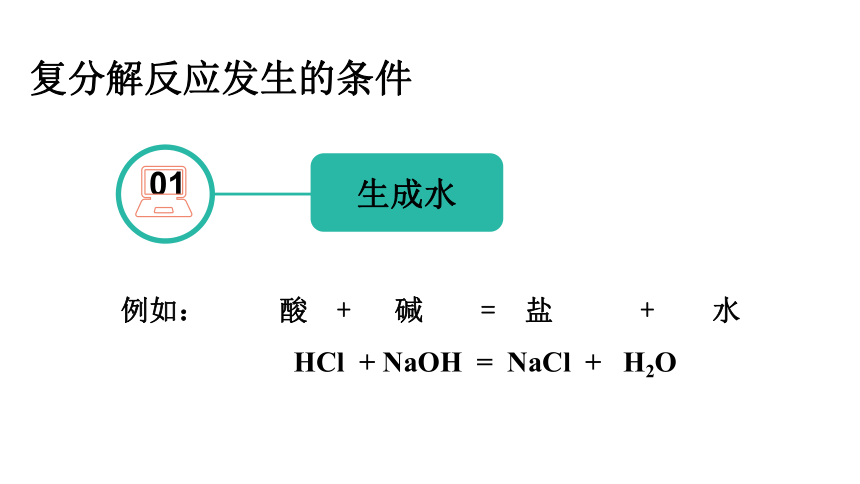
复分解反应发生的条件
01
生成水
例如: 酸 + 碱 = 盐 + 水
HCl + NaOH = NaCl + H2O
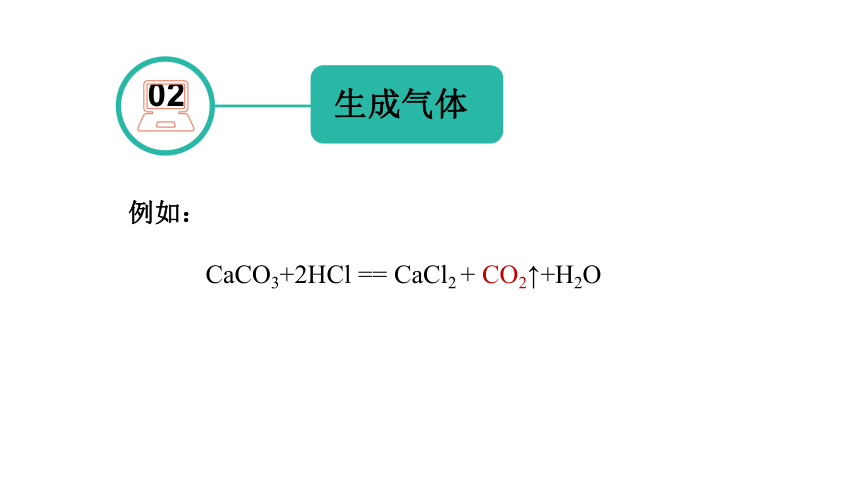
02
生成气体
例如:
CaCO3+2HCl == CaCl2 + CO2↑+H2O
03
生成沉淀
Ca(OH) 2 + Na2CO3 =2NaOH+CaCO3 ↓
H2SO4+BaCl2 = BaSO4↓ +2HCl
例如:
总结溶解性口诀:
钾、钠、硝酸、铵盐溶,
碳酸盐多数都不溶;
氯化物中氯化银,
硫酸盐中钡不溶;
钾、钙、钠、钡碱可溶。
03
生成沉淀
Ca(OH) 2 + Na2CO3 =2NaOH+CaCO3 ↓
Na2CO3+BaCl2 = BaCO3↓ +2NaCl
例如:
部 分 酸 碱 盐 的 溶 解 性 表 (20℃)
碱只溶五位,钾钠铵钙钡
酸均溶于水
硝酸盐均易溶
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
初中几种典型沉淀
不溶于酸的白色沉淀:BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
Mg(OH)2 ( 白色沉淀)
溶于酸的白色沉淀: BaCO3(白色沉淀)
CaCO3(白色沉淀)
AgCl(白色沉淀)
带颜色的沉淀: Fe(OH)3(红褐色沉淀)
酸、碱、盐之间发生的反应一般都属于复分解反应,但并不是任意的酸、碱、盐之间都能发生复分解反应,你知道是为什么吗?
想一想
NaOH
HCl
Na+
OH-
H+
Cl-
H2O
Na+
Cl-
NaOH+HCl===NaCl+H2O
复分解反应的实质
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3
HCl
HCl
Na+
Na+
CO32-
H+
H+
Cl-
Cl-
H2CO3
H2O
CO2↑
Na+
Na+
Cl-
Cl-
Na2CO3+BaCl2===2NaCl+BaCO3↓
Na2CO3
BaCl2
Na+
Na+
CO32-
Ba2+
Cl-
Cl-
BaCO3↓
Na+
Na+
Cl-
Cl-
复分解反应的实质
离子之间相互结合,生成沉淀(即难溶性的碱或盐)、气体 (不稳定的酸或碱分解放出)或水,溶液中离子种类就会发生改变,则复分解反应就能发生。
复分解反应的类型
酸
碱
盐
盐
1
2
3
4
金属氧化物
5
均可溶
1.酸 + 碱=
2.酸 + 盐=
3.碱 + 盐=
4.盐 + 盐=
5.酸+金属氧化物=
生成物依据化学方程式可推知
课堂小结
课堂小结
盐的化学性质及复分解反应
一、盐的化学性质
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐1 + 盐2 → 新盐1 + 新盐2
二、复分解反应
1.定义:由两种化合物互相交换成分,生成另外两种化合物的反应
2.条件:有沉淀、气体或水产生
3.实质:解离出的离子相互结合生成沉淀、气体或水的过程
1. 用盐酸除去水垢中Mg(OH)2的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应
C.复分解反应 D.置换反应
C
课堂练习
2.下列各组物质在溶液中不能发生复分解反应的是( )
A.HNO3、Ca(OH)2 B.KNO3、NaCl
C.AgNO3、HCl D.Na2CO3、H2SO4
B
课堂练习
3.下列各组离子在溶液中一定能大量共存的是( )
A.Na+、Cl-、OH-
B.K+、Ca2+、CO32-
C.H+、Cl-、CO32-
D.Na+、Fe3+、OH-
A
课堂练习
4.现有一包白色固体混合物,可能由BaCl2、KOH、KNO3、MgC12、CuSO4中的几种混合而成。为证明其组成,做了如下实验:取一定量混合物加入足量水,充分搅拌,得到白色沉淀和无色液体。则原混合物中一定含有__________________, 一定不含有________。
KOH 、MgCl2
CuSO4
课堂练习
谢 谢 观 看
第八单元 海洋化学资源的利用
第三节 碳酸氢钠和碳酸钠
第2课时 盐的化学性质及复分解反应
新知导学
新知导学:
回顾:碳酸钠的化学性质有哪些?
1.碳酸钠的水溶液呈碱性。
2.碳酸钠能与酸反应。
3.碳酸钠能与某些碱溶液反应。
4.碳酸钠能与某些盐溶液反应。
新知导学
新知导学:
你能写出相关的化学方程式吗?
Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
Na2CO3 +H2SO4= Na2SO4+ H2O + CO2↑
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓
Na2CO3+ CaCl2 = 2NaCl+CaCO3↓
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐 + 盐 → 新盐 + 新盐
盐的化学性质
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐1 + 盐2 → 新盐1 + 新盐2
任务一 盐的化学性质
新知导学
Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
Na2CO3 +H2SO4= Na2SO4+ H2O + CO2↑
Na2CO3+ Ca(OH)2 = 2NaOH+CaCO3↓
Na2CO3+ CaCl2 = 2NaCl+CaCO3↓
Na2CO3+ BaCl2 = 2NaCl+BaCO3↓
观察下列化学方程式,你发现它们有何特点?
有人说这些反应像是“交换舞伴的舞蹈”,你能否解释其原因?
+1 +1
HCl + NaOH = H2O + NaCl
AD + CB
AB + CD
定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2.特点: 双交换,价不变。
1.表达式:
任务二 复分解反应
尝试写出下列反应的化学方程式
HCl + NaOH=_________________
H2SO4+BaCl2=_________________
Na2CO3 + HNO3=_________________
Na2CO3 + NaOH=_________________
NaCl+CaCO3=_________________
NaCl+H2O
BaSO4↓+2HCl
2NaNO3+H2O+CO2↑
2
Na2CO3 + 2NaOH
2
Na2CO3 + CaCl2
2
思考:后两个化学反应符合实际情况吗?为什么?
复分解反应发生的条件
01
生成水
例如: 酸 + 碱 = 盐 + 水
HCl + NaOH = NaCl + H2O
02
生成气体
例如:
CaCO3+2HCl == CaCl2 + CO2↑+H2O
03
生成沉淀
Ca(OH) 2 + Na2CO3 =2NaOH+CaCO3 ↓
H2SO4+BaCl2 = BaSO4↓ +2HCl
例如:
总结溶解性口诀:
钾、钠、硝酸、铵盐溶,
碳酸盐多数都不溶;
氯化物中氯化银,
硫酸盐中钡不溶;
钾、钙、钠、钡碱可溶。
03
生成沉淀
Ca(OH) 2 + Na2CO3 =2NaOH+CaCO3 ↓
Na2CO3+BaCl2 = BaCO3↓ +2NaCl
例如:
部 分 酸 碱 盐 的 溶 解 性 表 (20℃)
碱只溶五位,钾钠铵钙钡
酸均溶于水
硝酸盐均易溶
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
初中几种典型沉淀
不溶于酸的白色沉淀:BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
Mg(OH)2 ( 白色沉淀)
溶于酸的白色沉淀: BaCO3(白色沉淀)
CaCO3(白色沉淀)
AgCl(白色沉淀)
带颜色的沉淀: Fe(OH)3(红褐色沉淀)
酸、碱、盐之间发生的反应一般都属于复分解反应,但并不是任意的酸、碱、盐之间都能发生复分解反应,你知道是为什么吗?
想一想
NaOH
HCl
Na+
OH-
H+
Cl-
H2O
Na+
Cl-
NaOH+HCl===NaCl+H2O
复分解反应的实质
Na2CO3+2HCl===2NaCl+H2O+CO2↑
Na2CO3
HCl
HCl
Na+
Na+
CO32-
H+
H+
Cl-
Cl-
H2CO3
H2O
CO2↑
Na+
Na+
Cl-
Cl-
Na2CO3+BaCl2===2NaCl+BaCO3↓
Na2CO3
BaCl2
Na+
Na+
CO32-
Ba2+
Cl-
Cl-
BaCO3↓
Na+
Na+
Cl-
Cl-
复分解反应的实质
离子之间相互结合,生成沉淀(即难溶性的碱或盐)、气体 (不稳定的酸或碱分解放出)或水,溶液中离子种类就会发生改变,则复分解反应就能发生。
复分解反应的类型
酸
碱
盐
盐
1
2
3
4
金属氧化物
5
均可溶
1.酸 + 碱=
2.酸 + 盐=
3.碱 + 盐=
4.盐 + 盐=
5.酸+金属氧化物=
生成物依据化学方程式可推知
课堂小结
课堂小结
盐的化学性质及复分解反应
一、盐的化学性质
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新碱 + 新盐
盐1 + 盐2 → 新盐1 + 新盐2
二、复分解反应
1.定义:由两种化合物互相交换成分,生成另外两种化合物的反应
2.条件:有沉淀、气体或水产生
3.实质:解离出的离子相互结合生成沉淀、气体或水的过程
1. 用盐酸除去水垢中Mg(OH)2的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应
C.复分解反应 D.置换反应
C
课堂练习
2.下列各组物质在溶液中不能发生复分解反应的是( )
A.HNO3、Ca(OH)2 B.KNO3、NaCl
C.AgNO3、HCl D.Na2CO3、H2SO4
B
课堂练习
3.下列各组离子在溶液中一定能大量共存的是( )
A.Na+、Cl-、OH-
B.K+、Ca2+、CO32-
C.H+、Cl-、CO32-
D.Na+、Fe3+、OH-
A
课堂练习
4.现有一包白色固体混合物,可能由BaCl2、KOH、KNO3、MgC12、CuSO4中的几种混合而成。为证明其组成,做了如下实验:取一定量混合物加入足量水,充分搅拌,得到白色沉淀和无色液体。则原混合物中一定含有__________________, 一定不含有________。
KOH 、MgCl2
CuSO4
课堂练习
谢 谢 观 看
同课章节目录
