1.4 物质性质的探究 课件(共33张PPT内嵌视频) 2024-2025学年化学科粤版九年级上册
文档属性
| 名称 | 1.4 物质性质的探究 课件(共33张PPT内嵌视频) 2024-2025学年化学科粤版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 77.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-28 15:13:34 | ||
图片预览







文档简介
(共33张PPT)
第一单元 大家都来学化学
1.4 物质性质的探究
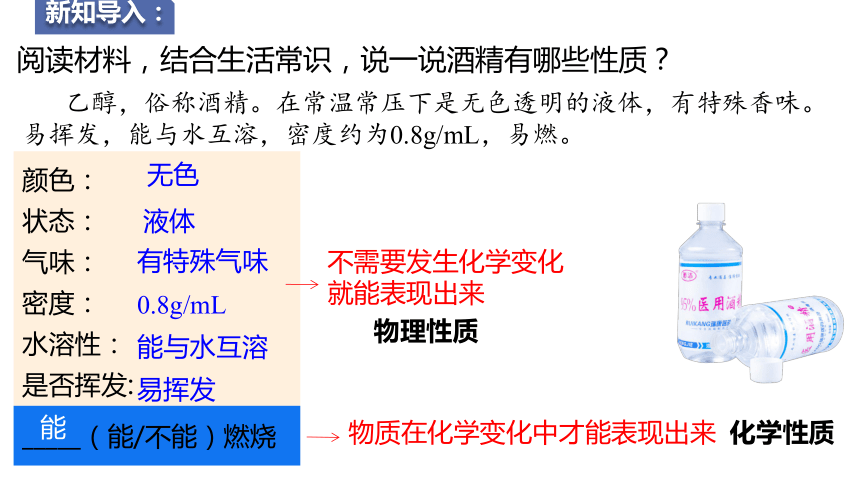
新知导入:
颜色: 状态: 气味: 密度: 水溶性: 是否挥发:
_____(能/不能)燃烧 阅读材料,结合生活常识,说一说酒精有哪些性质?
乙醇,俗称酒精。在常温常压下是无色透明的液体,有特殊香味。易挥发,能与水互溶,密度约为0.8g/mL,易燃。
能
不需要发生化学变化就能表现出来
物质在化学变化中才能表现出来
物理性质
化学性质
无色
液体
有特殊气味
0.8g/mL
能与水互溶
易挥发
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
化学性质
(1)定义:需要通过化学变化才能表现出来的性质。
木柴燃烧
木柴能燃烧
可燃性
化学变化
化学性质
铁生锈
铁能生锈
二氧化碳 .
能 使澄清石灰水变浑浊
二氧化碳
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
(2)常见的化学性质:
可燃性
毒性
酸碱性
活泼性
铁容易生锈,即铁的化学性质活泼
金很难生锈,即金的化学性质稳定
腐蚀性
稳定性
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
化学性质和物理性质的比较
化学性质 物理性质
概念 物质在化学变化中才能表现出来的性质 物质不需要发生化学变化就能表现出来的性质
范围 可燃性、稳定性、氧化性、还原性 、酸碱性、毒性······ 颜色、状态、气味、熔点、沸点 、硬度、密度、溶解性、挥发性、导电性······
实例 1.镁带能在空气中燃烧,说明镁具有可燃性 2.碱式碳酸铜受热能分解。说明它的热稳定性差 1.镁是银白色固体
2.二氧化碳是无色无气味的气体
3.酒精具有挥发性
4.金属铜具有导电性
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
物质的性质与变化的关系
区别:
物质的性质是物质固有的属性(特征)。
物质的变化是一个过程(正在进行)。
如:镁带在空气中燃烧是化学变化,
镁带能在空气中燃烧是化学性质;
化学变化
化学性质
一般描述物质性质的语言中有“可、易、能、会”等字,
如:酒精燃烧,酒精能燃烧 。
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
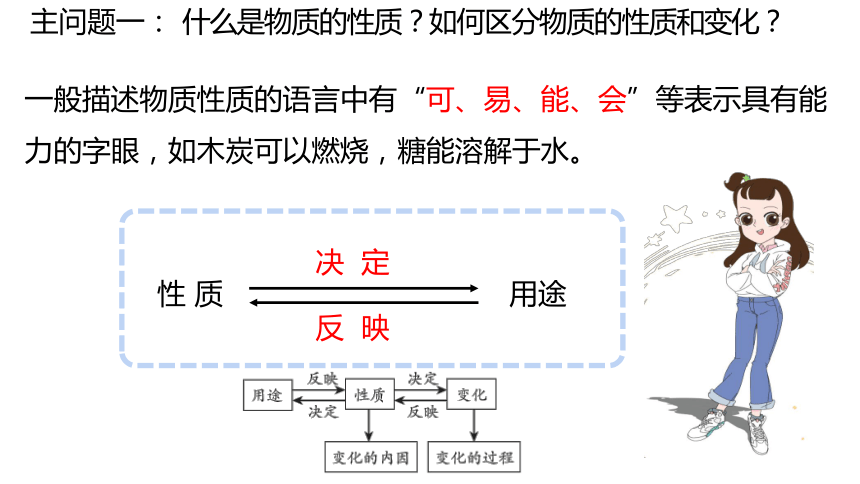
一般描述物质性质的语言中有“可、易、能、会”等表示具有能力的字眼,如木炭可以燃烧,糖能溶解于水。
性 质
决 定
用途
反 映
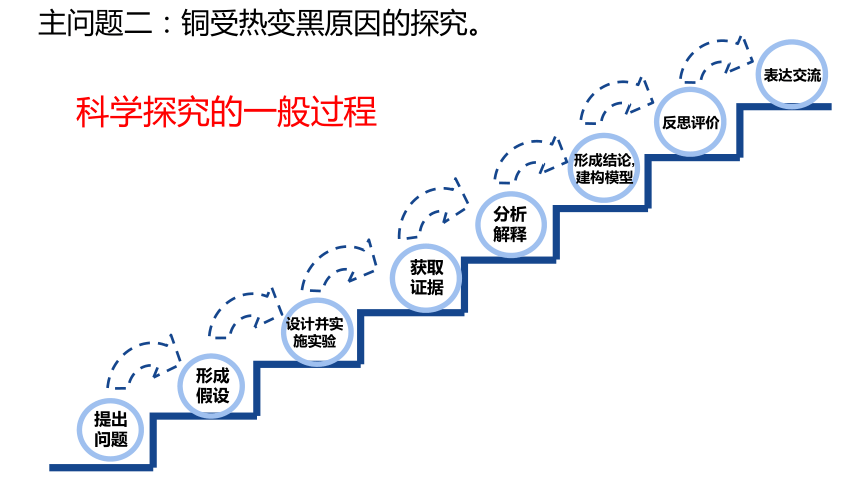
主问题二:铜受热变黑原因的探究。
科学探究的一般过程
提出
问题
形成假设
获取证据
设计并实施实验
分析解释
形成结论,建构模型
反思评价
表达交流
主问题二:铜受热变黑原因的探究。
加热铜丝实验
主问题二:铜受热变黑原因的探究。
小组交流讨论分析,铜丝受热变黑的原因
主问题二:铜受热变黑原因的探究。
问题假设 实验步骤 实验现象 解释结论
假设1:铜片变黑是因为火焰中的烟灰附着在铜片上。 用洁净的白色抹布轻轻擦一擦已冷却的铜片黑色部分;将一段光亮的铜片装在敞口的试管中,用酒精灯火焰加热试管,观察铜片是否变色。 黑色不能被擦掉;铜片变黑。 假设1错误。
假设2:铜片变黑是因为它与空气中的氧气发生化学反应。 用银白色的金属铝箔将铜片严密包裹,压紧,不留空隙,以保证隔绝空气,然后加热铝箔,一定时间后停止加热,待冷却后打开包裹的铝箔,观察铜片是否变色。 铜片不变黑。 假设2正确。
主问题二:铜受热变黑原因的探究。
问题假设 实验步骤 实验现象 解释结论
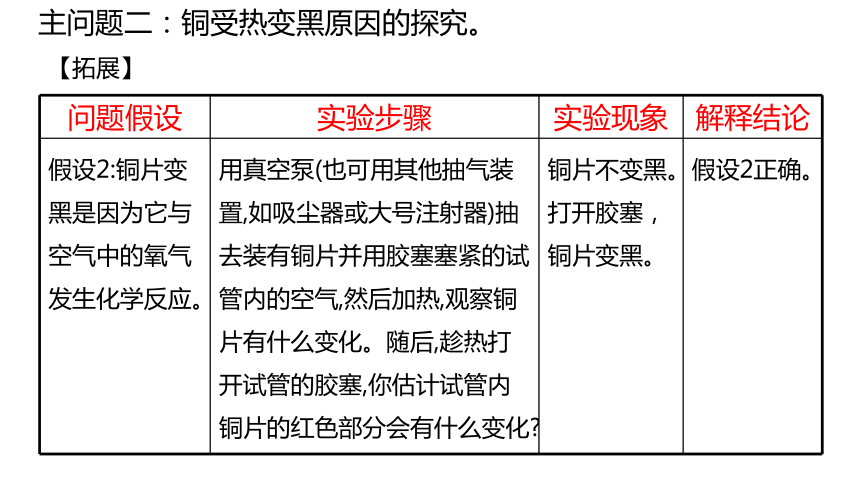
假设2:铜片变黑是因为它与空气中的氧气发生化学反应。 用真空泵(也可用其他抽气装置,如吸尘器或大号注射器)抽去装有铜片并用胶塞塞紧的试管内的空气,然后加热,观察铜片有什么变化。随后,趁热打开试管的胶塞,你估计试管内铜片的红色部分会有什么变化 铜片不变黑。打开胶塞,铜片变黑。 假设2正确。
【拓展】
主问题二:铜受热变黑原因的探究。
证明物质是氧化铜的方法:利用氧化铜能和稀硫酸反应而溶解,得到蓝色溶液的原理。
探究新知
主问题二:铜受热变黑原因的探究。
化学变化的文字表达式
如:铜受热
铜 +氧气 氧化铜
加热
四个注意:
1.参加反应的物质写在左边;
2.生成的物质写在右边;
3.用箭头连接,将反应条件写在箭头的上方;
4.当反应物和生成物的种类不止一种时,用“+”连接。
练习写文字表达式
1、磷和氧气在点燃条件下生成五氧化二磷
交流讨论:我们吸入的空气和呼出的气体一样吗?
吸气
吐气
呼吸作用
主问题三: 探究人体吸入和呼出气体成分含量的差异。
说明
水蒸气遇冷会液化
二氧化碳可以使澄清石灰水变浑浊,白色沉淀越多,说明气体中二氧化碳含量越多;二氧化碳可使燃着的木条熄灭
氧气可使带火星的木条复燃。木条燃烧越旺,说明气体中氧气含量越多
主问题三: 探究人体吸入和呼出气体成分含量的差异。
主问题三: 探究人体吸入和呼出气体成分含量的差异。
主问题三: 探究人体吸入和呼出气体成分含量的差异。
吸入空气中的氧气含量与呼出气体中的氧气含量的比较
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中氧气含量
实验现象 分析原因 得出结论
空气中的后熄灭
呼出气体中的先熄灭
呼出气体中氧气的含量比空气中的少,导致木条燃烧的时间比在空气中的短
小于
呼出气体中氧气的含量
空气中氧气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
吸入空气中的二氧化碳含量与呼出气体中的二氧化碳含量的比较
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中二氧化碳含量
实验现象 分析原因 得出结论
空气中的澄清石灰水无明显变化
呼出气体中的澄清石灰水变浑浊
呼出气体中二氧化碳的含量比空气中的多,导致澄清石灰水变浑浊
大于
呼出气体中二氧化碳的含量
空气中二氧化碳的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中水蒸气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中水蒸气的含量
实验现象 分析原因 得出结论
空气中的玻璃片无明显变化
哈气的玻璃片出现水雾
呼出气体中水蒸气的含量比空气中的多,哈气后水蒸气遇冷液化,导致哈气的玻璃片表面出现水雾
大于
呼出气体中水蒸气的含量
空气中水蒸气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
探究
人体吸入和呼出气体成分含量的差异
呼出的气体中二氧化碳的含量比空气中的多
呼出的气体中氧气的含量比空气中的少
呼出的气体中水蒸气的含量比空气中的多
课堂小结
课堂小结
水蒸气含量的比较
1.下列氧气性质的表述中,属于化学性质的是 ( )
A.无色、无气味 B.沸点低
C.能支持燃烧 D.不易溶于水
课堂练习
课堂练习
C
课堂练习
2.下列关于物质的性质或变化叙述正确的是 ( )
A.活性炭能吸附水中的固体小颗粒,可用于净水——利用了活性炭的化学性质
B.石蜡熔化——物理变化
C.蔗糖溶解——物理性质
D.氢气在氧气中燃烧生成水——化学性质
B
课堂练习
3.下列属于物理性质的是 ( )
A.可燃性 B.延展性 C.酸碱性 D.氧化性
4.下列叙述属于物质的物理性质的是 ( )
A.二氧化碳的密度比空气的大
B.铁在潮湿的空气中易生锈
C.一氧化碳有毒
D.木炭能在空气中燃烧
B
A
课堂练习
5.如图是探究空气和呼出气体中二氧化碳含量的差异。下列叙述不正确的是 ( )
A.滴入的澄清石灰水的滴数要相同
B.该实验证明呼出气体中二氧化碳的含量比
空气中的多
C.该实验证明人体呼出的气体是二氧化碳
D.滴入澄清石灰水后振荡集气瓶,有利于气液充分接触,产生更明显的现象
C
6.某化学兴趣小组将光亮铜片放在酒精灯外焰上灼烧,发现铜片表面变黑,他们对黑色物质的来源产生了兴趣,铜片表面的黑色物质是什么呢
[猜想与假设] 甲认为铜片表面的黑色物质是烟灰。乙认为铜片表面的黑色物质可能是空气中的氧气与铜反应生成的新物质;丙认为铜片表面的黑色物质既有烟灰,又有氧气与铜反应生成的新物质。
[查阅资料] ①酒精不充分燃烧产生炭黑(即黑烟);
②氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
课堂练习
[进行实验] 实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。由铜片变黑,试管外表面无黑色物质出现,可推知 (填“甲”“乙”或“丙”)的猜想错误。说明黑色物质的出现可能与空气中的 有关。
课堂练习
甲、丙
氧气
实验二:取一支试管,将一小段光亮铜片放入试管中,塞上胶塞,并用真空泵抽出试管内的空气,封好胶塞,加热,趁热取下胶塞,观察现象。取下胶塞前的现象:
;取下胶塞后的现象: 。说明乙的猜想正确。
[反思拓展] (1)实验一将铜片放入试管中加热,目的是排除
的干扰。
(2)实验二用真空泵抽出试管内的空气的目的是 。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的文字表达式:
。
课堂练习
无明显现象
铜片变黑
酒精不充分燃烧产生的炭黑
使铜片不与氧气接触
铜+氧气 氧化铜
加热
谢 谢 观 看
第一单元 大家都来学化学
1.4 物质性质的探究
新知导入:
颜色: 状态: 气味: 密度: 水溶性: 是否挥发:
_____(能/不能)燃烧 阅读材料,结合生活常识,说一说酒精有哪些性质?
乙醇,俗称酒精。在常温常压下是无色透明的液体,有特殊香味。易挥发,能与水互溶,密度约为0.8g/mL,易燃。
能
不需要发生化学变化就能表现出来
物质在化学变化中才能表现出来
物理性质
化学性质
无色
液体
有特殊气味
0.8g/mL
能与水互溶
易挥发
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
化学性质
(1)定义:需要通过化学变化才能表现出来的性质。
木柴燃烧
木柴能燃烧
可燃性
化学变化
化学性质
铁生锈
铁能生锈
二氧化碳 .
能 使澄清石灰水变浑浊
二氧化碳
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
(2)常见的化学性质:
可燃性
毒性
酸碱性
活泼性
铁容易生锈,即铁的化学性质活泼
金很难生锈,即金的化学性质稳定
腐蚀性
稳定性
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
化学性质和物理性质的比较
化学性质 物理性质
概念 物质在化学变化中才能表现出来的性质 物质不需要发生化学变化就能表现出来的性质
范围 可燃性、稳定性、氧化性、还原性 、酸碱性、毒性······ 颜色、状态、气味、熔点、沸点 、硬度、密度、溶解性、挥发性、导电性······
实例 1.镁带能在空气中燃烧,说明镁具有可燃性 2.碱式碳酸铜受热能分解。说明它的热稳定性差 1.镁是银白色固体
2.二氧化碳是无色无气味的气体
3.酒精具有挥发性
4.金属铜具有导电性
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
物质的性质与变化的关系
区别:
物质的性质是物质固有的属性(特征)。
物质的变化是一个过程(正在进行)。
如:镁带在空气中燃烧是化学变化,
镁带能在空气中燃烧是化学性质;
化学变化
化学性质
一般描述物质性质的语言中有“可、易、能、会”等字,
如:酒精燃烧,酒精能燃烧 。
主问题一: 什么是物质的性质?如何区分物质的性质和变化?
一般描述物质性质的语言中有“可、易、能、会”等表示具有能力的字眼,如木炭可以燃烧,糖能溶解于水。
性 质
决 定
用途
反 映
主问题二:铜受热变黑原因的探究。
科学探究的一般过程
提出
问题
形成假设
获取证据
设计并实施实验
分析解释
形成结论,建构模型
反思评价
表达交流
主问题二:铜受热变黑原因的探究。
加热铜丝实验
主问题二:铜受热变黑原因的探究。
小组交流讨论分析,铜丝受热变黑的原因
主问题二:铜受热变黑原因的探究。
问题假设 实验步骤 实验现象 解释结论
假设1:铜片变黑是因为火焰中的烟灰附着在铜片上。 用洁净的白色抹布轻轻擦一擦已冷却的铜片黑色部分;将一段光亮的铜片装在敞口的试管中,用酒精灯火焰加热试管,观察铜片是否变色。 黑色不能被擦掉;铜片变黑。 假设1错误。
假设2:铜片变黑是因为它与空气中的氧气发生化学反应。 用银白色的金属铝箔将铜片严密包裹,压紧,不留空隙,以保证隔绝空气,然后加热铝箔,一定时间后停止加热,待冷却后打开包裹的铝箔,观察铜片是否变色。 铜片不变黑。 假设2正确。
主问题二:铜受热变黑原因的探究。
问题假设 实验步骤 实验现象 解释结论
假设2:铜片变黑是因为它与空气中的氧气发生化学反应。 用真空泵(也可用其他抽气装置,如吸尘器或大号注射器)抽去装有铜片并用胶塞塞紧的试管内的空气,然后加热,观察铜片有什么变化。随后,趁热打开试管的胶塞,你估计试管内铜片的红色部分会有什么变化 铜片不变黑。打开胶塞,铜片变黑。 假设2正确。
【拓展】
主问题二:铜受热变黑原因的探究。
证明物质是氧化铜的方法:利用氧化铜能和稀硫酸反应而溶解,得到蓝色溶液的原理。
探究新知
主问题二:铜受热变黑原因的探究。
化学变化的文字表达式
如:铜受热
铜 +氧气 氧化铜
加热
四个注意:
1.参加反应的物质写在左边;
2.生成的物质写在右边;
3.用箭头连接,将反应条件写在箭头的上方;
4.当反应物和生成物的种类不止一种时,用“+”连接。
练习写文字表达式
1、磷和氧气在点燃条件下生成五氧化二磷
交流讨论:我们吸入的空气和呼出的气体一样吗?
吸气
吐气
呼吸作用
主问题三: 探究人体吸入和呼出气体成分含量的差异。
说明
水蒸气遇冷会液化
二氧化碳可以使澄清石灰水变浑浊,白色沉淀越多,说明气体中二氧化碳含量越多;二氧化碳可使燃着的木条熄灭
氧气可使带火星的木条复燃。木条燃烧越旺,说明气体中氧气含量越多
主问题三: 探究人体吸入和呼出气体成分含量的差异。
主问题三: 探究人体吸入和呼出气体成分含量的差异。
主问题三: 探究人体吸入和呼出气体成分含量的差异。
吸入空气中的氧气含量与呼出气体中的氧气含量的比较
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中氧气含量
实验现象 分析原因 得出结论
空气中的后熄灭
呼出气体中的先熄灭
呼出气体中氧气的含量比空气中的少,导致木条燃烧的时间比在空气中的短
小于
呼出气体中氧气的含量
空气中氧气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
吸入空气中的二氧化碳含量与呼出气体中的二氧化碳含量的比较
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中二氧化碳含量
实验现象 分析原因 得出结论
空气中的澄清石灰水无明显变化
呼出气体中的澄清石灰水变浑浊
呼出气体中二氧化碳的含量比空气中的多,导致澄清石灰水变浑浊
大于
呼出气体中二氧化碳的含量
空气中二氧化碳的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中水蒸气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
比较吸入空气和呼出气体中水蒸气的含量
实验现象 分析原因 得出结论
空气中的玻璃片无明显变化
哈气的玻璃片出现水雾
呼出气体中水蒸气的含量比空气中的多,哈气后水蒸气遇冷液化,导致哈气的玻璃片表面出现水雾
大于
呼出气体中水蒸气的含量
空气中水蒸气的含量
主问题三: 探究人体吸入和呼出气体成分含量的差异。
探究
人体吸入和呼出气体成分含量的差异
呼出的气体中二氧化碳的含量比空气中的多
呼出的气体中氧气的含量比空气中的少
呼出的气体中水蒸气的含量比空气中的多
课堂小结
课堂小结
水蒸气含量的比较
1.下列氧气性质的表述中,属于化学性质的是 ( )
A.无色、无气味 B.沸点低
C.能支持燃烧 D.不易溶于水
课堂练习
课堂练习
C
课堂练习
2.下列关于物质的性质或变化叙述正确的是 ( )
A.活性炭能吸附水中的固体小颗粒,可用于净水——利用了活性炭的化学性质
B.石蜡熔化——物理变化
C.蔗糖溶解——物理性质
D.氢气在氧气中燃烧生成水——化学性质
B
课堂练习
3.下列属于物理性质的是 ( )
A.可燃性 B.延展性 C.酸碱性 D.氧化性
4.下列叙述属于物质的物理性质的是 ( )
A.二氧化碳的密度比空气的大
B.铁在潮湿的空气中易生锈
C.一氧化碳有毒
D.木炭能在空气中燃烧
B
A
课堂练习
5.如图是探究空气和呼出气体中二氧化碳含量的差异。下列叙述不正确的是 ( )
A.滴入的澄清石灰水的滴数要相同
B.该实验证明呼出气体中二氧化碳的含量比
空气中的多
C.该实验证明人体呼出的气体是二氧化碳
D.滴入澄清石灰水后振荡集气瓶,有利于气液充分接触,产生更明显的现象
C
6.某化学兴趣小组将光亮铜片放在酒精灯外焰上灼烧,发现铜片表面变黑,他们对黑色物质的来源产生了兴趣,铜片表面的黑色物质是什么呢
[猜想与假设] 甲认为铜片表面的黑色物质是烟灰。乙认为铜片表面的黑色物质可能是空气中的氧气与铜反应生成的新物质;丙认为铜片表面的黑色物质既有烟灰,又有氧气与铜反应生成的新物质。
[查阅资料] ①酒精不充分燃烧产生炭黑(即黑烟);
②氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
课堂练习
[进行实验] 实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。由铜片变黑,试管外表面无黑色物质出现,可推知 (填“甲”“乙”或“丙”)的猜想错误。说明黑色物质的出现可能与空气中的 有关。
课堂练习
甲、丙
氧气
实验二:取一支试管,将一小段光亮铜片放入试管中,塞上胶塞,并用真空泵抽出试管内的空气,封好胶塞,加热,趁热取下胶塞,观察现象。取下胶塞前的现象:
;取下胶塞后的现象: 。说明乙的猜想正确。
[反思拓展] (1)实验一将铜片放入试管中加热,目的是排除
的干扰。
(2)实验二用真空泵抽出试管内的空气的目的是 。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的文字表达式:
。
课堂练习
无明显现象
铜片变黑
酒精不充分燃烧产生的炭黑
使铜片不与氧气接触
铜+氧气 氧化铜
加热
谢 谢 观 看
同课章节目录
