2.2 第2课时 原子、原子的结构 课件(共37张PPT内嵌视频) 2024-2025学年化学科粤版九年级上册
文档属性
| 名称 | 2.2 第2课时 原子、原子的结构 课件(共37张PPT内嵌视频) 2024-2025学年化学科粤版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 56.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-28 15:17:38 | ||
图片预览










文档简介
(共37张PPT)
第二单元 空气、物质的构成与组成
2.2 构成物质的微观粒子
第2课时 原子、原子的结构
新知导入:
新知导入:
科学发展永无止境,原子的概念最初是古代哲学家提出的。原子是否可以再分,内部有什么结构,今天我们一起来学习原子及其内部结构。
主问题一:什么是原子?它有什么特性?
原
子
的
探
索
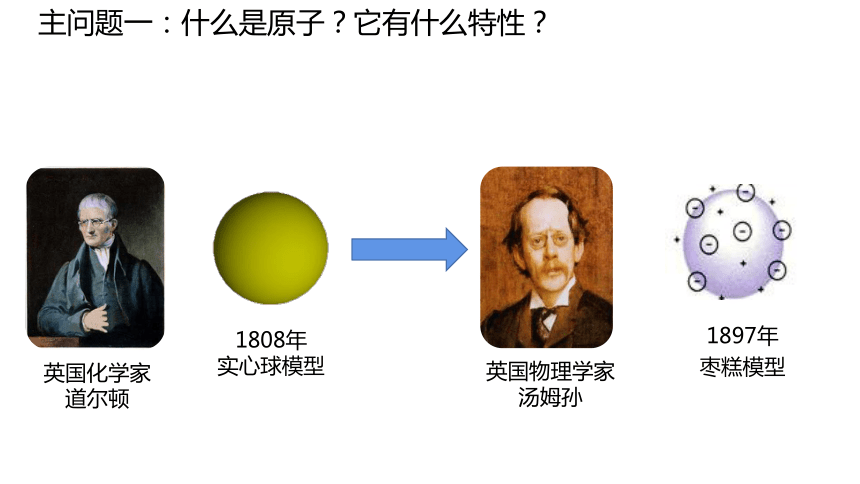
主问题一:什么是原子?它有什么特性?
英国化学家
道尔顿
1808年
实心球模型
英国物理学家
汤姆孙
1897年
枣糕模型
主问题一:什么是原子?它有什么特性?
英国科学家
卢瑟福
英国物理学家 查德维克
1911年
行星式有核原子模型
1921-1932年 发现中子
主问题一:什么是原子?它有什么特性?
主问题一:什么是原子?它有什么特性?
交流讨论:
1.在化学变化中,氧化汞分解成什么
2.氧化汞分子由什么构成
3.氧化汞分子本身有没有发生变化 如有的话,变成了什么
主问题一:什么是原子?它有什么特性?
化学反应的微观实质
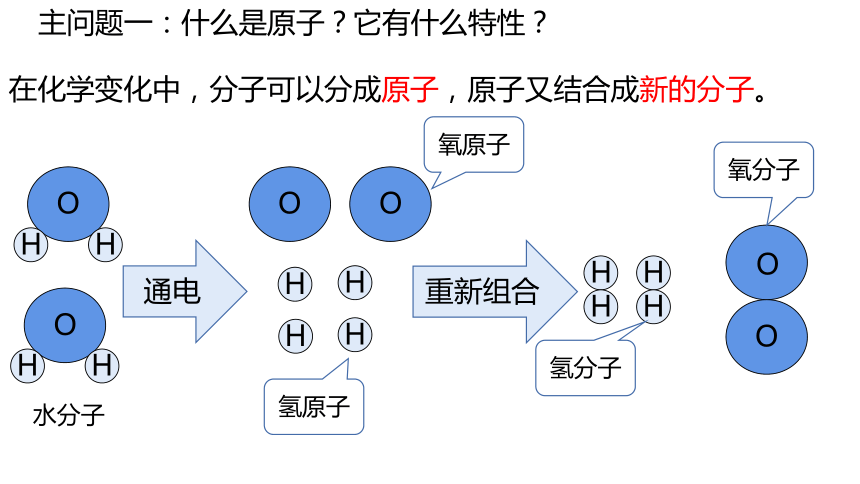
主问题一:什么是原子?它有什么特性?
在化学变化中,分子可以分成原子,原子又结合成新的分子。
通电
重新组合
O
H
H
O
H
H
水分子
O
H
H
O
H
H
氧原子
氢原子
H
H
O
O
H
H
氧分子
氢分子
主问题一:什么是原子?它有什么特性?
归纳总结
1.原子是构成物质的另一种微观粒子。
2.原子构成分子,原子也可直接构成某些物质。
3.在化学变化中,分子本身发生变化,而原子本身没有发生根本变化,只是重新组成新分子,构成新物质,所以,原子是化学变化中的最小微观粒子。
主问题一:什么是原子?它有什么特性?
不同角度解释物质的变化
变化 宏观 微观 实例
物理变化 没有新物质生成 由分子构成的物质在发生物理变化时,分子本身没有发生变化 水蒸发时,水分子本身没有变化,只是水分子间的间隔发生了改变
化学变化 有新物质生成 由分子构成的物质在发生化学变化时,分子发生了变化,变成了其他物质的分子 过氧化氢分解制取氧气时,过氧化氢分子变成了水分子和氧分子
主问题一:什么是原子?它有什么特性?
由原子直接构成的物质
金属 镁(Mg) 铝(Al) 铁(Fe) 铜(Cu) 汞(Hg)
稀有气体 氦气(He) 氖气(Ne) 氩气(Ar) 氪(Kr) 氙(Xe)
固态非金属 碳(C) 金刚石(C) 硫(S) 磷(P) 硅(Si)
主问题一:什么是原子?它有什么特性?
原子的基本性质
1.原子质量和体积都很小。
2.原子在不断运动。
3.原子之间有间隔。
4.同种原子,化学性质相同;不同种原子,化学性质不同。
主问题二:分子和原子有何区别和联系
分子、原子的区别和联系
分 子 原 子
概念 由分子构成的物质,分子是保持其化学性质的最小微观粒子 化学变化中的最小微观粒子
相 同 点 1.质量和体积都很小。 2.在不断地运动。 3.微观粒子之间有间隔。 4.同种分子,化学性质相同;不同种分子,化学性质不同。同种原子,化学性质相同;不同种原子,化学性质不同 本质 区别 化学变化中可以再分 (在化学反应中分子分解成原子,原子重新组合成新的分子) 化学变化中不能再分,在化学反应前后,原子的种类
不变
相互联系 分子可以分成原子,原子可以构成分子 注意 分子可以构成物质,原子也可以直接构成物质; 分子不一定比原子大,但分子一定比构成它的原子大 主问题二:分子和原子有何区别和联系
特别说明:
分子可以构成物质,原子也可以直接构成物质;分子不一定比原子大,但分子一定比构成它的原子大。
原子的探索
道尔顿
汤姆生
卢瑟福
玻 尔
20世纪20年代
电子云模型
量子力学
人 类
探 索 的 脚 步
从 未 停 止
主问题三:原子内部有何奥秘?
主问题三:原子内部有何奥秘?
主问题三:原子内部有何奥秘?
带负电
带正电
中子
质子
电子
不带电
原子核
绕核做高速运动
带正电
核电荷数:原子核所带的电荷数
+
-
+
核电荷数 质子数
=
原子带电吗?
3个
3个
3个
电子数
=
不带电
+
-
主问题三:原子内部有何奥秘?
日常生活中我们用手接触铁、铜等金属会触电吗?
铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),那么原子是否显电性?
主问题三:原子内部有何奥秘?
原子核内质子所带电荷与核外电子所带电荷的数量相等,电性相反,因此原子不显电性(即电中性)。
主问题三:原子内部有何奥秘?
原子种类 原 子 核 核外电子数
质子数 中子数 氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
铁 26 30 26
质子数 = 核外电子数
不是所有的原子都有中子
不同类原子,原子核内质子数不同
第一层
第二层
第三层
原子核外电子的排布
主问题三:原子内部有何奥秘?
主问题四:原子核外电子是如何排布的?
电子不像行星绕太阳旋转那样有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。
电子层:1 2 3 4 5 6 7
离核:近
能量:低
能量低的电子在离核近的区域运动
能量高的电子在离核远的区域运动
电子在核外分层排布
远
高
主问题四:原子核外电子是如何排布的?
原子核
核电荷数(质子数)
该电子层上的电子数
Na
原子结构示意图
+11
2
8
1
电子层
最外电子层
主问题四:原子核外电子是如何排布的?
氢
氦
锂
铍
硼
碳
氮
氧
氟
氖
钠
镁
铝
硅
磷
硫
氯
氩
下列是部分原子结构示意图
看图你能找出什么规律吗?
金属原子
非金属原子
稀有气体
主问题四:原子核外电子是如何排布的?
原子最外层电子数与结构、性质的关系
原 子 种 类 最外层电子数 原子结构 化学性质 变 化 趋 势
金 属 原 子
非金属 原子
稀有气 体原子
8(氦为2 )
一 般≥4
一般< 4
相对稳定结构
稳定
不易得
失电子
不稳定结构
易失电子
不稳定
不稳定结构
易得电子
不稳定
主问题四:原子核外电子是如何排布的?
原子的化学性质与最外层电子数关系密切
结构
性质
决定
课堂小结
课堂小结
课堂练习
课堂练习
1.如图所示为通过移动硅原子构成的文字,下列有关硅原子的表述错误的是 ( )
A.原子之间有间隔
B.原子是客观存在的
C.原子是最小的微观粒子
D.硅原子构成硅这种物质
C
2.化学上称“原子是化学变化中的最小微观粒子”的依据是
( )
A.原子的质量很小 B.原子是构成物质的最小微观粒子
C.原子的体积很小 D.原子在化学变化中不可再分
课堂练习
D
3.如图为某反应的微观示意图,下列从图中获得的有关信息不正确的是 ( )
A.分子间存在一定的间隔
B.该过程为物理变化
C.原子是化学变化中的最小微观粒子
D.化学反应前后原子的数目没有变化
课堂练习
B
课堂练习
4.氧化汞分解反应的示意图如右图所示。下列说法正确的是
( )
A.在化学变化中,分子可以分成原子
B.分子是化学变化中的最小微观粒子
C.在这个变化中,原子的种类发生改变
D.物质只能由分子构成,不能由原子构成
A
课堂练习
5.用分子、原子、质子、中子、电子、原子核填空。
①可以构成物质的微观粒子有 。
②不显电性或呈电中性的微观粒子有 。
③带正电荷的微观粒子有 。
④带负电荷的微观粒子有 。
⑤质量最小的微观粒子是 。
分子、原子
分子、原子、中子
质子、原子核
电子
电子
6.原子核中一定含有的微观粒子是 ( )
A.中子 B.质子 C.电子 D.质子和电子
7.“悟空”号卫星上的计算机被太空中带正电荷的某些粒子击中,导致“死机”,在遥控指令下,计算机重新启动,卫星恢复正常。带正电荷的粒子可能是 ( )
A.原子核、质子 B.原子核、中子
C.电子、原子核 D.电子、质子
B
A
课堂练习
8.如图为某种碳原子的结构模型,从模型中可以看出构成碳原子的有
种微观粒子,其中不显电性的微观粒子是 ,整个碳原子不显电性,这是因为 。
中子
三
原子核所带的电量和核外电子所带的电量相等,电性相反
课堂练习
谢 谢 观 看
第二单元 空气、物质的构成与组成
2.2 构成物质的微观粒子
第2课时 原子、原子的结构
新知导入:
新知导入:
科学发展永无止境,原子的概念最初是古代哲学家提出的。原子是否可以再分,内部有什么结构,今天我们一起来学习原子及其内部结构。
主问题一:什么是原子?它有什么特性?
原
子
的
探
索
主问题一:什么是原子?它有什么特性?
英国化学家
道尔顿
1808年
实心球模型
英国物理学家
汤姆孙
1897年
枣糕模型
主问题一:什么是原子?它有什么特性?
英国科学家
卢瑟福
英国物理学家 查德维克
1911年
行星式有核原子模型
1921-1932年 发现中子
主问题一:什么是原子?它有什么特性?
主问题一:什么是原子?它有什么特性?
交流讨论:
1.在化学变化中,氧化汞分解成什么
2.氧化汞分子由什么构成
3.氧化汞分子本身有没有发生变化 如有的话,变成了什么
主问题一:什么是原子?它有什么特性?
化学反应的微观实质
主问题一:什么是原子?它有什么特性?
在化学变化中,分子可以分成原子,原子又结合成新的分子。
通电
重新组合
O
H
H
O
H
H
水分子
O
H
H
O
H
H
氧原子
氢原子
H
H
O
O
H
H
氧分子
氢分子
主问题一:什么是原子?它有什么特性?
归纳总结
1.原子是构成物质的另一种微观粒子。
2.原子构成分子,原子也可直接构成某些物质。
3.在化学变化中,分子本身发生变化,而原子本身没有发生根本变化,只是重新组成新分子,构成新物质,所以,原子是化学变化中的最小微观粒子。
主问题一:什么是原子?它有什么特性?
不同角度解释物质的变化
变化 宏观 微观 实例
物理变化 没有新物质生成 由分子构成的物质在发生物理变化时,分子本身没有发生变化 水蒸发时,水分子本身没有变化,只是水分子间的间隔发生了改变
化学变化 有新物质生成 由分子构成的物质在发生化学变化时,分子发生了变化,变成了其他物质的分子 过氧化氢分解制取氧气时,过氧化氢分子变成了水分子和氧分子
主问题一:什么是原子?它有什么特性?
由原子直接构成的物质
金属 镁(Mg) 铝(Al) 铁(Fe) 铜(Cu) 汞(Hg)
稀有气体 氦气(He) 氖气(Ne) 氩气(Ar) 氪(Kr) 氙(Xe)
固态非金属 碳(C) 金刚石(C) 硫(S) 磷(P) 硅(Si)
主问题一:什么是原子?它有什么特性?
原子的基本性质
1.原子质量和体积都很小。
2.原子在不断运动。
3.原子之间有间隔。
4.同种原子,化学性质相同;不同种原子,化学性质不同。
主问题二:分子和原子有何区别和联系
分子、原子的区别和联系
分 子 原 子
概念 由分子构成的物质,分子是保持其化学性质的最小微观粒子 化学变化中的最小微观粒子
相 同 点 1.质量和体积都很小。 2.在不断地运动。 3.微观粒子之间有间隔。 4.同种分子,化学性质相同;不同种分子,化学性质不同。同种原子,化学性质相同;不同种原子,化学性质不同 本质 区别 化学变化中可以再分 (在化学反应中分子分解成原子,原子重新组合成新的分子) 化学变化中不能再分,在化学反应前后,原子的种类
不变
相互联系 分子可以分成原子,原子可以构成分子 注意 分子可以构成物质,原子也可以直接构成物质; 分子不一定比原子大,但分子一定比构成它的原子大 主问题二:分子和原子有何区别和联系
特别说明:
分子可以构成物质,原子也可以直接构成物质;分子不一定比原子大,但分子一定比构成它的原子大。
原子的探索
道尔顿
汤姆生
卢瑟福
玻 尔
20世纪20年代
电子云模型
量子力学
人 类
探 索 的 脚 步
从 未 停 止
主问题三:原子内部有何奥秘?
主问题三:原子内部有何奥秘?
主问题三:原子内部有何奥秘?
带负电
带正电
中子
质子
电子
不带电
原子核
绕核做高速运动
带正电
核电荷数:原子核所带的电荷数
+
-
+
核电荷数 质子数
=
原子带电吗?
3个
3个
3个
电子数
=
不带电
+
-
主问题三:原子内部有何奥秘?
日常生活中我们用手接触铁、铜等金属会触电吗?
铁、铜等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),那么原子是否显电性?
主问题三:原子内部有何奥秘?
原子核内质子所带电荷与核外电子所带电荷的数量相等,电性相反,因此原子不显电性(即电中性)。
主问题三:原子内部有何奥秘?
原子种类 原 子 核 核外电子数
质子数 中子数 氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
铁 26 30 26
质子数 = 核外电子数
不是所有的原子都有中子
不同类原子,原子核内质子数不同
第一层
第二层
第三层
原子核外电子的排布
主问题三:原子内部有何奥秘?
主问题四:原子核外电子是如何排布的?
电子不像行星绕太阳旋转那样有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。
电子层:1 2 3 4 5 6 7
离核:近
能量:低
能量低的电子在离核近的区域运动
能量高的电子在离核远的区域运动
电子在核外分层排布
远
高
主问题四:原子核外电子是如何排布的?
原子核
核电荷数(质子数)
该电子层上的电子数
Na
原子结构示意图
+11
2
8
1
电子层
最外电子层
主问题四:原子核外电子是如何排布的?
氢
氦
锂
铍
硼
碳
氮
氧
氟
氖
钠
镁
铝
硅
磷
硫
氯
氩
下列是部分原子结构示意图
看图你能找出什么规律吗?
金属原子
非金属原子
稀有气体
主问题四:原子核外电子是如何排布的?
原子最外层电子数与结构、性质的关系
原 子 种 类 最外层电子数 原子结构 化学性质 变 化 趋 势
金 属 原 子
非金属 原子
稀有气 体原子
8(氦为2 )
一 般≥4
一般< 4
相对稳定结构
稳定
不易得
失电子
不稳定结构
易失电子
不稳定
不稳定结构
易得电子
不稳定
主问题四:原子核外电子是如何排布的?
原子的化学性质与最外层电子数关系密切
结构
性质
决定
课堂小结
课堂小结
课堂练习
课堂练习
1.如图所示为通过移动硅原子构成的文字,下列有关硅原子的表述错误的是 ( )
A.原子之间有间隔
B.原子是客观存在的
C.原子是最小的微观粒子
D.硅原子构成硅这种物质
C
2.化学上称“原子是化学变化中的最小微观粒子”的依据是
( )
A.原子的质量很小 B.原子是构成物质的最小微观粒子
C.原子的体积很小 D.原子在化学变化中不可再分
课堂练习
D
3.如图为某反应的微观示意图,下列从图中获得的有关信息不正确的是 ( )
A.分子间存在一定的间隔
B.该过程为物理变化
C.原子是化学变化中的最小微观粒子
D.化学反应前后原子的数目没有变化
课堂练习
B
课堂练习
4.氧化汞分解反应的示意图如右图所示。下列说法正确的是
( )
A.在化学变化中,分子可以分成原子
B.分子是化学变化中的最小微观粒子
C.在这个变化中,原子的种类发生改变
D.物质只能由分子构成,不能由原子构成
A
课堂练习
5.用分子、原子、质子、中子、电子、原子核填空。
①可以构成物质的微观粒子有 。
②不显电性或呈电中性的微观粒子有 。
③带正电荷的微观粒子有 。
④带负电荷的微观粒子有 。
⑤质量最小的微观粒子是 。
分子、原子
分子、原子、中子
质子、原子核
电子
电子
6.原子核中一定含有的微观粒子是 ( )
A.中子 B.质子 C.电子 D.质子和电子
7.“悟空”号卫星上的计算机被太空中带正电荷的某些粒子击中,导致“死机”,在遥控指令下,计算机重新启动,卫星恢复正常。带正电荷的粒子可能是 ( )
A.原子核、质子 B.原子核、中子
C.电子、原子核 D.电子、质子
B
A
课堂练习
8.如图为某种碳原子的结构模型,从模型中可以看出构成碳原子的有
种微观粒子,其中不显电性的微观粒子是 ,整个碳原子不显电性,这是因为 。
中子
三
原子核所带的电量和核外电子所带的电量相等,电性相反
课堂练习
谢 谢 观 看
同课章节目录
