2.2 课时1 杂化轨道理论 课件 (共21张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时1 杂化轨道理论 课件 (共21张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 01:09:01 | ||
图片预览




文档简介
(共21张PPT)
杂化轨道理论
第2章 微粒间相互作用与物质性质
1.了解杂化轨道理论的要点和类型;
2.能运用杂化轨道理论解释简单共价分子和离子的空间结构。
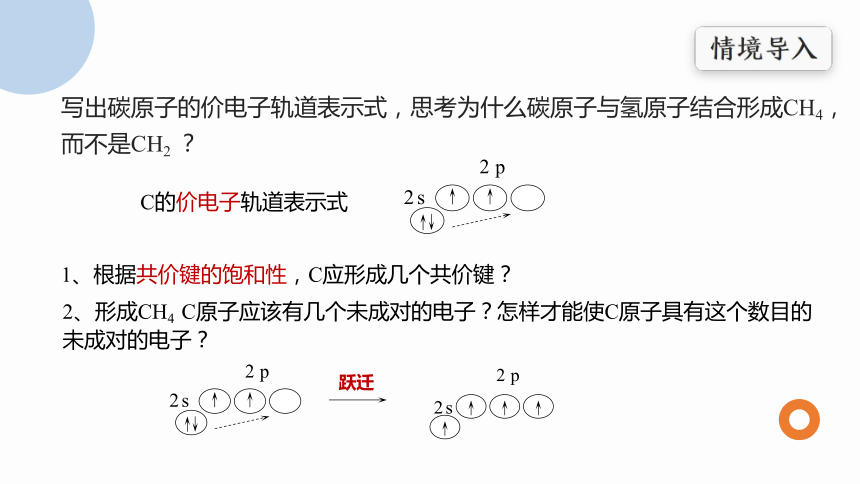
写出碳原子的价电子轨道表示式,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
C的价电子轨道表示式
1、根据共价键的饱和性,C应形成几个共价键?
2、形成CH4 C原子应该有几个未成对的电子?怎样才能使C原子具有这个数目的未成对的电子?
跃迁
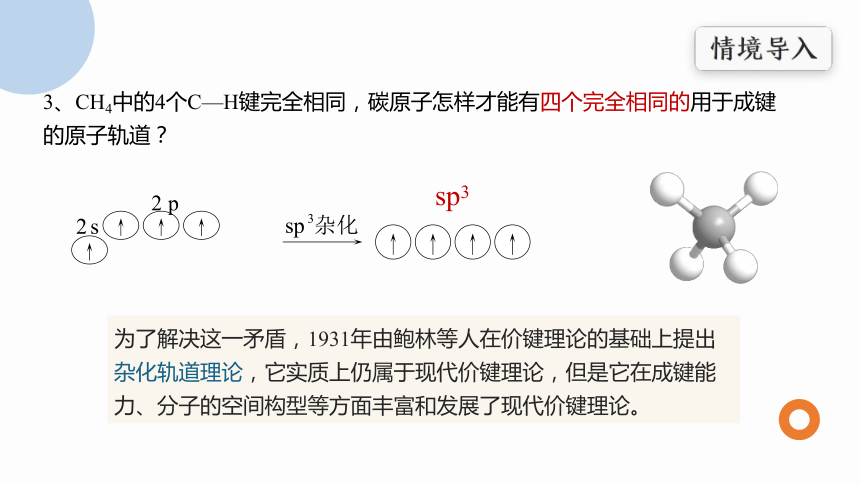
3、CH4中的4个C—H键完全相同,碳原子怎样才能有四个完全相同的用于成键的原子轨道?
sp3
为了解决这一矛盾,1931年由鲍林等人在价键理论的基础上提出杂化轨道理论,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
2s
2p
↑↓
↑
↑
基态
激发
2s
2p
↑
↑
↑
↑
激发态
4个sp3杂化轨道
杂化
↑
↑
↑
↑
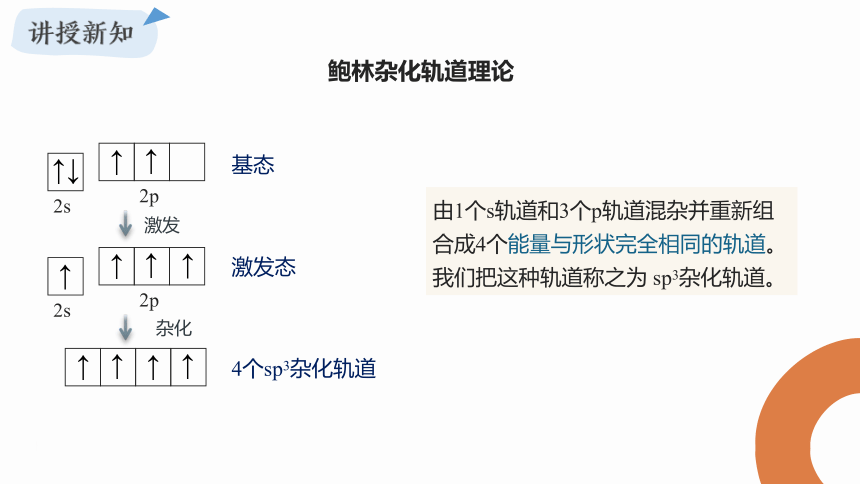
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
鲍林杂化轨道理论
原子轨道的杂化
原子内部能量相近的原子轨道,重新组合形成新的原子轨道的过程。
杂化轨道
原子轨道组合杂化后形成的一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
杂化轨道特点
杂化轨道不仅改变了原有s和p轨道的空间取向,而且使它在与其他原子的原子轨道成键时重叠的程度更大,形成的共价键更牢固。
2s
2p
↑↓
↑
↑
基态
激发
2s
2p
↑
↑
↑
↑
激发态
4个sp3杂化轨道
杂化
↑
↑
↑
↑
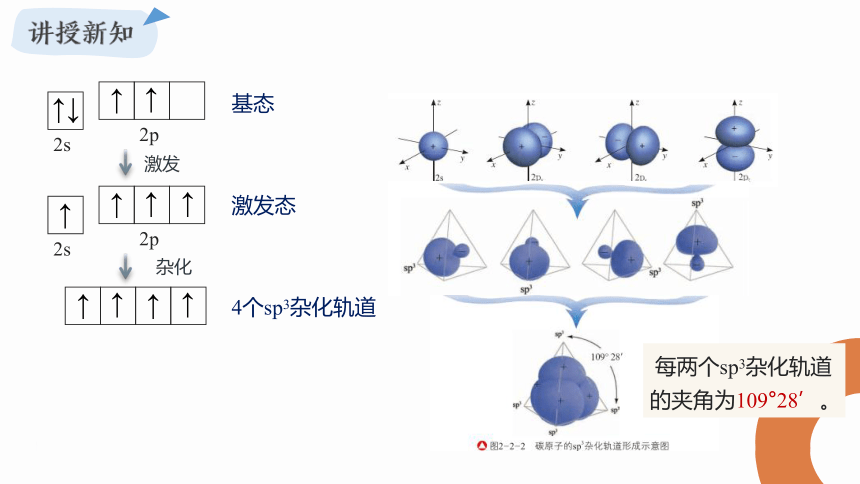
每两个sp3杂化轨道的夹角为109°28’。
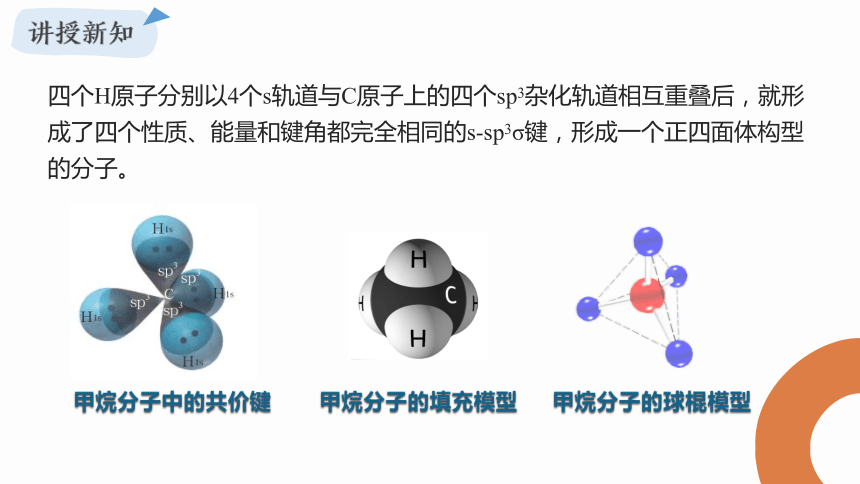
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的s-sp3σ键,形成一个正四面体构型的分子。
甲烷分子中的共价键
甲烷分子的填充模型
甲烷分子的球棍模型
杂化轨道类型
有几个原子轨道参与杂化,杂化后就生成几个杂化轨道。
sp杂化、sp2杂化、sp3杂化
sp3杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
sp3杂化轨道特点:四个sp3轨道在空间均匀分布,轨道间夹角109.5°
【思考】BF3是平面三角形构型, 分子中键角均为120o;试用杂化轨道理论加以说明。
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
杂化
↑
↑
↑
未杂化轨道
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
【思考】气态BeCl2是直线型分子构型,分子中键角为180o 。试用杂化轨道理论加以说明。
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。2个sp杂化轨道在一条直线上,轨道间夹角180°
杂化 类型 杂化轨道数目 键角 空间 构形 图示
3
sp2
4
sp3
2
sp
平面三角形
120°
109.5°
正四面体形
180°
直线形
试用杂化轨道理论分析乙烯和乙炔分子的成键情况
2s
2p
2s
2p
sp2
3个 sp2 杂化轨道
跃迁
sp2杂化
乙烯 中心原子C的sp2杂化
C原子以sp2杂化,形成3个sp2杂化轨道,分别与C原子和H原子键合。2个碳原子上未杂化的2p轨道形成1个 π键。乙烯分子中含有4个C—H σ键(sp2 s)、1个C—C σ键(sp2 sp2)、1个π键(p p)。
乙烯分子的空间结构为平面结构。
2s
2p
2s
2p
sp
2个 sp 杂化轨道
跃迁
sp杂化
乙炔 中心原子C的sp杂化
C原子以sp杂化,形成2个sp杂化轨道,分别与C原子和H原子键合。2个碳原子上未杂化的2p轨道形成2个 π键。乙炔分子中含有2个C—H σ键(sp2 s)、1个C—C σ键(sp2 sp2)、2个π键(p p)。
乙炔分子的空间结构为直线形。
联想与质疑
苯为什么不能使酸性KMnO4溶液或溴的四氯化碳溶液褪色呢?
苯分子中究竟存在怎样的化学键呢?
2s
2p
↑
↑
↑
↑
激发态
杂化
↑
↑
↑
↑
1、苯中C: sp2杂化 120°
2、六个C 的未参与杂化的p轨道形成大π键
6个碳原子和6个氢原子在同一平面内,整个分子呈平面正六边形,键角皆为120°。
1.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
2.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
A
3.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )
A.CH≡CH B.CO2
C.BeCl2 D.BF3
C
4.下列有关甲醛(HCHO)分子的说法正确的是( )
①C原子采取sp杂化 ②甲醛分子为三角锥形结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A.①② B.②③
C.③④ D.①④
C
杂化轨道理论
第2章 微粒间相互作用与物质性质
1.了解杂化轨道理论的要点和类型;
2.能运用杂化轨道理论解释简单共价分子和离子的空间结构。
写出碳原子的价电子轨道表示式,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
C的价电子轨道表示式
1、根据共价键的饱和性,C应形成几个共价键?
2、形成CH4 C原子应该有几个未成对的电子?怎样才能使C原子具有这个数目的未成对的电子?
跃迁
3、CH4中的4个C—H键完全相同,碳原子怎样才能有四个完全相同的用于成键的原子轨道?
sp3
为了解决这一矛盾,1931年由鲍林等人在价键理论的基础上提出杂化轨道理论,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
2s
2p
↑↓
↑
↑
基态
激发
2s
2p
↑
↑
↑
↑
激发态
4个sp3杂化轨道
杂化
↑
↑
↑
↑
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
鲍林杂化轨道理论
原子轨道的杂化
原子内部能量相近的原子轨道,重新组合形成新的原子轨道的过程。
杂化轨道
原子轨道组合杂化后形成的一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
杂化轨道特点
杂化轨道不仅改变了原有s和p轨道的空间取向,而且使它在与其他原子的原子轨道成键时重叠的程度更大,形成的共价键更牢固。
2s
2p
↑↓
↑
↑
基态
激发
2s
2p
↑
↑
↑
↑
激发态
4个sp3杂化轨道
杂化
↑
↑
↑
↑
每两个sp3杂化轨道的夹角为109°28’。
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的s-sp3σ键,形成一个正四面体构型的分子。
甲烷分子中的共价键
甲烷分子的填充模型
甲烷分子的球棍模型
杂化轨道类型
有几个原子轨道参与杂化,杂化后就生成几个杂化轨道。
sp杂化、sp2杂化、sp3杂化
sp3杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
sp3杂化轨道特点:四个sp3轨道在空间均匀分布,轨道间夹角109.5°
【思考】BF3是平面三角形构型, 分子中键角均为120o;试用杂化轨道理论加以说明。
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
杂化
↑
↑
↑
未杂化轨道
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
【思考】气态BeCl2是直线型分子构型,分子中键角为180o 。试用杂化轨道理论加以说明。
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。2个sp杂化轨道在一条直线上,轨道间夹角180°
杂化 类型 杂化轨道数目 键角 空间 构形 图示
3
sp2
4
sp3
2
sp
平面三角形
120°
109.5°
正四面体形
180°
直线形
试用杂化轨道理论分析乙烯和乙炔分子的成键情况
2s
2p
2s
2p
sp2
3个 sp2 杂化轨道
跃迁
sp2杂化
乙烯 中心原子C的sp2杂化
C原子以sp2杂化,形成3个sp2杂化轨道,分别与C原子和H原子键合。2个碳原子上未杂化的2p轨道形成1个 π键。乙烯分子中含有4个C—H σ键(sp2 s)、1个C—C σ键(sp2 sp2)、1个π键(p p)。
乙烯分子的空间结构为平面结构。
2s
2p
2s
2p
sp
2个 sp 杂化轨道
跃迁
sp杂化
乙炔 中心原子C的sp杂化
C原子以sp杂化,形成2个sp杂化轨道,分别与C原子和H原子键合。2个碳原子上未杂化的2p轨道形成2个 π键。乙炔分子中含有2个C—H σ键(sp2 s)、1个C—C σ键(sp2 sp2)、2个π键(p p)。
乙炔分子的空间结构为直线形。
联想与质疑
苯为什么不能使酸性KMnO4溶液或溴的四氯化碳溶液褪色呢?
苯分子中究竟存在怎样的化学键呢?
2s
2p
↑
↑
↑
↑
激发态
杂化
↑
↑
↑
↑
1、苯中C: sp2杂化 120°
2、六个C 的未参与杂化的p轨道形成大π键
6个碳原子和6个氢原子在同一平面内,整个分子呈平面正六边形,键角皆为120°。
1.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
2.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
A
3.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )
A.CH≡CH B.CO2
C.BeCl2 D.BF3
C
4.下列有关甲醛(HCHO)分子的说法正确的是( )
①C原子采取sp杂化 ②甲醛分子为三角锥形结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A.①② B.②③
C.③④ D.①④
C
