2.3 课时2 配位键 课件 (共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时2 配位键 课件 (共21张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 01:24:22 | ||
图片预览





文档简介
(共21张PPT)
配位键
第2章 微粒间相互作用与物质性质
1.知道配位键的特点、认识简单配位化合物的成键特征。
2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
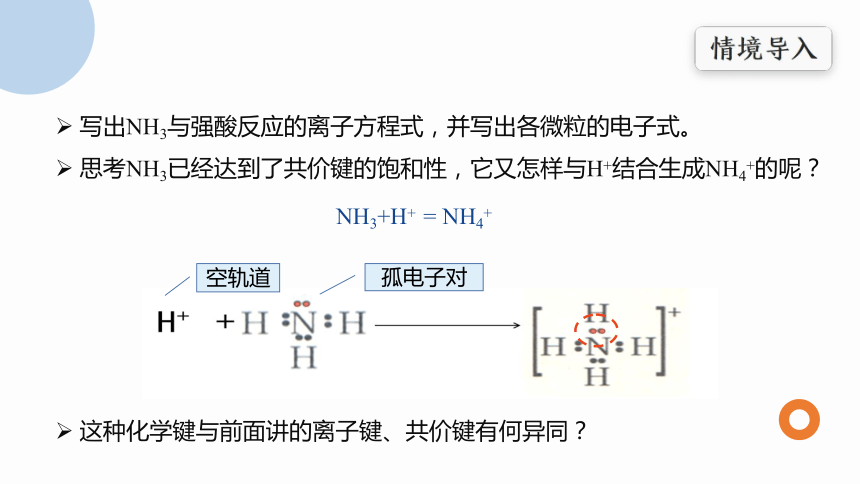
写出NH3与强酸反应的离子方程式,并写出各微粒的电子式。
思考NH3已经达到了共价键的饱和性,它又怎样与H+结合生成NH4+的呢?
NH3+H+ = NH4+
这种化学键与前面讲的离子键、共价键有何异同?
空轨道
孤电子对
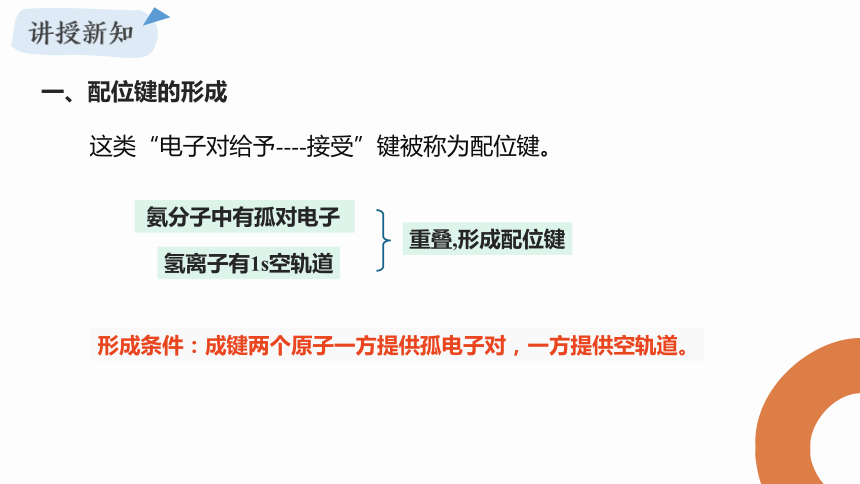
一、配位键的形成
这类“电子对给予----接受”键被称为配位键。
氨分子中有孤对电子
氢离子有1s空轨道
重叠,形成配位键
形成条件:成键两个原子一方提供孤电子对,一方提供空轨道。
表示方法
A→B(A为提供孤电子对的原子,称为配体;B为接受孤电子对的原子,称为中心原子或中心离子。)
正四面体结构
a. 配位键是一种特殊的共价键;
b. 配位键的键参数与一般共价键的键参数相同;
meiyangyang8602
meiyangyang8602
[H O H]+
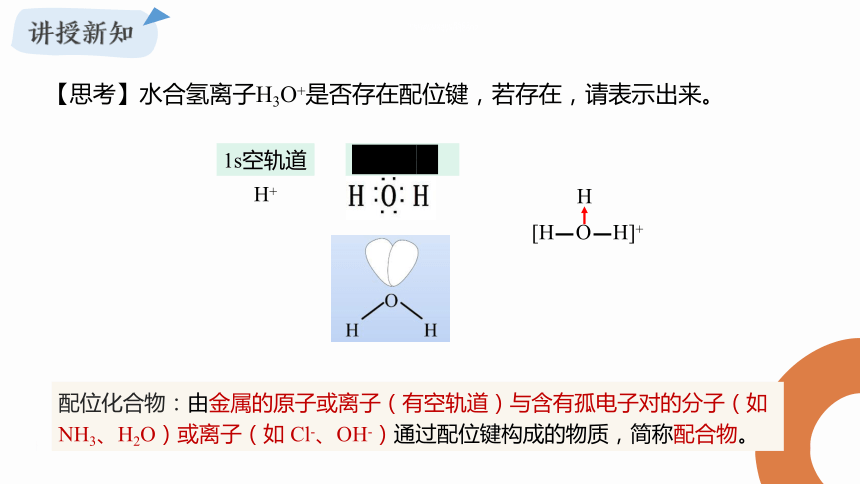
H
H+
1s空轨道
孤电子对
配位化合物:由金属的原子或离子(有空轨道)与含有孤电子对的分子(如 NH3、H2O)或离子(如 Cl-、OH-)通过配位键构成的物质,简称配合物。
【思考】水合氢离子H3O+是否存在配位键,若存在,请表示出来。
二、探究配位化合物的结构
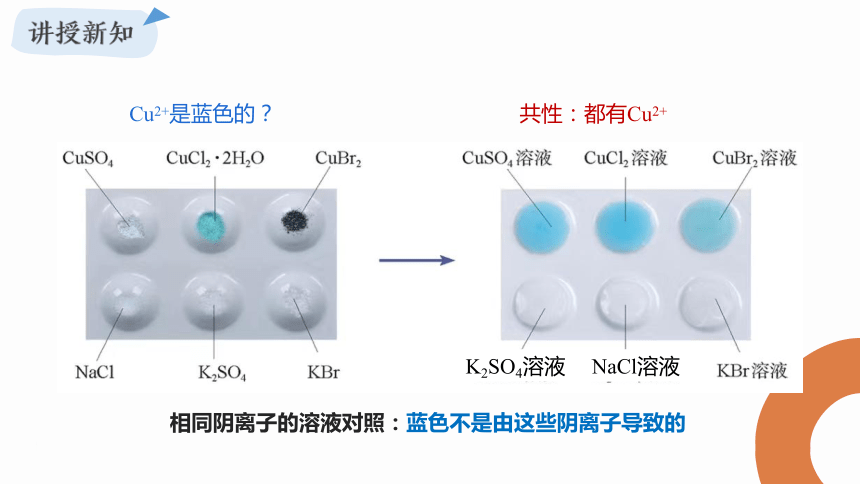
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
K2SO4溶液
NaCl溶液
Cu2+是蓝色的?
相同阴离子的溶液对照:蓝色不是由这些阴离子导致的
共性:都有Cu2+
理论解释:Cu2+与水结合显蓝色
白色
黑色
固态二价铜盐不一定显蓝色
Cu2+在水溶液中 常显蓝色
CuSO4·5H2O晶体
CuCl2·2H2O晶体
CuSO4
CuCl2
【信 息】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
(电子对接受体)空轨道 孤电子对(电子对给予体)
配位键
配合物的表示方法
[Cu(H2O)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
[Cu(H2O)4]SO4
= [Cu(H2O)4]2+ + SO42-
配
位
原
子
提供孤电子对
提供空轨道
内界(配离子)
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
NH3、H2O、Cl-、SCN-等。
Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+等
大多为过渡金属的原子或离子。
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
Ni(CO)4
无
Ni
CO
4
三、配合物的制备与应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
活动2.探究Cu2+与氨水和OH-反应的差异。
结论:
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
不同的配合物耐酸程度不同,从而影响其存在形式
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
葡萄糖
水浴加热
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
银镜
配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
叶绿素
血红素
1.以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH4+ ⑤[Cu(NH3)4]2+
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
2.关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
A.中心原子的化合价为+2价
B.配体为水分子,外界为Cl-
C.配位数是6
D.在其水溶液中加入AgNO3溶液,不产生白色沉淀
C
C
3.下列各种说法中错误的是( )
A.形成配位键的条件是一方有空轨道一方有孤对电子。
B.配位键是一种特殊的共价键。
C.配位化合物中的配体可以是分子也可以是阴离子。
D.共价键的形成条件是成键原子必须有未成对电子。
4.具有6个配体的Co3+的配合物CoClm·nNH3, 1mol配合物与AgNO3;溶液作用生成1mol AgCl沉淀,则m、n的值是( )
A. m=1、n=5 B. m=3、n=4 C. m=5、n=1 D. m=4、n=5
D
B
配位键
第2章 微粒间相互作用与物质性质
1.知道配位键的特点、认识简单配位化合物的成键特征。
2.了解配位化合物的存在与应用。通过探究配合物的制备,了解外界条件对配合物的影响。
写出NH3与强酸反应的离子方程式,并写出各微粒的电子式。
思考NH3已经达到了共价键的饱和性,它又怎样与H+结合生成NH4+的呢?
NH3+H+ = NH4+
这种化学键与前面讲的离子键、共价键有何异同?
空轨道
孤电子对
一、配位键的形成
这类“电子对给予----接受”键被称为配位键。
氨分子中有孤对电子
氢离子有1s空轨道
重叠,形成配位键
形成条件:成键两个原子一方提供孤电子对,一方提供空轨道。
表示方法
A→B(A为提供孤电子对的原子,称为配体;B为接受孤电子对的原子,称为中心原子或中心离子。)
正四面体结构
a. 配位键是一种特殊的共价键;
b. 配位键的键参数与一般共价键的键参数相同;
meiyangyang8602
meiyangyang8602
[H O H]+
H
H+
1s空轨道
孤电子对
配位化合物:由金属的原子或离子(有空轨道)与含有孤电子对的分子(如 NH3、H2O)或离子(如 Cl-、OH-)通过配位键构成的物质,简称配合物。
【思考】水合氢离子H3O+是否存在配位键,若存在,请表示出来。
二、探究配位化合物的结构
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
K2SO4溶液
NaCl溶液
Cu2+是蓝色的?
相同阴离子的溶液对照:蓝色不是由这些阴离子导致的
共性:都有Cu2+
理论解释:Cu2+与水结合显蓝色
白色
黑色
固态二价铜盐不一定显蓝色
Cu2+在水溶液中 常显蓝色
CuSO4·5H2O晶体
CuCl2·2H2O晶体
CuSO4
CuCl2
【信 息】Cu2+ + 4H2O = [Cu(H2O)4]2+(蓝色)。
(电子对接受体)空轨道 孤电子对(电子对给予体)
配位键
配合物的表示方法
[Cu(H2O)4 ] S O 4
外界(离子)
配
位
数
中
心
离
子
配
位
体
[Cu(H2O)4]SO4
= [Cu(H2O)4]2+ + SO42-
配
位
原
子
提供孤电子对
提供空轨道
内界(配离子)
形成条件
一方能给予孤电子对
另一方能接受电子对
(有空轨道)
NH3、H2O、Cl-、SCN-等。
Ag+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+等
大多为过渡金属的原子或离子。
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2
Ni(CO)4 四羰基镍
[Ag(NH3)2]+
OH-
Ag+
NH3
2
[Fe(CN)6]3-
K+
Fe3+
CN-
6
[Co(NH3)5Cl]2+
Cl-
Co3+
NH3、Cl-
6
Ni(CO)4
无
Ni
CO
4
三、配合物的制备与应用
活动1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
活动2.探究Cu2+与氨水和OH-反应的差异。
结论:
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响
活动3.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
不同的配合物耐酸程度不同,从而影响其存在形式
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
活动4.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
葡萄糖
水浴加热
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
银镜
配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
叶绿素
血红素
1.以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH4+ ⑤[Cu(NH3)4]2+
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
2.关于[Cr(H2O)4Cl2]Cl的说法正确的是( )
A.中心原子的化合价为+2价
B.配体为水分子,外界为Cl-
C.配位数是6
D.在其水溶液中加入AgNO3溶液,不产生白色沉淀
C
C
3.下列各种说法中错误的是( )
A.形成配位键的条件是一方有空轨道一方有孤对电子。
B.配位键是一种特殊的共价键。
C.配位化合物中的配体可以是分子也可以是阴离子。
D.共价键的形成条件是成键原子必须有未成对电子。
4.具有6个配体的Co3+的配合物CoClm·nNH3, 1mol配合物与AgNO3;溶液作用生成1mol AgCl沉淀,则m、n的值是( )
A. m=1、n=5 B. m=3、n=4 C. m=5、n=1 D. m=4、n=5
D
B
