2.2 课时3 分子的空间结构与分子性质 课件 (共25张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时3 分子的空间结构与分子性质 课件 (共25张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 47.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 01:25:41 | ||
图片预览







文档简介
(共25张PPT)
分子的空间结构与分子性质
第2章 微粒间相互作用与物质性质
1.知道分子的某些性质与分子的对称性有关,认识手性分子的定义,会判断不对称碳原子;
2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法,据此对分子的一些典型性质及其应用做出解释。
在日常生活中,自然景观等显示其对称性。
宏观物体具有对称性,构成它们的微观粒子如分子也具有对称性吗
观察甲烷的球棍模型,找出它的对称轴或对称面
对称轴
对称面
一、分子中的原子排布与对称性
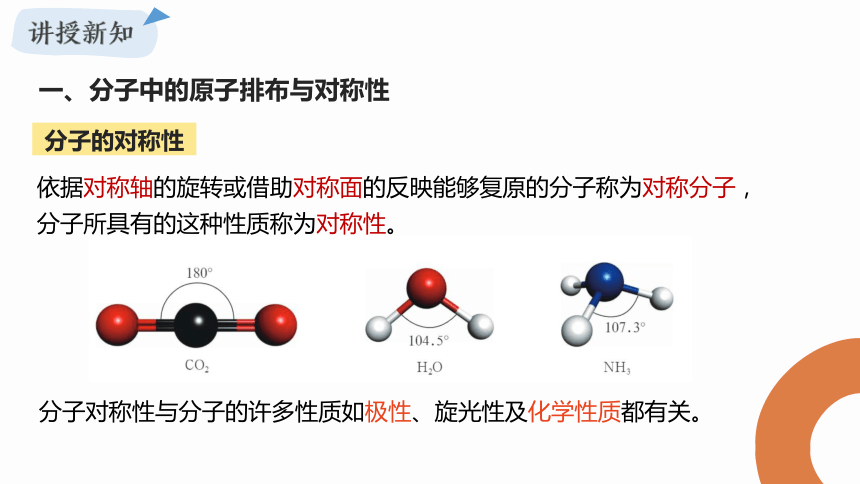
分子的对称性
依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。
分子对称性与分子的许多性质如极性、旋光性及化学性质都有关。
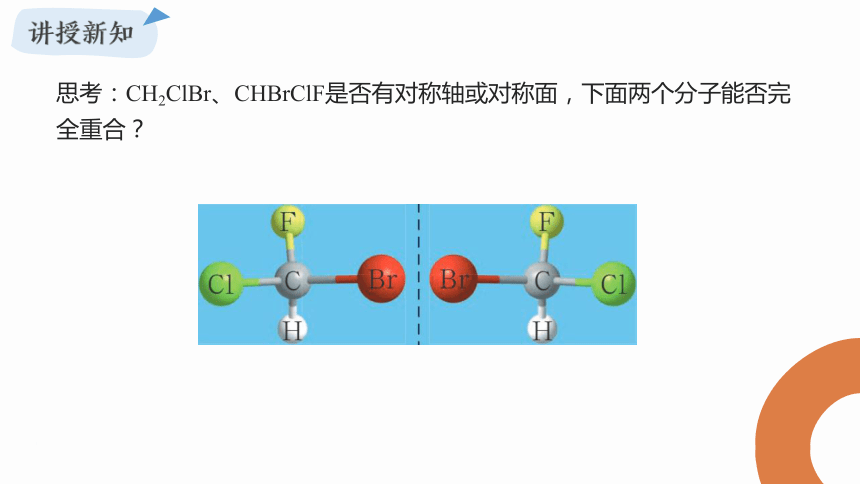
思考:CH2ClBr、CHBrClF是否有对称轴或对称面,下面两个分子能否完全重合?
一、分子中的原子排布与对称性
分子的手性
一种分子本身和它在镜中的像,就如同人的左右手,相似但不能重叠。
手性分子和它的镜像分子构成一对对映异构体。
互为对映异构体的两种分子具有相反的旋光性。
旋光性
在光通过某些化合物时,光波振动的方向会旋转一定的角度。
人们在研究手性药物时发现,手性药物的两个对映异构体表现出来的生物活性往往是不同的,甚至是截然相反的。例如,由于左旋糖较难被人体吸收,摄入后不会被代谢产生能量,对那些希望摄入低能量甜味剂的人群(如肥胖、糖尿病人等)来说,是一种理想的甜味剂。右丙氧芬和左丙氧芬是一对对映异构体,右丙氧芬具有镇痛作用,其对映异构体左丙氧芬无镇痛作用却是有效的镇咳药。再如,早期用于减轻妇女妊娠反应的药物沙利度胺,因未能将其中左旋异构体分离出去而导致许多胎儿畸形。
“镇痛”
“镇咳”
不对称碳原子
手性分子的判断:大多数的手性分子都含有不对称碳原子(手性碳原子)。
连接四个不同的原子或基团的碳原子。
手性碳原子
不对称碳原子采取sp3杂化,采取sp或sp2杂化的一定不是不对称碳原子!
不对称碳原子
有机物分子中连有四个各不相同的原子或基团的碳原子。
Br
A.OHC—CH—CH2OH B. OHC—CH—C—Cl
C.HOOC—CH — C—C—Cl
D. CH3—CH—C—CH3
H
Cl
OH
OH
Cl
H
Br
Br
CH3
CH3
下列化合物中含有2个“手性”碳原子的是( )
B
1. 使用四氯化碳、水做实验时,观察到的现象是否相同?
2. 请画图分析四氯化碳分子和水分子中的化学键是极性键还是非极性键,电荷在化学键乃至整个分子中是如何分布的。这对你解释上述实验现象有什么启示?
极性键
δ+
δ-
δ+
正电重心和负电重心不重合;
H2O中存在着带正电荷的正极和带负电荷的负极。
极性键
δ-
δ-
δ-
δ-
δ+
正电重心和负电重心重合;
CCl4分子中无正极和负极之分
二、分子中的电荷分布与极性
极性分子
正、负电荷重心不重合的分子
非极性分子
正、负电荷重心重合的分子
分子极性的判断
双原子分子的极性
非极性键→非极性分子
极性键→极性分子
双原子分子的极性与化学键的极性一致
多原子分子的极性
分子极性也可根据化学键的极性的向量和判断
大小相等,方向相反,
向量和为0
非极性分子:
B
F
F
F
平面三角形
直线形
正四面体形
多原子分子的极性
分子极性也可根据化学键的极性的向量和判断
δ+
δ+
δ+
δ-
NH3 三角锥形
δ-
δ+
HCN
δ+
H2O
键的极性向量和不为0
极性分子:
回答下列问题
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN
⑨H2O ⑩NH3 BF3 CH4 SO3 CH3Cl Ar H2O2
(1)只含非极性键的是_________;
只含极性键的是___________________,既含极性键又含非极性键的是_____。
(2)属于非极性分子的是_______________________,
属于极性分子的是_____________。
①②④⑤
③⑥⑧⑨⑩
⑦
①②④⑤⑥⑦
③⑧⑨⑩
三、分子极性对物质性质的影响
1.分子的极性对物质的熔、沸点有一定影响
相对分子质量相等的分子,分子极性大,分子间的电性作用强,分子间作用力大,熔、沸点较高。
CO分子 >N2 分子
2.相似相溶原则
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
解释:卤素单质易溶于有机溶剂,微溶于水。
I2在不同溶剂中的溶解度(g/100g溶剂) H2O CCl4
0.030(25℃) 2.91(25℃)
分子的亲水性与疏水性
分子中极性较大的基团具有亲水性,极性较小的基团具有亲脂性(或称为疏水性)。有些分子中既含有亲水性的基团,又含有疏水性的基团,由这类分子构成的物质称为表面活性剂。
1.下列中心原子采取sp2杂化且为非极性分子的是( )
A.CS2 B.H2S
C.SO2 D.SO3
D
2.下列叙述正确的是( )
A.NO、N2O、NO2、NH3都是非极性分子
B.CO2、SO3、BCl3、NF5都是非极性分子
C.H2O、NH3是极性分子,分子中的H—O比N—H的极性弱
D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
B
3.①PH3分子的空间结构为三角锥形,②BeCl2分子的空间结构为直线形,③CH4分子的空间结构为正四面体形,④CO2为直线形分子,⑤BF3分子的空间结构为平面三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
A
分子的空间结构与分子性质
第2章 微粒间相互作用与物质性质
1.知道分子的某些性质与分子的对称性有关,认识手性分子的定义,会判断不对称碳原子;
2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断简单分子极性的方法,据此对分子的一些典型性质及其应用做出解释。
在日常生活中,自然景观等显示其对称性。
宏观物体具有对称性,构成它们的微观粒子如分子也具有对称性吗
观察甲烷的球棍模型,找出它的对称轴或对称面
对称轴
对称面
一、分子中的原子排布与对称性
分子的对称性
依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。
分子对称性与分子的许多性质如极性、旋光性及化学性质都有关。
思考:CH2ClBr、CHBrClF是否有对称轴或对称面,下面两个分子能否完全重合?
一、分子中的原子排布与对称性
分子的手性
一种分子本身和它在镜中的像,就如同人的左右手,相似但不能重叠。
手性分子和它的镜像分子构成一对对映异构体。
互为对映异构体的两种分子具有相反的旋光性。
旋光性
在光通过某些化合物时,光波振动的方向会旋转一定的角度。
人们在研究手性药物时发现,手性药物的两个对映异构体表现出来的生物活性往往是不同的,甚至是截然相反的。例如,由于左旋糖较难被人体吸收,摄入后不会被代谢产生能量,对那些希望摄入低能量甜味剂的人群(如肥胖、糖尿病人等)来说,是一种理想的甜味剂。右丙氧芬和左丙氧芬是一对对映异构体,右丙氧芬具有镇痛作用,其对映异构体左丙氧芬无镇痛作用却是有效的镇咳药。再如,早期用于减轻妇女妊娠反应的药物沙利度胺,因未能将其中左旋异构体分离出去而导致许多胎儿畸形。
“镇痛”
“镇咳”
不对称碳原子
手性分子的判断:大多数的手性分子都含有不对称碳原子(手性碳原子)。
连接四个不同的原子或基团的碳原子。
手性碳原子
不对称碳原子采取sp3杂化,采取sp或sp2杂化的一定不是不对称碳原子!
不对称碳原子
有机物分子中连有四个各不相同的原子或基团的碳原子。
Br
A.OHC—CH—CH2OH B. OHC—CH—C—Cl
C.HOOC—CH — C—C—Cl
D. CH3—CH—C—CH3
H
Cl
OH
OH
Cl
H
Br
Br
CH3
CH3
下列化合物中含有2个“手性”碳原子的是( )
B
1. 使用四氯化碳、水做实验时,观察到的现象是否相同?
2. 请画图分析四氯化碳分子和水分子中的化学键是极性键还是非极性键,电荷在化学键乃至整个分子中是如何分布的。这对你解释上述实验现象有什么启示?
极性键
δ+
δ-
δ+
正电重心和负电重心不重合;
H2O中存在着带正电荷的正极和带负电荷的负极。
极性键
δ-
δ-
δ-
δ-
δ+
正电重心和负电重心重合;
CCl4分子中无正极和负极之分
二、分子中的电荷分布与极性
极性分子
正、负电荷重心不重合的分子
非极性分子
正、负电荷重心重合的分子
分子极性的判断
双原子分子的极性
非极性键→非极性分子
极性键→极性分子
双原子分子的极性与化学键的极性一致
多原子分子的极性
分子极性也可根据化学键的极性的向量和判断
大小相等,方向相反,
向量和为0
非极性分子:
B
F
F
F
平面三角形
直线形
正四面体形
多原子分子的极性
分子极性也可根据化学键的极性的向量和判断
δ+
δ+
δ+
δ-
NH3 三角锥形
δ-
δ+
HCN
δ+
H2O
键的极性向量和不为0
极性分子:
回答下列问题
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN
⑨H2O ⑩NH3 BF3 CH4 SO3 CH3Cl Ar H2O2
(1)只含非极性键的是_________;
只含极性键的是___________________,既含极性键又含非极性键的是_____。
(2)属于非极性分子的是_______________________,
属于极性分子的是_____________。
①②④⑤
③⑥⑧⑨⑩
⑦
①②④⑤⑥⑦
③⑧⑨⑩
三、分子极性对物质性质的影响
1.分子的极性对物质的熔、沸点有一定影响
相对分子质量相等的分子,分子极性大,分子间的电性作用强,分子间作用力大,熔、沸点较高。
CO分子 >N2 分子
2.相似相溶原则
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
解释:卤素单质易溶于有机溶剂,微溶于水。
I2在不同溶剂中的溶解度(g/100g溶剂) H2O CCl4
0.030(25℃) 2.91(25℃)
分子的亲水性与疏水性
分子中极性较大的基团具有亲水性,极性较小的基团具有亲脂性(或称为疏水性)。有些分子中既含有亲水性的基团,又含有疏水性的基团,由这类分子构成的物质称为表面活性剂。
1.下列中心原子采取sp2杂化且为非极性分子的是( )
A.CS2 B.H2S
C.SO2 D.SO3
D
2.下列叙述正确的是( )
A.NO、N2O、NO2、NH3都是非极性分子
B.CO2、SO3、BCl3、NF5都是非极性分子
C.H2O、NH3是极性分子,分子中的H—O比N—H的极性弱
D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
B
3.①PH3分子的空间结构为三角锥形,②BeCl2分子的空间结构为直线形,③CH4分子的空间结构为正四面体形,④CO2为直线形分子,⑤BF3分子的空间结构为平面三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
A
