2.3 课时1 离子键、金属键 课件 (共19张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时1 离子键、金属键 课件 (共19张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 01:27:32 | ||
图片预览




文档简介
(共19张PPT)
离子键、金属键
第2章 微粒间相互作用与物质性质
1.掌握离子键的形成条件,并理解离子键的实质和特征;
2.知道金属键的含义,能用金属键理论解释金属的某些性质。
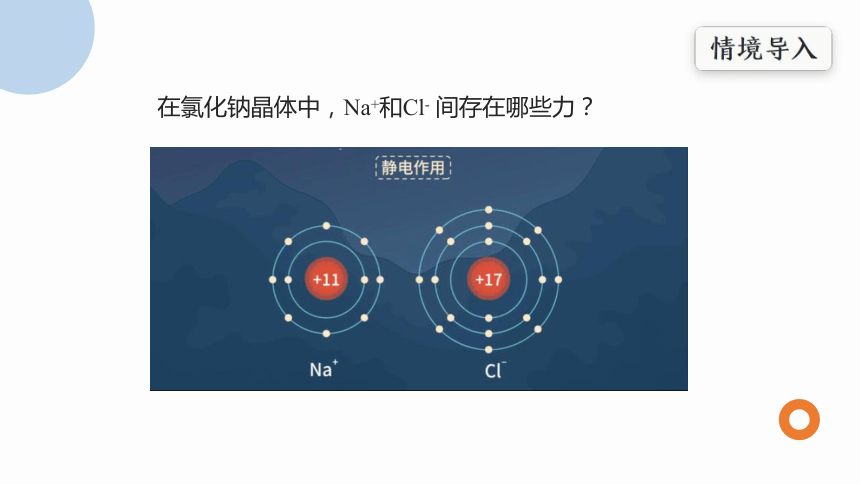
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
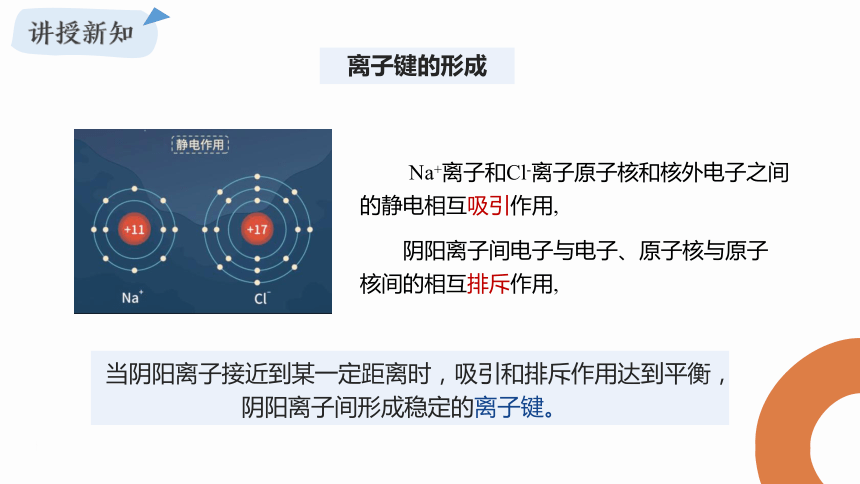
离子键的形成
Na+离子和Cl-离子原子核和核外电子之间的静电相互吸引作用,
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用,
当阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
一、离子键
1. 概念:阴、阳离子通过静电作用而形成的化学键叫做离子键。
2. 成键粒子:阴、阳离子。
3. 成键本质:阴、阳离子之间的相互作用(静电吸引和静电排斥)。
4. 成键原因:
①原子相互得失电子形成稳定的阴阳离子;
②离子间吸引与排斥处于平衡状态;
③体系的总能量降低。
【思考】判断下列哪些原子之间可以形成离子键,并说明你的判断依据。
Cs Mg K H F Cl S O
原子得失电子的能力可以用电负性表示,以上元素的电负性数据如下:
Cs 0.7 Mg 1.2 K 0.8 H 2.0 F 4.0 Cl 3.0 S 2.5 O 3.5
根据以上数据验证你的结论是否符合?
一般而言,电负性较大的非金属元素的原子容易获得电子形成阴离子,电负性较小的金属元素的原子容易失去价电子形成阳离子。
当成键原子所属元素的电负性的差值大于1.7时,原子间可以形成离子键
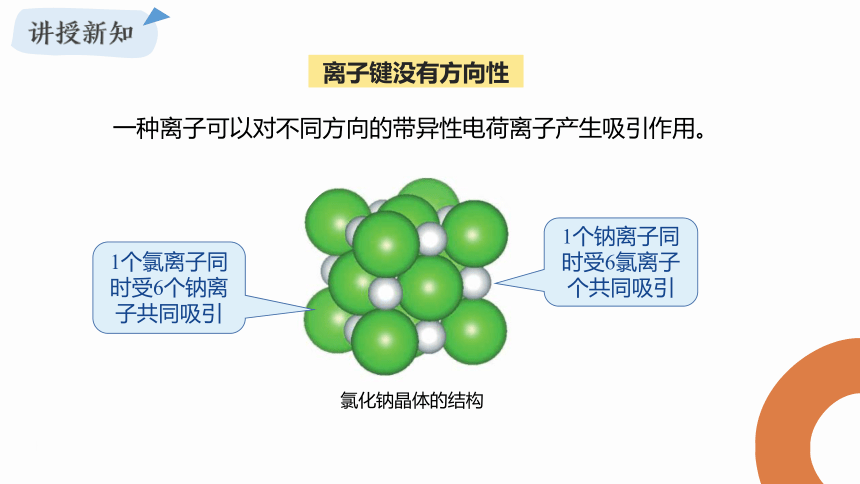
一种离子可以对不同方向的带异性电荷离子产生吸引作用。
氯化钠晶体的结构
1个氯离子同时受6个钠离子共同吸引
1个钠离子同时受6氯离子个共同吸引
离子键没有方向性
离子键没有饱和性
在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的相对大小。只要空间条件允许,阳离子将吸引尽可能多的阴离子排列在其周围,阴离子也将吸引尽可能多的阳离子排列在其周围。
为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,
难溶性随之增加 这些变化的本质原因是什么
离子极化
离子极化
从表面上看,卤化银是由带正电荷的Ag+和带负电荷的X-通过离子键结合形成的,应当是离子化合物,但实际上并非如此
这是因为,基本上呈球形对称的离子本身所带有的电荷会形成一个电场
在相互的电场作用下,阴、阳离子中的电子分布会发生相对偏移。这种在电场的作用下产生的离子中电子分布发生偏移的现象称为离子极化。
离子极化可能导致阴、阳离子的外层轨道发生重叠,从而使得许多离子键不同程度地显示共价性,继而导致键长缩短、键能增加,甚至出现键型变异。
为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,
难溶性随之增加 这些变化的本质原因是什么
对于卤素阴离子而言,从F-到I-半径增大,在具有较强极化能力的Ag+的极化下,AgX的键型由离子键(AgF)向共价键过渡,AgI已成为以共价键为主的结构,因而从AgF到AgI,卤化物的性质发生了一定的变化。
铁块
镁条
铜片
思考:除了共价键和离子键,原子之间还有其他的结合方式吗?
金属通性:
金属光泽、导电性、导热性、延展性 等
二、金属键
金属元素的电负性和电离能较小,金属原子的价电子容易脱离原子核的束缚。在固态金属中,金属原子失去的电子在所形成的金属阳离子之间“自由”运动,成为“自由电子”。
金属元素的原子构成的金属单质内也存在一种强烈的相互作用。
实验测知,1 mol W 转变成气态
原子,需要吸收824.0 kJ的能量。
钨的熔点高达3422℃
二、金属键
这种“自由电子”和金属阳离子之间的强的相互作用,叫作金属键
电子在整个三维空间运动,属于整块固态金属,被所有原子所共用,从而把所有的原子维系在一起。
二、金属键
1.定义:
金属阳离子和自由电子之间的强烈的相互作用。
2.组成:
金属阳离子和自由电子。
3.实质:
电性作用——特殊形式的共价键
4.特征:
(1)无方向性和饱和性
(2)电子在整个三维空间运动,属于整块固态金属
金属键可以看成是由许多个原子共用许多个电子形成的,所以有人将金属键视为一种特殊形式的共价键。
思考:金属有哪些物理通性?如何运用金属键进行解释?
(1)金属不透明,具有金属光泽
当可见光照射到金属固体表面上时,固态金属中的“自由电子”能够吸收所有频率的光并迅速释放,使得金属不透明并具有金属光泽。
(2)金属具有良好的导电性
金属内部自由电子的运动不具有方向性,在外加电场的作用下,金属晶体中的“自由电子”发生定向移动而形成电流。
当金属中存在温度差时,不停运动着的“自由电子”通过自身与金属阳离子之间的碰撞,将能量由高温处传向低温处,使金属表现出导热性。
(3)金属具有良好的导热性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属具有良好的延展性,在受到外力时不易断裂。
(4)金属具有良好的延展性
1. 下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
4.具有下列选项中电负性数值的两种元素的原子,最容易形成离子键的是( ) A.4.0和1.0 B.3.5和1.0 C.1.8和2.5 D.4.0和0.8
D
5.下列有关金属键和金属性质的说法中,错误的是( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的相互作用
C. 自由电子吸收可见光后又迅速释放,使金属具有不透明性和金属光泽
D. 金属的导热性和导电性都是通过自由电子的定向运动实现的
D
离子键、金属键
第2章 微粒间相互作用与物质性质
1.掌握离子键的形成条件,并理解离子键的实质和特征;
2.知道金属键的含义,能用金属键理论解释金属的某些性质。
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
离子键的形成
Na+离子和Cl-离子原子核和核外电子之间的静电相互吸引作用,
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用,
当阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
一、离子键
1. 概念:阴、阳离子通过静电作用而形成的化学键叫做离子键。
2. 成键粒子:阴、阳离子。
3. 成键本质:阴、阳离子之间的相互作用(静电吸引和静电排斥)。
4. 成键原因:
①原子相互得失电子形成稳定的阴阳离子;
②离子间吸引与排斥处于平衡状态;
③体系的总能量降低。
【思考】判断下列哪些原子之间可以形成离子键,并说明你的判断依据。
Cs Mg K H F Cl S O
原子得失电子的能力可以用电负性表示,以上元素的电负性数据如下:
Cs 0.7 Mg 1.2 K 0.8 H 2.0 F 4.0 Cl 3.0 S 2.5 O 3.5
根据以上数据验证你的结论是否符合?
一般而言,电负性较大的非金属元素的原子容易获得电子形成阴离子,电负性较小的金属元素的原子容易失去价电子形成阳离子。
当成键原子所属元素的电负性的差值大于1.7时,原子间可以形成离子键
一种离子可以对不同方向的带异性电荷离子产生吸引作用。
氯化钠晶体的结构
1个氯离子同时受6个钠离子共同吸引
1个钠离子同时受6氯离子个共同吸引
离子键没有方向性
离子键没有饱和性
在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的相对大小。只要空间条件允许,阳离子将吸引尽可能多的阴离子排列在其周围,阴离子也将吸引尽可能多的阳离子排列在其周围。
为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,
难溶性随之增加 这些变化的本质原因是什么
离子极化
离子极化
从表面上看,卤化银是由带正电荷的Ag+和带负电荷的X-通过离子键结合形成的,应当是离子化合物,但实际上并非如此
这是因为,基本上呈球形对称的离子本身所带有的电荷会形成一个电场
在相互的电场作用下,阴、阳离子中的电子分布会发生相对偏移。这种在电场的作用下产生的离子中电子分布发生偏移的现象称为离子极化。
离子极化可能导致阴、阳离子的外层轨道发生重叠,从而使得许多离子键不同程度地显示共价性,继而导致键长缩短、键能增加,甚至出现键型变异。
为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,
难溶性随之增加 这些变化的本质原因是什么
对于卤素阴离子而言,从F-到I-半径增大,在具有较强极化能力的Ag+的极化下,AgX的键型由离子键(AgF)向共价键过渡,AgI已成为以共价键为主的结构,因而从AgF到AgI,卤化物的性质发生了一定的变化。
铁块
镁条
铜片
思考:除了共价键和离子键,原子之间还有其他的结合方式吗?
金属通性:
金属光泽、导电性、导热性、延展性 等
二、金属键
金属元素的电负性和电离能较小,金属原子的价电子容易脱离原子核的束缚。在固态金属中,金属原子失去的电子在所形成的金属阳离子之间“自由”运动,成为“自由电子”。
金属元素的原子构成的金属单质内也存在一种强烈的相互作用。
实验测知,1 mol W 转变成气态
原子,需要吸收824.0 kJ的能量。
钨的熔点高达3422℃
二、金属键
这种“自由电子”和金属阳离子之间的强的相互作用,叫作金属键
电子在整个三维空间运动,属于整块固态金属,被所有原子所共用,从而把所有的原子维系在一起。
二、金属键
1.定义:
金属阳离子和自由电子之间的强烈的相互作用。
2.组成:
金属阳离子和自由电子。
3.实质:
电性作用——特殊形式的共价键
4.特征:
(1)无方向性和饱和性
(2)电子在整个三维空间运动,属于整块固态金属
金属键可以看成是由许多个原子共用许多个电子形成的,所以有人将金属键视为一种特殊形式的共价键。
思考:金属有哪些物理通性?如何运用金属键进行解释?
(1)金属不透明,具有金属光泽
当可见光照射到金属固体表面上时,固态金属中的“自由电子”能够吸收所有频率的光并迅速释放,使得金属不透明并具有金属光泽。
(2)金属具有良好的导电性
金属内部自由电子的运动不具有方向性,在外加电场的作用下,金属晶体中的“自由电子”发生定向移动而形成电流。
当金属中存在温度差时,不停运动着的“自由电子”通过自身与金属阳离子之间的碰撞,将能量由高温处传向低温处,使金属表现出导热性。
(3)金属具有良好的导热性
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,所以金属具有良好的延展性,在受到外力时不易断裂。
(4)金属具有良好的延展性
1. 下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
4.具有下列选项中电负性数值的两种元素的原子,最容易形成离子键的是( ) A.4.0和1.0 B.3.5和1.0 C.1.8和2.5 D.4.0和0.8
D
5.下列有关金属键和金属性质的说法中,错误的是( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间存在的强烈的相互作用
C. 自由电子吸收可见光后又迅速释放,使金属具有不透明性和金属光泽
D. 金属的导热性和导电性都是通过自由电子的定向运动实现的
D
