2.4 分子间作用力 课件 (共23张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.4 分子间作用力 课件 (共23张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 40.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:11:59 | ||
图片预览





文档简介
(共23张PPT)
分子间作用力
第2章 微粒间相互作用与物质性质
1、通过对水的三态变化和通电分解后的实质的分析,认识到分子间作用力的存在。
2、通过不同物质分子间的比较,初步建立对范德华力的理解。
3、通过比较水和硫化氢沸点的大小,引出氢键,探究氢键的形成条件。
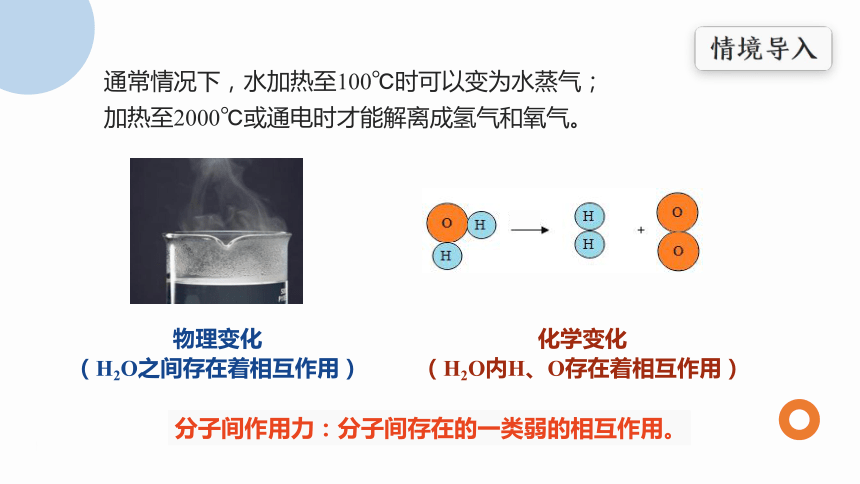
通常情况下,水加热至100℃时可以变为水蒸气;
加热至2000℃或通电时才能解离成氢气和氧气。
物理变化
(H2O之间存在着相互作用)
化学变化
(H2O内H、O存在着相互作用)
分子间作用力:分子间存在的一类弱的相互作用。
一、范德华力
范德华力概念的提出
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们便将分子间作用力称为范德华力。
一、范德华力
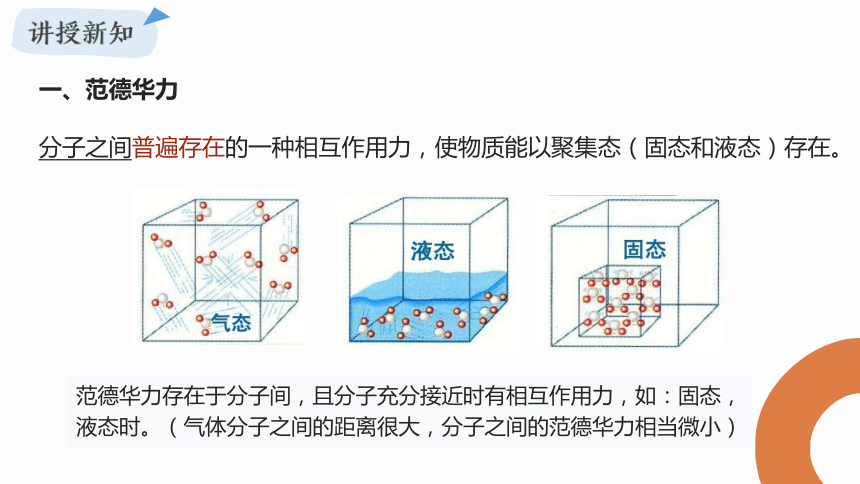
分子之间普遍存在的一种相互作用力,使物质能以聚集态(固态和液态)存在。
范德华力存在于分子间,且分子充分接近时有相互作用力,如:固态,液态时。(气体分子之间的距离很大,分子之间的范德华力相当微小)
范德华力的成因
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或使吸引力增强,这种吸引力称为诱导力。
范德华力的成因
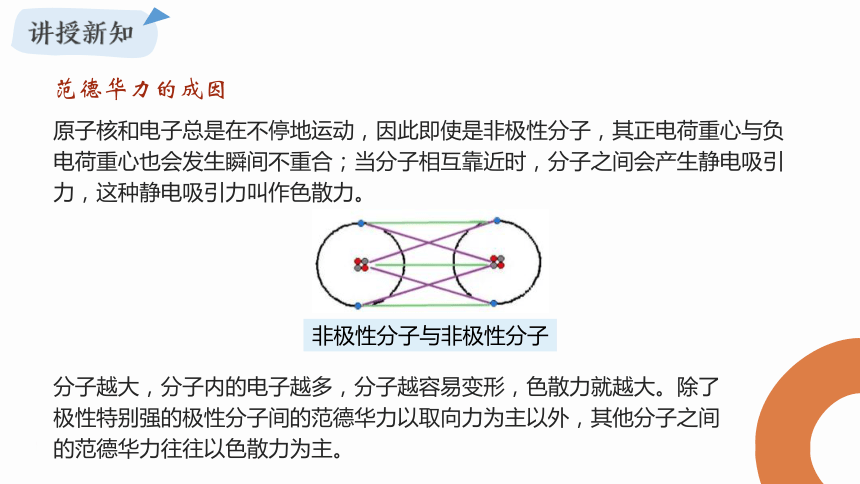
原子核和电子总是在不停地运动,因此即使是非极性分子,其正电荷重心与负电荷重心也会发生瞬间不重合;当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。
非极性分子与非极性分子
分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子之间的范德华力往往以色散力为主。
范德华力的成因
分子的极性与变形性,是产生范德华力的原因
范德华力的实质
电性作用
特征:没有方向性和饱和性。只要分子周围空间允许,当气体分子凝聚时,它总是尽可能多地吸引其他分子
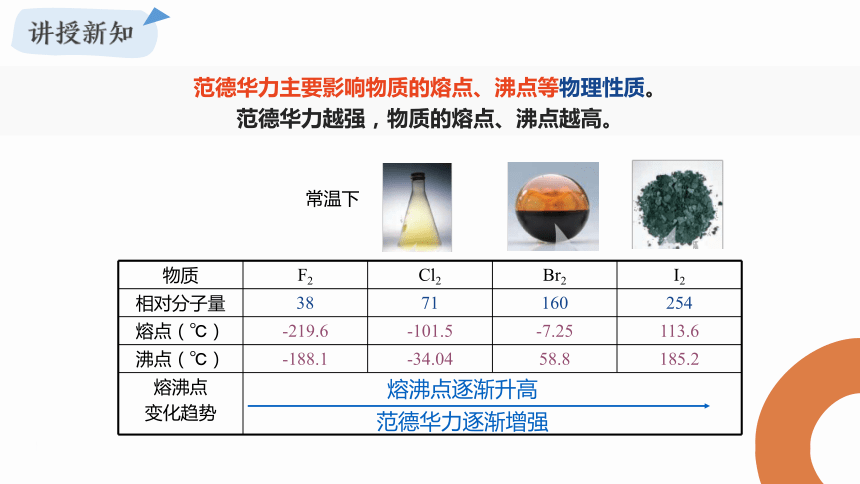
范德华力主要影响物质的熔点、沸点等物理性质。
范德华力越强,物质的熔点、沸点越高。
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101.5 -7.25 113.6
沸点(℃) -188.1 -34.04 58.8 185.2
熔沸点 变化趋势 熔沸点逐渐升高
范德华力逐渐增强
常温下
观察卤素单质的熔沸点变化,思考范德华力与相对分子质量的关系
分子组成和结构相似的物质,相对分子质量越大,范德华力越强,物质熔、沸点越高。
CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
分子的极性越大,范德华力越大
CO2为非极性分子
CH3CHO为极性分子
范德华力的影响因素
1.分子构型
2.相对分子质量
比较H2O、H2S、H2Se、H2Te中范德华力的强弱、熔沸点的高低
范德华力:H2O<H2S<H2Se<H2Te
按照一般规律,水的沸点应该低于硫化氢的沸点,但事实却相反。这是为什么?
二、氢键
H2O
O-H中共用电子对强烈偏向O
H几乎成为“裸露”的质子显正电性
能与另一个水分子中显负电性的O的孤电子对产生静电作用
二、氢键
氢键是由已经与电负性很大的原子X形成共价键的氢原子,与另一个电负性大的原子Y之间的静电作用。
X —— H · · · Y
化学键
氢键
强烈、距离近
微弱、距离远
X、Y两原子可以相同,也可以不同
氢键介于范德华力和化学键之间,是一种较弱的作用力。
一个水分子最多能形成几个氢键?
氢键具有方向性和饱和性
【思考】物质由液态变为固态时,通常体积变小,但水结冰后体积却变大,为什么?
在固态水(冰)中,水分子大范围地以氢键互相联结。形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
二、氢键
O— H … O
N— H … N
F— H … F
氢键对物质性质的影响
1.氢键对熔沸点的影响
(1)当形成分子间氢键时,物质的熔、沸点将升高。
氢键对物质性质的影响
1.氢键对熔沸点的影响
(2)当形成分子内氢键使物质熔沸点降低。
氢键对物质性质的影响
2.氢键对溶解度的影响
b.由于溶质分子NH3与溶剂分子H2O间可以形成氢键,使溶质的溶解度增大(主)
a.NH3和H2O都是极性分子,相似相溶
c.NH3与H2O发生反应
如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
思考:为什么乙醇与水任意比互溶?
1. 下列说法中正确的是( )
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力
B
2.下列物质性质的变化规律与分子间作用力无关的是( )
A.CI4、CBr4、CCl4、CF4的熔、沸点逐渐降低
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.F2、Cl2、Br2、I2的熔、沸点逐渐升高
D.CH3—CH3、CH3—CH2—CH3、(CH3)2CHCH3、CH3CH2CH2CH3的沸点
逐渐升高
B
3.有关物质结构的下列说法中正确的是( )
A.形成氢键A—H…B—的三个原子总在一条直线上
B.含极性键的共价化合物一定是电解质
C.氯化钠固体中的离子键在溶于水时被破坏
D.HF的分子间作用力大于HCl,故HF比HCI更稳定
C
分子间作用力
第2章 微粒间相互作用与物质性质
1、通过对水的三态变化和通电分解后的实质的分析,认识到分子间作用力的存在。
2、通过不同物质分子间的比较,初步建立对范德华力的理解。
3、通过比较水和硫化氢沸点的大小,引出氢键,探究氢键的形成条件。
通常情况下,水加热至100℃时可以变为水蒸气;
加热至2000℃或通电时才能解离成氢气和氧气。
物理变化
(H2O之间存在着相互作用)
化学变化
(H2O内H、O存在着相互作用)
分子间作用力:分子间存在的一类弱的相互作用。
一、范德华力
范德华力概念的提出
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们便将分子间作用力称为范德华力。
一、范德华力
分子之间普遍存在的一种相互作用力,使物质能以聚集态(固态和液态)存在。
范德华力存在于分子间,且分子充分接近时有相互作用力,如:固态,液态时。(气体分子之间的距离很大,分子之间的范德华力相当微小)
范德华力的成因
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或使吸引力增强,这种吸引力称为诱导力。
范德华力的成因
原子核和电子总是在不停地运动,因此即使是非极性分子,其正电荷重心与负电荷重心也会发生瞬间不重合;当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。
非极性分子与非极性分子
分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子之间的范德华力往往以色散力为主。
范德华力的成因
分子的极性与变形性,是产生范德华力的原因
范德华力的实质
电性作用
特征:没有方向性和饱和性。只要分子周围空间允许,当气体分子凝聚时,它总是尽可能多地吸引其他分子
范德华力主要影响物质的熔点、沸点等物理性质。
范德华力越强,物质的熔点、沸点越高。
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101.5 -7.25 113.6
沸点(℃) -188.1 -34.04 58.8 185.2
熔沸点 变化趋势 熔沸点逐渐升高
范德华力逐渐增强
常温下
观察卤素单质的熔沸点变化,思考范德华力与相对分子质量的关系
分子组成和结构相似的物质,相对分子质量越大,范德华力越强,物质熔、沸点越高。
CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
分子的极性越大,范德华力越大
CO2为非极性分子
CH3CHO为极性分子
范德华力的影响因素
1.分子构型
2.相对分子质量
比较H2O、H2S、H2Se、H2Te中范德华力的强弱、熔沸点的高低
范德华力:H2O<H2S<H2Se<H2Te
按照一般规律,水的沸点应该低于硫化氢的沸点,但事实却相反。这是为什么?
二、氢键
H2O
O-H中共用电子对强烈偏向O
H几乎成为“裸露”的质子显正电性
能与另一个水分子中显负电性的O的孤电子对产生静电作用
二、氢键
氢键是由已经与电负性很大的原子X形成共价键的氢原子,与另一个电负性大的原子Y之间的静电作用。
X —— H · · · Y
化学键
氢键
强烈、距离近
微弱、距离远
X、Y两原子可以相同,也可以不同
氢键介于范德华力和化学键之间,是一种较弱的作用力。
一个水分子最多能形成几个氢键?
氢键具有方向性和饱和性
【思考】物质由液态变为固态时,通常体积变小,但水结冰后体积却变大,为什么?
在固态水(冰)中,水分子大范围地以氢键互相联结。形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
二、氢键
O— H … O
N— H … N
F— H … F
氢键对物质性质的影响
1.氢键对熔沸点的影响
(1)当形成分子间氢键时,物质的熔、沸点将升高。
氢键对物质性质的影响
1.氢键对熔沸点的影响
(2)当形成分子内氢键使物质熔沸点降低。
氢键对物质性质的影响
2.氢键对溶解度的影响
b.由于溶质分子NH3与溶剂分子H2O间可以形成氢键,使溶质的溶解度增大(主)
a.NH3和H2O都是极性分子,相似相溶
c.NH3与H2O发生反应
如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
思考:为什么乙醇与水任意比互溶?
1. 下列说法中正确的是( )
A.分子间作用力越大,分子越稳定
B.分子间作用力越大,物质的熔、沸点越高
C.相对分子质量越大,其分子间作用力越大
D.分子间只存在范德华力
B
2.下列物质性质的变化规律与分子间作用力无关的是( )
A.CI4、CBr4、CCl4、CF4的熔、沸点逐渐降低
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.F2、Cl2、Br2、I2的熔、沸点逐渐升高
D.CH3—CH3、CH3—CH2—CH3、(CH3)2CHCH3、CH3CH2CH2CH3的沸点
逐渐升高
B
3.有关物质结构的下列说法中正确的是( )
A.形成氢键A—H…B—的三个原子总在一条直线上
B.含极性键的共价化合物一定是电解质
C.氯化钠固体中的离子键在溶于水时被破坏
D.HF的分子间作用力大于HCl,故HF比HCI更稳定
C
