微项目 补铁剂中铁元素的检验 课件 (共23张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 微项目 补铁剂中铁元素的检验 课件 (共23张PPT)2024-2025学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 62.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:15:50 | ||
图片预览







文档简介
(共23张PPT)
补铁剂中铁元素的检验
第2章 微粒间相互作用与物质性质
了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
补铁药物种类繁多,常见的有效成分有硫酸亚铁、琥珀酸亚铁、富马酸亚铁、葡萄糖酸亚铁等,其中多种为亚铁离子的配合物。在补铁药物中也有铁离子的配合物,如蛋白琥珀酸铁等。
药片里是否含有Fe2+?里面的Fe2+是否被氧化成了Fe3+?
请设计实验方案,检验补铁药片中铁元素的价态
一、补铁药片中铁元素价态的检验
药片里是否含有Fe2+?里面的Fe2+是否被氧化成了Fe3+?
由于 Fe2+ 具有还原性,药品在保存过程中可能生成 Fe3+。
Fe2+ 与 Fe3+ 在水溶液中均有颜色,但是在浓度较低时肉眼几乎观察不到;不过,它们形成配合物后往往会显示特征颜色,且颜色较深。
实验一:
根据所给试剂和仪器设计实验方案,检验该药片在保存过程中铁元素是否被部分氧化成三价?
试剂:琥珀酸亚铁片、稀硫酸、KSCN溶液、蒸馏水
仪器:试管、研钵、胶头滴管、玻璃棒、小烧杯
实验任务 实验方案 实验现象 实验结论
任务1
对于同一批药片,用 KSCN 溶液检验 Fe3+,有的小组观察到溶液变红,说明药片被氧化,但也有的小组没有观察到该现象。
讨论:为什么溶解方式不同,带来的实验现象不同?
对比实验过程发现:用酸溶解药片配制成悬浊液的小组,用 KSCN 溶液检验Fe3+ 观察到溶液变红,而用蒸馏水溶解药片的小组没有观察到溶液变红。
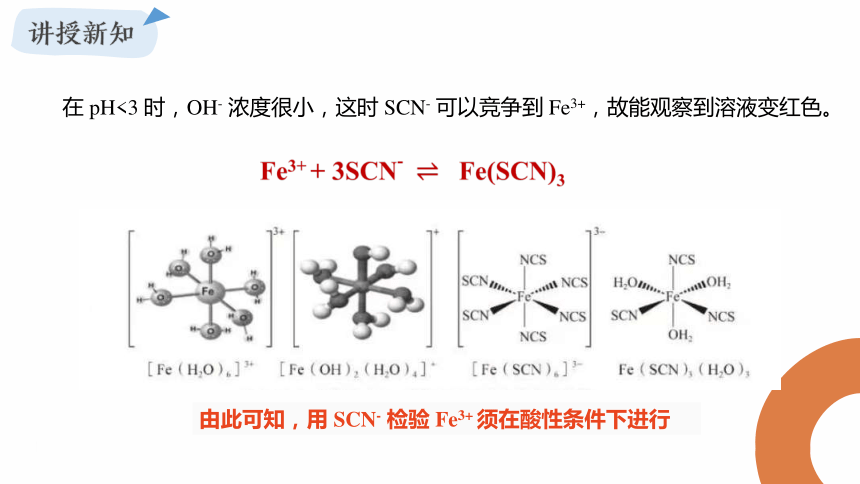
Fe3+ 的水合离子[Fe(H2O)6]3+ 呈淡紫色(稀溶液时为无色),但因 Fe3+ 极易水解,故未充分酸化的水溶液会由于有[Fe(OH)]2+ 存在而显黄色。随着 pH 升高,Fe3+ 水解程度增大,可生成 Fe(OH)3 胶体或沉淀。用 KSCN 溶液检验 Fe3+ 时,SCN- 会与OH- 竞争结合 Fe3+。由于 OH- 更易与 Fe3+ 结合,在 pH>3 时,SCN- 无法竞争到Fe3+;
在 pH<3 时,OH- 浓度很小,这时 SCN- 可以竞争到 Fe3+,故能观察到溶液变红色。
由此可知,用 SCN- 检验 Fe3+ 须在酸性条件下进行
药片中是否存在着正二价的铁元素?
2.结合说明书思考以上方法检验补铁剂中的Fe2+是否可行?
1.思考哪些方法可以检验Fe2+?
①观察颜 ②NaOH沉淀法 ③KSCN+氯水 ④酸性高锰酸钾
考虑到补铁药片中可能含有其他还原剂,因此无法说明溶液中含有 Fe2+
有什么方法,能像检验Fe3+一样,直接检验Fe2+?
进一步设计出控制变量的实验,检验猜想的合理性,确认影响因素。
在遇到陌生现象希望寻找其发生的原因时,可以按下列思路进行:
列出体系中存在的微粒
逐一判断每一种微粒是否有可能是影响因素
筛选出潜在的影响因素
作出解释、猜想
寻找检验Fe2+、Fe3+的更优试剂
前面了解到很多配合物具有特征颜色,可以在离子检验中发挥作用。那么,能否利用配合物直接检验 Fe2+ 呢?
1、请你预测以下物质是否有可能与Fe2+、Fe3+形成配合物。如果能形成,会与哪个原子形成配位键?
寻找检验Fe2+、Fe3+的更优试剂
请分别向0.001mol/L的FeSO4和Fe2(SO4)3溶液中滴加试剂(3-5滴)并记录实验现象。
Fe2(SO4)3 FeSO4
苯酚
邻二氮菲
KSCN
EDTA-2Na
无明显现象
无明显现象
溶液变红
溶液变浅黄色
血红色
黄色
寻找检验Fe2+、Fe3+的更优试剂
螯合物更稳定
EDTA-2Na 乙二胺四乙酸二钠盐
多齿配体
EDTA-2Na 溶 液 中, 每 个 EDTA2- 可 以 电 离出 2 个 H+,生成 EDTA4-,然后与金属离子配位。EDTA4- 中的 2 个 N、4 个 O 都可以与金属离子结合,这类配体称为多齿配体,形成的配合物称为螯合物。
EDTA适合检验Fe3+吗?
提示:配体结合中心离子的能力是有强弱之分的。
通常,配位键越强,配体能配位的原子越多,越容易形成配合物,配合物也就越稳定。
一般而言,稳定性弱的配合物容易转化为稳定性强的配合物。
请分别向0.001mol/L的FeSO4和Fe2(SO4)3溶液中滴加试剂(3-5滴)并记录实验现象。
Fe2(SO4)3 FeSO4
苯酚
邻二氮菲
KSCN
EDTA-2Na
无明显现象
无明显现象
溶液变红
溶液变浅黄色
无明显现象
溶液变橙色
无明显现象
无明显现象
【初步总结】
Fe3+ 可使用KSCN特征检验;
Fe2+可使用邻二氮菲特征检验。
探究邻二氮菲检验Fe2+的适宜环境
根据所给试剂和仪器设计实验方案,探究邻二氮菲检验Fe2+的适宜环境
试剂:FeSO4溶液、邻二氮菲溶液、NaOH溶液、稀硫酸、蒸馏水。
仪器:试管、胶头滴管
酸碱性为什么会对邻二氮菲检验Fe2+有影响?请从结构或平衡角度解释。
Fe2+
+2H+
H+
H+
+Fe2+
加酸:
Fe2+
+2OH-
+Fe(OH)2
加碱:
H+与Fe2+竞争邻二氮菲
配体受酸碱性影响
OH-与邻二氮菲竞争Fe2+
中心离子受酸碱性影响
邻二氮菲检验Fe2+最适PH范围是2-9
Fe3+ 可使用KSCN特征检验,适宜环境为PH<3的酸性环境。
Fe2+可使用邻二氮菲特征检验,适宜环境约为2二、根据目视比色法定量测定补铁药片中Fe2+的含量
比色法
邻二氮菲显色测量亚铁离子的浓度
由于溶液颜色的深浅与有色物质的浓度有关,可以通过比较颜色深浅确定有色物质的浓度,这种方法称为比色法,其中最简单的是目视比色法。
目视比色法的基本思路为:用该物质的已知浓度且浓度较大的溶液通过稀释配制一系列浓度呈等差分布的溶液,在一定条件下显色后作为标准色阶;然后将待测溶液在相同条件下显色,并与标准色阶进行比较,从而确定待测物质的浓度。
补铁剂中铁元素的检验
第2章 微粒间相互作用与物质性质
了解金属离子可以形成丰富多彩的配合物,许多配合物都具有颜色;知道可以利用形成的配合物的特征颜色对金属离子进行定性检验。
了解配合物的稳定性各不相同,配合物之间可以发生转化;知道如何在实验过程中根据配合物的稳定性及转化关系选择实验条件。
补铁药物种类繁多,常见的有效成分有硫酸亚铁、琥珀酸亚铁、富马酸亚铁、葡萄糖酸亚铁等,其中多种为亚铁离子的配合物。在补铁药物中也有铁离子的配合物,如蛋白琥珀酸铁等。
药片里是否含有Fe2+?里面的Fe2+是否被氧化成了Fe3+?
请设计实验方案,检验补铁药片中铁元素的价态
一、补铁药片中铁元素价态的检验
药片里是否含有Fe2+?里面的Fe2+是否被氧化成了Fe3+?
由于 Fe2+ 具有还原性,药品在保存过程中可能生成 Fe3+。
Fe2+ 与 Fe3+ 在水溶液中均有颜色,但是在浓度较低时肉眼几乎观察不到;不过,它们形成配合物后往往会显示特征颜色,且颜色较深。
实验一:
根据所给试剂和仪器设计实验方案,检验该药片在保存过程中铁元素是否被部分氧化成三价?
试剂:琥珀酸亚铁片、稀硫酸、KSCN溶液、蒸馏水
仪器:试管、研钵、胶头滴管、玻璃棒、小烧杯
实验任务 实验方案 实验现象 实验结论
任务1
对于同一批药片,用 KSCN 溶液检验 Fe3+,有的小组观察到溶液变红,说明药片被氧化,但也有的小组没有观察到该现象。
讨论:为什么溶解方式不同,带来的实验现象不同?
对比实验过程发现:用酸溶解药片配制成悬浊液的小组,用 KSCN 溶液检验Fe3+ 观察到溶液变红,而用蒸馏水溶解药片的小组没有观察到溶液变红。
Fe3+ 的水合离子[Fe(H2O)6]3+ 呈淡紫色(稀溶液时为无色),但因 Fe3+ 极易水解,故未充分酸化的水溶液会由于有[Fe(OH)]2+ 存在而显黄色。随着 pH 升高,Fe3+ 水解程度增大,可生成 Fe(OH)3 胶体或沉淀。用 KSCN 溶液检验 Fe3+ 时,SCN- 会与OH- 竞争结合 Fe3+。由于 OH- 更易与 Fe3+ 结合,在 pH>3 时,SCN- 无法竞争到Fe3+;
在 pH<3 时,OH- 浓度很小,这时 SCN- 可以竞争到 Fe3+,故能观察到溶液变红色。
由此可知,用 SCN- 检验 Fe3+ 须在酸性条件下进行
药片中是否存在着正二价的铁元素?
2.结合说明书思考以上方法检验补铁剂中的Fe2+是否可行?
1.思考哪些方法可以检验Fe2+?
①观察颜 ②NaOH沉淀法 ③KSCN+氯水 ④酸性高锰酸钾
考虑到补铁药片中可能含有其他还原剂,因此无法说明溶液中含有 Fe2+
有什么方法,能像检验Fe3+一样,直接检验Fe2+?
进一步设计出控制变量的实验,检验猜想的合理性,确认影响因素。
在遇到陌生现象希望寻找其发生的原因时,可以按下列思路进行:
列出体系中存在的微粒
逐一判断每一种微粒是否有可能是影响因素
筛选出潜在的影响因素
作出解释、猜想
寻找检验Fe2+、Fe3+的更优试剂
前面了解到很多配合物具有特征颜色,可以在离子检验中发挥作用。那么,能否利用配合物直接检验 Fe2+ 呢?
1、请你预测以下物质是否有可能与Fe2+、Fe3+形成配合物。如果能形成,会与哪个原子形成配位键?
寻找检验Fe2+、Fe3+的更优试剂
请分别向0.001mol/L的FeSO4和Fe2(SO4)3溶液中滴加试剂(3-5滴)并记录实验现象。
Fe2(SO4)3 FeSO4
苯酚
邻二氮菲
KSCN
EDTA-2Na
无明显现象
无明显现象
溶液变红
溶液变浅黄色
血红色
黄色
寻找检验Fe2+、Fe3+的更优试剂
螯合物更稳定
EDTA-2Na 乙二胺四乙酸二钠盐
多齿配体
EDTA-2Na 溶 液 中, 每 个 EDTA2- 可 以 电 离出 2 个 H+,生成 EDTA4-,然后与金属离子配位。EDTA4- 中的 2 个 N、4 个 O 都可以与金属离子结合,这类配体称为多齿配体,形成的配合物称为螯合物。
EDTA适合检验Fe3+吗?
提示:配体结合中心离子的能力是有强弱之分的。
通常,配位键越强,配体能配位的原子越多,越容易形成配合物,配合物也就越稳定。
一般而言,稳定性弱的配合物容易转化为稳定性强的配合物。
请分别向0.001mol/L的FeSO4和Fe2(SO4)3溶液中滴加试剂(3-5滴)并记录实验现象。
Fe2(SO4)3 FeSO4
苯酚
邻二氮菲
KSCN
EDTA-2Na
无明显现象
无明显现象
溶液变红
溶液变浅黄色
无明显现象
溶液变橙色
无明显现象
无明显现象
【初步总结】
Fe3+ 可使用KSCN特征检验;
Fe2+可使用邻二氮菲特征检验。
探究邻二氮菲检验Fe2+的适宜环境
根据所给试剂和仪器设计实验方案,探究邻二氮菲检验Fe2+的适宜环境
试剂:FeSO4溶液、邻二氮菲溶液、NaOH溶液、稀硫酸、蒸馏水。
仪器:试管、胶头滴管
酸碱性为什么会对邻二氮菲检验Fe2+有影响?请从结构或平衡角度解释。
Fe2+
+2H+
H+
H+
+Fe2+
加酸:
Fe2+
+2OH-
+Fe(OH)2
加碱:
H+与Fe2+竞争邻二氮菲
配体受酸碱性影响
OH-与邻二氮菲竞争Fe2+
中心离子受酸碱性影响
邻二氮菲检验Fe2+最适PH范围是2-9
Fe3+ 可使用KSCN特征检验,适宜环境为PH<3的酸性环境。
Fe2+可使用邻二氮菲特征检验,适宜环境约为2
比色法
邻二氮菲显色测量亚铁离子的浓度
由于溶液颜色的深浅与有色物质的浓度有关,可以通过比较颜色深浅确定有色物质的浓度,这种方法称为比色法,其中最简单的是目视比色法。
目视比色法的基本思路为:用该物质的已知浓度且浓度较大的溶液通过稀释配制一系列浓度呈等差分布的溶液,在一定条件下显色后作为标准色阶;然后将待测溶液在相同条件下显色,并与标准色阶进行比较,从而确定待测物质的浓度。
