1.2 课时2 元素周期律 课件(共22张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2 课时2 元素周期律 课件(共22张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |
|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
元素周期律
第一章 原子结构与性质
1. 认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,能从电子排布的角度对元素性质的周期性变化进行解释,促进对"结构"与"性质"关系的理解
2. 建构元素周期律模型,能列举元素周期律的应用。
在元素周期表中,核外电子周期性排布规律,原子半径、主族元素的主要化合价、元素金属性与非金属性的周期性的变化规律是什么呢?
一、原子半径周期性递变规律
原子半径
电子的能层数
核电荷数
取决于
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
电子的能层越多,电子之间的排除作用越大,将使原子的半径增大。
离子半径如何比较?思考总结粒子半径的比较方法。
特例:rLi>rAl
越大
越大
原子半径_____
核电荷数越小
电子的能层数
原子半径_____
能层数越多
①
核电荷数
能层数相同
②
越大
原子半径_____
核外电子数越多
核外电子数
核电荷数和能层数都相同
③
电离能
定量
原子失电子的能力
金属性
定性
原子得电子的能力
非金属性
定性
电负性
定量
二、电离能的递变规律
1.第一电离能 气态基态原子失去一个电子转化为气态基态正离子所需的最低能量,I1表示
2.逐级电离能 +1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,用I2表示;依次类推
3.电离能反映气态基态原子(离子)得失电子能力
气态原子(离子)电离能越小,越易失电子
电离能越大 ,越难失电子
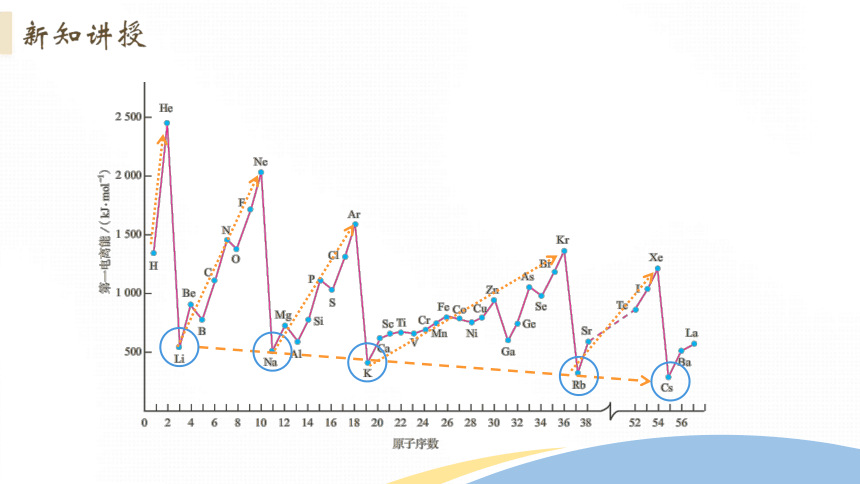
分析第ⅡA族和第ⅢA族,第ⅤA族和第ⅥA族第一电离能出现反常的原因
s轨道处于全充满状态
p轨道处于半充满状态
具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值较大
观察课本图表,原子的逐级电离能为什么越来越大?
原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,需要更多的能量。
观察逐级电离能和元素常见化合价有什么关系?
Na(g)===Na+(g) + e-
Na+(g)===Na2+(g) + e-
1s22s22p63s1
1s22s22p6 全满稳定
1s22s22p6全满稳定
1s22s22p5
由此可判断价态:钠、镁、铝的最高化合价分别是+1、+2、+3
电离能的应用
判断元素的金属性、非金属性强弱
判断主族元素的最高正化合价或最外层电子数
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n价离子而不易形成+(n+1)价离。如果是主族元素,则其最外层有n个电子,最高正化合价为+n(O、F除外)。
确定元素原子的核外电子排布
Na的逐级电离能I1 I21.以下说法不正确的是( )
A.第一电离能越小,表示气态原子越容易失电子
B.同一元素的电离能,各级电离能逐级增大
C.在元素周期表中,主族元素原子的第一电离能
从左到右一定是越来越大
D.在元素周期表中,同主族元素从上到下,
第一电离能呈现递减的趋势
C
三、电负性的递变规律
1.定义:电负性是原子在分子中吸引键合电子能力的标度
电负性越大的原子,对键合电子的吸引力越大
2.电负性计算标准
相对标准:F:4.0 Li:1.0 据此,得到电负性数据表格
H
.
.
.
.
F
.
.
+
.
.
.
.
F
.
.
H
.
.
键合电子
孤对电子
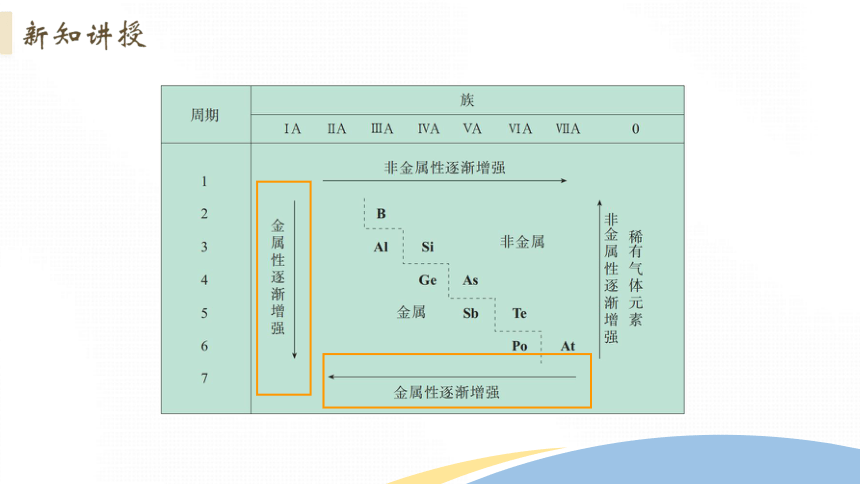
同周期,同主族电负性的递变规律是什么呢?
同一周期从左到右,元素的电负性递增
同一主族自上而下,元素的电负性递减
电负性可判断元素的金属性和非金属性及其强弱
①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
电负性的应用
判断元素的金属性、非金属性强弱
判断元素的化合价
判断化学键的性质
电负性大的元素易呈现负价,电负性小的元素易呈现正价
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
2.1
2.5
+
H
H
2.判断以下氧化还原反应的氧化产物分别是什么?
SiH4 + 2O2 SiO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
点燃
SiH4 + 2O2 SiO2 + 2H2O
甲硅烷是一种较强还原剂
+4
-1
+1
+4
-2
-2
0
氧化产物
CH4 + 2O2 CO2 + 2H2O
点燃
氧化产物
-4
+1
+1
+4
-2
-2
0
3.下列说法不正确的是( )
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第ⅦA族的观点
A
元素周期律
第一章 原子结构与性质
1. 认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,能从电子排布的角度对元素性质的周期性变化进行解释,促进对"结构"与"性质"关系的理解
2. 建构元素周期律模型,能列举元素周期律的应用。
在元素周期表中,核外电子周期性排布规律,原子半径、主族元素的主要化合价、元素金属性与非金属性的周期性的变化规律是什么呢?
一、原子半径周期性递变规律
原子半径
电子的能层数
核电荷数
取决于
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
电子的能层越多,电子之间的排除作用越大,将使原子的半径增大。
离子半径如何比较?思考总结粒子半径的比较方法。
特例:rLi>rAl
越大
越大
原子半径_____
核电荷数越小
电子的能层数
原子半径_____
能层数越多
①
核电荷数
能层数相同
②
越大
原子半径_____
核外电子数越多
核外电子数
核电荷数和能层数都相同
③
电离能
定量
原子失电子的能力
金属性
定性
原子得电子的能力
非金属性
定性
电负性
定量
二、电离能的递变规律
1.第一电离能 气态基态原子失去一个电子转化为气态基态正离子所需的最低能量,I1表示
2.逐级电离能 +1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,用I2表示;依次类推
3.电离能反映气态基态原子(离子)得失电子能力
气态原子(离子)电离能越小,越易失电子
电离能越大 ,越难失电子
分析第ⅡA族和第ⅢA族,第ⅤA族和第ⅥA族第一电离能出现反常的原因
s轨道处于全充满状态
p轨道处于半充满状态
具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值较大
观察课本图表,原子的逐级电离能为什么越来越大?
原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,需要更多的能量。
观察逐级电离能和元素常见化合价有什么关系?
Na(g)===Na+(g) + e-
Na+(g)===Na2+(g) + e-
1s22s22p63s1
1s22s22p6 全满稳定
1s22s22p6全满稳定
1s22s22p5
由此可判断价态:钠、镁、铝的最高化合价分别是+1、+2、+3
电离能的应用
判断元素的金属性、非金属性强弱
判断主族元素的最高正化合价或最外层电子数
如果电离能在In与In+1之间发生突变,则元素的原子易形成+n价离子而不易形成+(n+1)价离。如果是主族元素,则其最外层有n个电子,最高正化合价为+n(O、F除外)。
确定元素原子的核外电子排布
Na的逐级电离能I1 I2
A.第一电离能越小,表示气态原子越容易失电子
B.同一元素的电离能,各级电离能逐级增大
C.在元素周期表中,主族元素原子的第一电离能
从左到右一定是越来越大
D.在元素周期表中,同主族元素从上到下,
第一电离能呈现递减的趋势
C
三、电负性的递变规律
1.定义:电负性是原子在分子中吸引键合电子能力的标度
电负性越大的原子,对键合电子的吸引力越大
2.电负性计算标准
相对标准:F:4.0 Li:1.0 据此,得到电负性数据表格
H
.
.
.
.
F
.
.
+
.
.
.
.
F
.
.
H
.
.
键合电子
孤对电子
同周期,同主族电负性的递变规律是什么呢?
同一周期从左到右,元素的电负性递增
同一主族自上而下,元素的电负性递减
电负性可判断元素的金属性和非金属性及其强弱
①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
电负性的应用
判断元素的金属性、非金属性强弱
判断元素的化合价
判断化学键的性质
电负性大的元素易呈现负价,电负性小的元素易呈现正价
电负性的差值较大 离子键
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性 0.9
3.0
电负性的差值较小 共价键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
2.1
2.5
+
H
H
2.判断以下氧化还原反应的氧化产物分别是什么?
SiH4 + 2O2 SiO2 + 2H2O
CH4 + 2O2 CO2 + 2H2O
点燃
SiH4 + 2O2 SiO2 + 2H2O
甲硅烷是一种较强还原剂
+4
-1
+1
+4
-2
-2
0
氧化产物
CH4 + 2O2 CO2 + 2H2O
点燃
氧化产物
-4
+1
+1
+4
-2
-2
0
3.下列说法不正确的是( )
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第ⅦA族的观点
A
