2.2 课时2 价层电子对互斥模型 课件 2024-2(共25张PPT)025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时2 价层电子对互斥模型 课件 2024-2(共25张PPT)025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:28:28 | ||
图片预览






文档简介
(共25张PPT)
价层电子对互斥模型
第二章 分子结构与性质
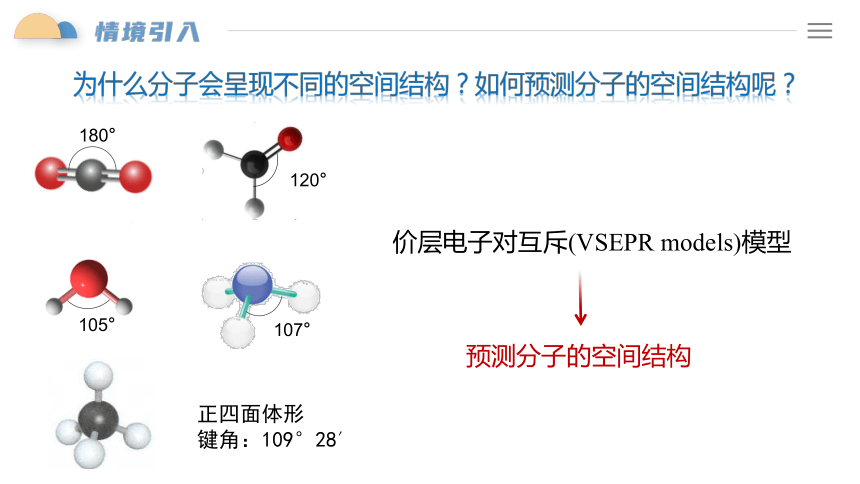
为什么分子会呈现不同的空间结构?如何预测分子的空间结构呢?
180°
105°
107°
120°
价层电子对互斥(VSEPR models)模型
预测分子的空间结构
正四面体形 键角:109°28′
1、认识微观结构对分子立体构型的影响,了解共价分子结构的多样性和复杂性;
2、能计算中心原子上的孤电子对数的计算;
3、在理解价层电子对互斥模型的基础上,对分子或离子的空间构型进行解释和预测。
一、价层电子对互斥模型(VSEPR模型)
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
σ键电子对
中心原子上的孤电子对
价层电子对
两个原子间的成键电子对不论是单键还是多重键,都看作一个空间取向(即只计σ键电子对,不计π键电子对);一对孤电子对可看作一个空间取向。
因此,我们可以先分析分子中的中心原子的价层电子对存在几个空间取向,再让这几个空间取向尽量彼此远离,就可以推测出分子的空间结构。
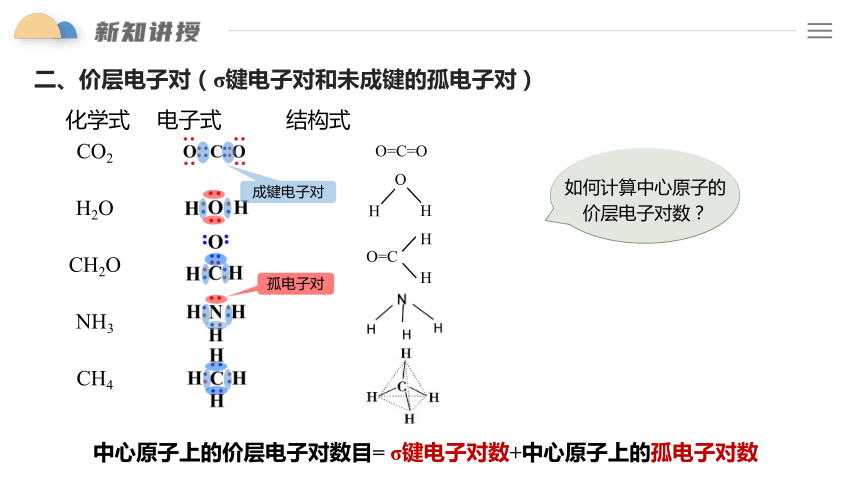
二、价层电子对(σ键电子对和未成键的孤电子对)
化学式 电子式 结构式
CO2
H2O
CH2O
NH3
CH4
成键电子对
孤电子对
如何计算中心原子的价层电子对数?
O=C=O
O
H
H
O=C
H
H
中心原子上的价层电子对数目= σ键电子对数+中心原子上的孤电子对数
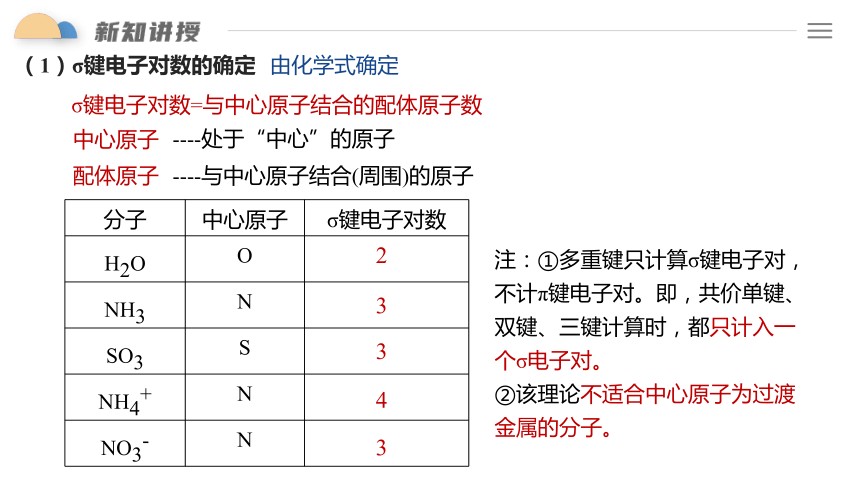
分子 中心原子 σ键电子对数
H2O O
NH3 N
SO3 S
NH4+ N
NO3- N
2
3
3
(1)σ键电子对数的确定
σ键电子对数=与中心原子结合的配体原子数
由化学式确定
中心原子
配体原子
----处于“中心”的原子
----与中心原子结合(周围)的原子
4
3
注:①多重键只计算σ键电子对,不计π键电子对。即,共价单键、双键、三键计算时,都只计入一个σ电子对。
②该理论不适合中心原子为过渡金属的分子。
孤电子对数=
2
—
1
(a-xb)
(2)中心原子上的孤电子对数
如:ABX 型粒子
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
对主族元素:a=
对于阳离子:a=
对于阴离子:a=
价电子数-电荷数
最外层电子数
价电子数+电荷数(绝对值)
b: H为1,
其他原子=
8﹣该原子的价电子数
中心原子的价电子数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
CO2
CO32-
NH4+
H3O+
SO32-
计算中心原子上的孤电子对数= 1/2(a-χb)
C
4
2
2
(4-2×2)÷2=0
注意:对于离子团,所带电荷数计入中心原子的价层电子中。
即: a = 中心原子价电子数—电荷数
C
N
4-(-2)=6
3
2
(6-3×2)÷2=0
5-1=4
4
1
(4-4×1)÷2=0
O
6-1=5
3
1
(5-3×1)÷2=1
S
3
2
(8-3×2)÷2=1
6-(-2)=8
价电子数
结合的原子个数
结合原子最多所能接受的电子数
三、VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路:ABn型分子
价层电子对 互斥理论
判断VSEPR模型
分子的立体构型
价层电子对数=σ键电子对数+孤电子对数
略去
孤电子对
σ键电子对数=结合原子数
中心原子上的孤电子对
价层电子对互斥(VSEPR)模型不能用于预测以过渡金属为中心原子的分子。
价层电子对数:2
价层电子对数:3
价层电子对数:4
价层电子对数:5
价层电子对数:6
直线形
平面三角形
正四面体形
三角双锥形
八面体形
价层电子对的空间结构(即VSEPR模型)
分子 或离子 σ键 电子数 孤电子对数 VSEPR模型 VSEPR 模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2
CH4
2
3
4
0
0
0
直线形
平面三角形
正四面体形
直线形
平面三角形
正四面体形
(1)中心原子无孤电子对的分子或离子
(2)中心原子有孤电子对的分子
分子 或离子 σ键 电子数 孤电子对数 VSEPR模型 VSEPR 模型名称 分子或离子的空间结构 分子或离子的空间结构名称
NH3
H2O
SO2
2
2
2
1
1
3
四面体形
V形
V形
四面体形
平面三角形
三角锥形
特别提醒 价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
2
3
直线形
2 0 AB2
直线形
3 0 AB3
平面
三角形
2 1 AB2
V形
O3 SO2
平面
三角形
BF3、BCl3、
SO3
CO2、BeCl2
ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
4
正四面体
正四
面体
三角
锥形
V形
H2O
4 0 AB4
3 1 AB3
2 2 AB2
NH3、NF3
CH4、CCl4
思考与讨论
直线形
平面三角形
四面体形
平面三角形
注意:多中心原子的分子,中心原子孤电子对的计算公式不适合。
1、C2H2、C2H4、C2H6、苯分子中碳原子的空间构型如何?
1、实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
成键电子对相互排斥
一对孤电子对对成键电子对排斥
两对孤电子对对成键电子对排斥
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
拓展:孤电子对影响分子键角:
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
109°28′
107°
105°
2、同为三角锥形结构,键角NH3>PH3 而NH3>NF3?为什么“中心原子电负性越大,键角越大;配位原子电负性越大,键角越小”试给出合理解释?
因为中心原子的电负性越大,成键电子对更靠近中心原子,成键电子对之间斥力增大,所以键角增大。
配位原子的电负性越大,成键电子对远离中心原子,成键电子对之间斥力减小,所以键角减小。
电负性O大于S,中心原子电负性越大,共用电子对越靠近中心原子,共用电子对之间的排斥力越大,键角越大。
中心原子电负性越大,键角越大;周围原子电负性越大,键角越小
3.H2O和H2S都是V形结构,但键角:H2O>H2S,分析原因
4.甲醛分子中键角:∠H—C=O >∠H—C—H,分析原因。
碳氧双键中有π键,排斥作用较强。
同一粒子中不同共价键的键角,
斥力:双键间>双键与单键间>单键间,则键角大小不同。
思考与讨论
1、以S和P为例,说明如何根据主族元素在周期表中的位置确定它的价电子数
2、以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
S的价电子数是6,P的价电子数是5
N最多能接受的电子数是3,Cl最多能接受的电子数1
分子或离子 σ键电子对数 孤电子对数 价层电子对数 VSEPR模型 空间结构
HCN
NO2-
NH2-
NO3-
H3O+
SiCl4
CHCl3
NH4+
PO43-
0
1
2
0
1
0
0
0
2
3
4
3
4
4
4
4
直线形
V 形
V 形
平面三角形
三角锥形
四面体
正四面体
正四面体
0
4
正四面体
2
2
2
3
3
4
4
4
4
直线形
平面三角形
四面体
正四面体
正四面体
正四面体
平面三角形
四面体
四面体
预测下列微粒的空间结构。
AB2型分子:直线形或V形
价层电子对
互斥模型
价层电子对互斥模型
价层电子对互斥模型
的应用——预测分子(或离子)空间结构
价层电子对数为=σ键电子对数+孤电子对数
价层电子对相互排斥,趋于尽可能远离而减小斥力
价层电子对数为2时:直线形
价层电子对数为3时:平面三角形、V形
价层电子对数为4时:四面体形、三角锥形、V形
价层电子对数为5时:常见三角双锥形
价层电子对数为6时:正八面体形
分子尽可能采取
对称的空间结构
步骤:价层电子对数→ VSEPR模型→空间结构
AB3型分子:平面三角形或三角锥形
AB4型分子:常见四面体形
分子(或离子)
空间结构
1.下列微粒的VSEPR模型与空间立体构型一致的是 ( )
A.BF3 B.SO2 C.H2O D.SO32-
2.下列有关描述正确的是 ( )
A. NO3-为V形分子
B. ClO3-的空间结构为平面三角形
C. NO3-的VSEPR模型、空间结构均为平面三角形
D. ClO3-的VSEPR模型、空间结构相同
3.以下分子或离子的结构为正四面体,且键角为109°28′ 的是 ( )
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
A
C
C
4.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
5.运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1) BeCl2 ; (2) SCl2 ;
SO32-___________; (4) PF3 ;
(5) H2Se ; (6) BBr3____________;
(7) CHCl3 ; (8) SiF4____________。
直线形
V形
三角锥形
三角锥形
V形
平面三角形
四面体形
正四面体形
价层电子对互斥模型
第二章 分子结构与性质
为什么分子会呈现不同的空间结构?如何预测分子的空间结构呢?
180°
105°
107°
120°
价层电子对互斥(VSEPR models)模型
预测分子的空间结构
正四面体形 键角:109°28′
1、认识微观结构对分子立体构型的影响,了解共价分子结构的多样性和复杂性;
2、能计算中心原子上的孤电子对数的计算;
3、在理解价层电子对互斥模型的基础上,对分子或离子的空间构型进行解释和预测。
一、价层电子对互斥模型(VSEPR模型)
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
σ键电子对
中心原子上的孤电子对
价层电子对
两个原子间的成键电子对不论是单键还是多重键,都看作一个空间取向(即只计σ键电子对,不计π键电子对);一对孤电子对可看作一个空间取向。
因此,我们可以先分析分子中的中心原子的价层电子对存在几个空间取向,再让这几个空间取向尽量彼此远离,就可以推测出分子的空间结构。
二、价层电子对(σ键电子对和未成键的孤电子对)
化学式 电子式 结构式
CO2
H2O
CH2O
NH3
CH4
成键电子对
孤电子对
如何计算中心原子的价层电子对数?
O=C=O
O
H
H
O=C
H
H
中心原子上的价层电子对数目= σ键电子对数+中心原子上的孤电子对数
分子 中心原子 σ键电子对数
H2O O
NH3 N
SO3 S
NH4+ N
NO3- N
2
3
3
(1)σ键电子对数的确定
σ键电子对数=与中心原子结合的配体原子数
由化学式确定
中心原子
配体原子
----处于“中心”的原子
----与中心原子结合(周围)的原子
4
3
注:①多重键只计算σ键电子对,不计π键电子对。即,共价单键、双键、三键计算时,都只计入一个σ电子对。
②该理论不适合中心原子为过渡金属的分子。
孤电子对数=
2
—
1
(a-xb)
(2)中心原子上的孤电子对数
如:ABX 型粒子
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
对主族元素:a=
对于阳离子:a=
对于阴离子:a=
价电子数-电荷数
最外层电子数
价电子数+电荷数(绝对值)
b: H为1,
其他原子=
8﹣该原子的价电子数
中心原子的价电子数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
CO2
CO32-
NH4+
H3O+
SO32-
计算中心原子上的孤电子对数= 1/2(a-χb)
C
4
2
2
(4-2×2)÷2=0
注意:对于离子团,所带电荷数计入中心原子的价层电子中。
即: a = 中心原子价电子数—电荷数
C
N
4-(-2)=6
3
2
(6-3×2)÷2=0
5-1=4
4
1
(4-4×1)÷2=0
O
6-1=5
3
1
(5-3×1)÷2=1
S
3
2
(8-3×2)÷2=1
6-(-2)=8
价电子数
结合的原子个数
结合原子最多所能接受的电子数
三、VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路:ABn型分子
价层电子对 互斥理论
判断VSEPR模型
分子的立体构型
价层电子对数=σ键电子对数+孤电子对数
略去
孤电子对
σ键电子对数=结合原子数
中心原子上的孤电子对
价层电子对互斥(VSEPR)模型不能用于预测以过渡金属为中心原子的分子。
价层电子对数:2
价层电子对数:3
价层电子对数:4
价层电子对数:5
价层电子对数:6
直线形
平面三角形
正四面体形
三角双锥形
八面体形
价层电子对的空间结构(即VSEPR模型)
分子 或离子 σ键 电子数 孤电子对数 VSEPR模型 VSEPR 模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2
CH4
2
3
4
0
0
0
直线形
平面三角形
正四面体形
直线形
平面三角形
正四面体形
(1)中心原子无孤电子对的分子或离子
(2)中心原子有孤电子对的分子
分子 或离子 σ键 电子数 孤电子对数 VSEPR模型 VSEPR 模型名称 分子或离子的空间结构 分子或离子的空间结构名称
NH3
H2O
SO2
2
2
2
1
1
3
四面体形
V形
V形
四面体形
平面三角形
三角锥形
特别提醒 价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
2
3
直线形
2 0 AB2
直线形
3 0 AB3
平面
三角形
2 1 AB2
V形
O3 SO2
平面
三角形
BF3、BCl3、
SO3
CO2、BeCl2
ABn 型分子的VSEPR模型和立体结构
价电子对数 VSEPR 模型 成键电子对数 孤对电子对数 分子类型 电子对的排布模型 立体结构 实 例
4
正四面体
正四
面体
三角
锥形
V形
H2O
4 0 AB4
3 1 AB3
2 2 AB2
NH3、NF3
CH4、CCl4
思考与讨论
直线形
平面三角形
四面体形
平面三角形
注意:多中心原子的分子,中心原子孤电子对的计算公式不适合。
1、C2H2、C2H4、C2H6、苯分子中碳原子的空间构型如何?
1、实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
成键电子对相互排斥
一对孤电子对对成键电子对排斥
两对孤电子对对成键电子对排斥
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
拓展:孤电子对影响分子键角:
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
109°28′
107°
105°
2、同为三角锥形结构,键角NH3>PH3 而NH3>NF3?为什么“中心原子电负性越大,键角越大;配位原子电负性越大,键角越小”试给出合理解释?
因为中心原子的电负性越大,成键电子对更靠近中心原子,成键电子对之间斥力增大,所以键角增大。
配位原子的电负性越大,成键电子对远离中心原子,成键电子对之间斥力减小,所以键角减小。
电负性O大于S,中心原子电负性越大,共用电子对越靠近中心原子,共用电子对之间的排斥力越大,键角越大。
中心原子电负性越大,键角越大;周围原子电负性越大,键角越小
3.H2O和H2S都是V形结构,但键角:H2O>H2S,分析原因
4.甲醛分子中键角:∠H—C=O >∠H—C—H,分析原因。
碳氧双键中有π键,排斥作用较强。
同一粒子中不同共价键的键角,
斥力:双键间>双键与单键间>单键间,则键角大小不同。
思考与讨论
1、以S和P为例,说明如何根据主族元素在周期表中的位置确定它的价电子数
2、以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
S的价电子数是6,P的价电子数是5
N最多能接受的电子数是3,Cl最多能接受的电子数1
分子或离子 σ键电子对数 孤电子对数 价层电子对数 VSEPR模型 空间结构
HCN
NO2-
NH2-
NO3-
H3O+
SiCl4
CHCl3
NH4+
PO43-
0
1
2
0
1
0
0
0
2
3
4
3
4
4
4
4
直线形
V 形
V 形
平面三角形
三角锥形
四面体
正四面体
正四面体
0
4
正四面体
2
2
2
3
3
4
4
4
4
直线形
平面三角形
四面体
正四面体
正四面体
正四面体
平面三角形
四面体
四面体
预测下列微粒的空间结构。
AB2型分子:直线形或V形
价层电子对
互斥模型
价层电子对互斥模型
价层电子对互斥模型
的应用——预测分子(或离子)空间结构
价层电子对数为=σ键电子对数+孤电子对数
价层电子对相互排斥,趋于尽可能远离而减小斥力
价层电子对数为2时:直线形
价层电子对数为3时:平面三角形、V形
价层电子对数为4时:四面体形、三角锥形、V形
价层电子对数为5时:常见三角双锥形
价层电子对数为6时:正八面体形
分子尽可能采取
对称的空间结构
步骤:价层电子对数→ VSEPR模型→空间结构
AB3型分子:平面三角形或三角锥形
AB4型分子:常见四面体形
分子(或离子)
空间结构
1.下列微粒的VSEPR模型与空间立体构型一致的是 ( )
A.BF3 B.SO2 C.H2O D.SO32-
2.下列有关描述正确的是 ( )
A. NO3-为V形分子
B. ClO3-的空间结构为平面三角形
C. NO3-的VSEPR模型、空间结构均为平面三角形
D. ClO3-的VSEPR模型、空间结构相同
3.以下分子或离子的结构为正四面体,且键角为109°28′ 的是 ( )
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④ C、①②⑤ D、①④⑤
A
C
C
4.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
5.运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1) BeCl2 ; (2) SCl2 ;
SO32-___________; (4) PF3 ;
(5) H2Se ; (6) BBr3____________;
(7) CHCl3 ; (8) SiF4____________。
直线形
V形
三角锥形
三角锥形
V形
平面三角形
四面体形
正四面体形
