1.1 课时1 能层与能级 原子光谱 课件 (共25张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 课时1 能层与能级 原子光谱 课件 (共25张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 42.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:32:12 | ||
图片预览








文档简介
能层与能级
原子光谱
第一章 原子结构与性质
1.认识核外电子的运动特点。通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3.知道原子光谱形成的原因,能论证核外电子运动的能量特点。
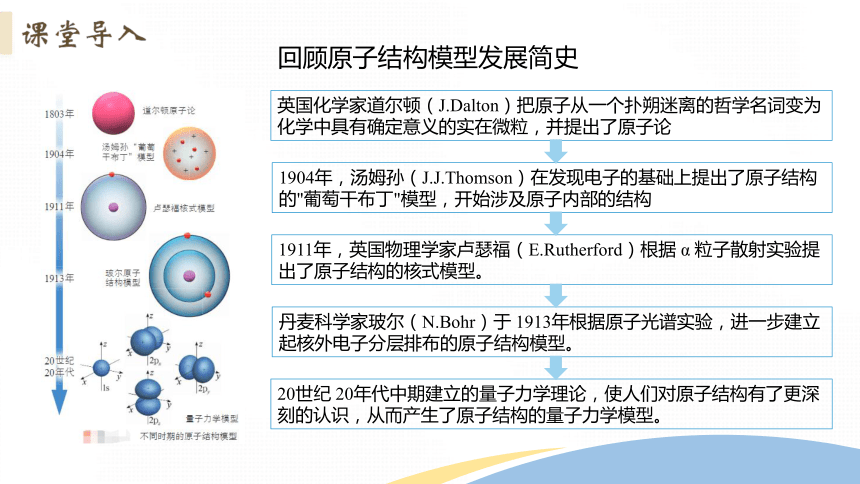
回顾原子结构模型发展简史
英国化学家道尔顿(J.Dalton)把原子从一个扑朔迷离的哲学名词变为化学中具有确定意义的实在微粒,并提出了原子论
1904年,汤姆孙(J.J.Thomson)在发现电子的基础上提出了原子结构的"葡萄干布丁"模型,开始涉及原子内部的结构
1911年,英国物理学家卢瑟福(E.Rutherford)根据 α 粒子散射实验提出了原子结构的核式模型。
丹麦科学家玻尔(N.Bohr)于 1913年根据原子光谱实验,进一步建立起核外电子分层排布的原子结构模型。
20世纪 20年代中期建立的量子力学理论,使人们对原子结构有了更深刻的认识,从而产生了原子结构的量子力学模型。
问题1:结合所学,请画出钠原子原子结构示意图,谈谈你对原子结构的认识。
问题2:研究核外电子排布的实验依据是什么?
研究原子结构的方法——原子光谱
研究原子结构的方法——原子光谱
许多物质都能够吸收光或发射光,人们常常利用原子光谱仪将物质吸收的光或发射的光的频率(或波长)和强度分布记录下来得到光谱。
【思考】如果原子结构真如卢瑟福的核式模型所描述的那样,根据经典的电动力学观点,围绕原子核高速运动的电子一定会自动且连续地辐射能量,最终坍塌到原子核上。
原子的光谱应当是连续光谱,即波长的变化呈连续分布。
卢瑟福原子结构核式模型推论
那么,实际情况如何呢?
研究原子结构的方法——原子光谱
氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱。
在一个被抽成真空、两端含有电极的玻璃管中充入低压氢气,然后在两个电极上施加高压,使氢原子在电场的激发下发光,发出的光经过三棱镜分光后得到如图所示的氢原子光谱图。
尼尔斯·亨利克·戴维·玻尔
核外电子分层排布的原子结构模型
问题3:原子光谱是如何产生的?
K
L
M
N
基态氢原子:处于能量最低状态的氢原子。
K
L
M
N
能量
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
问题3:原子光谱是如何产生的?
不同元素原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
锂、氦、汞的吸收光谱
特征:亮背景、暗线、线状不连续
K
L
M
N
能量
光
K
L
M
N
激发态
基态
光是电子跃迁释放能量的重要形式之一。
问题3:原子光谱是如何产生的?
问题3:原子光谱是如何产生的?
不同元素原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
锂、氦、汞的发射光谱
各种原子的吸收光谱或发射光谱,总称为原子光谱。
特征:暗背景、亮线、 线状不连续
问题4:原子光谱的应用
(1)发现新元素
(3)检验元素
不同元素的焰色试验
(2)鉴定元素
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
1、元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱
C.连续光谱 D.线状光谱
2.请解释钾、钠产生焰色及焰色不同的原因。
钾、钠及其化合物在火上灼烧时,原子中的电子吸收能量,电子从基态跃迁到激发态后,电子不稳定,电子很快跃迁到较低能量的激发态乃至基态时,能量以光的形式释放出来。而释放的光的波长在可见光范围内,因而能使火焰呈现不同的焰色。
钾、钠的原子结构不同电子跃迁是能量变化不同,所以产生的火焰不同
核外电子分层排布的原子结构模型
(1)成功地解释了氢原子光谱是线状光谱的实验事实。
(2)阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨道的能量是量子化的。
尼尔斯·亨利克·戴维·玻尔
问题5:回忆所学,核外电子运动特点和排布规律是什么?
①含有多个电子的原子里,电子分别在能量不同的区域内运动
②核外电子是分层排布的
③离核较近的电子,能量较低,离核较远的电子,能量较高。
能级与能层
1、 能层——电子层
(1)分类依据:
(2)能层的表示方法及各能层最多容纳的电子数
2n2
在多电子的原子中,核外电子的能量是不同的,按电子的能量差异,
可以将核外电子分成不同的能层。
能层
一
二
三
四
五
六
七
符号
K ?
L ?
M ?
N ?
O
P
Q
最多电子数
?
?
2=2×12
8=2×22
18=2×32
32=2×42
50=2×52
72=2×62
98=2×72
能级与能层
1、 能层——电子层
(3)核外电子的排布规律:
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
①先排能量低的电子层,再排能量高的电子层,由里往外。
②每一层最多容纳电子数:2n2个。
③最外层电子数不超过8个(K层为最外层时不超过2个)。
④次外层电子数不超过18个,倒数第三层不超过32个。
问题6:分析钠原子光谱时发现:即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。对于这个现象,你会提出何种假设?
钠原子光谱
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
2、 能级
在多电子原子中,同一能层的电子,能量也可能 ,还可以把它们分成 。
不同
能级
(1)分类依据:
能层是楼层
能级是楼梯的阶梯
能量越来越高
同一能层各能级
能量越来越高
2、 能级
(2)符号 :任一能层的能级都是从 s 能级开始,依次称p、d、f、g能级……
能级数=该能层序数
在同一能层中,能级的能量高低是ns{72833802-FEF1-4C79-8D5D-14CF1EAF98D9}电子层n
能级数
1
s
2
s、p
3
s、p、d
4
s、p、d、f
n
n
能层
K
L
M
N
O
能级
…
最多容纳电子
…
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
(3)能级表示方法及各能级最多容纳的电子数
各能级可容 纳的最多电子数依次为1、3、5、7……的二倍
不同能层中符号相同的能级所容纳的最多电子数 。
相同
问题7:第五能层最多可以容纳多少个电子?
分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)s能级的能量一定比p能级的能量低( )
(4)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍( )
(5)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)( )
×
√
×
×
√
原子光谱
第一章 原子结构与性质
1.认识核外电子的运动特点。通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3.知道原子光谱形成的原因,能论证核外电子运动的能量特点。
回顾原子结构模型发展简史
英国化学家道尔顿(J.Dalton)把原子从一个扑朔迷离的哲学名词变为化学中具有确定意义的实在微粒,并提出了原子论
1904年,汤姆孙(J.J.Thomson)在发现电子的基础上提出了原子结构的"葡萄干布丁"模型,开始涉及原子内部的结构
1911年,英国物理学家卢瑟福(E.Rutherford)根据 α 粒子散射实验提出了原子结构的核式模型。
丹麦科学家玻尔(N.Bohr)于 1913年根据原子光谱实验,进一步建立起核外电子分层排布的原子结构模型。
20世纪 20年代中期建立的量子力学理论,使人们对原子结构有了更深刻的认识,从而产生了原子结构的量子力学模型。
问题1:结合所学,请画出钠原子原子结构示意图,谈谈你对原子结构的认识。
问题2:研究核外电子排布的实验依据是什么?
研究原子结构的方法——原子光谱
研究原子结构的方法——原子光谱
许多物质都能够吸收光或发射光,人们常常利用原子光谱仪将物质吸收的光或发射的光的频率(或波长)和强度分布记录下来得到光谱。
【思考】如果原子结构真如卢瑟福的核式模型所描述的那样,根据经典的电动力学观点,围绕原子核高速运动的电子一定会自动且连续地辐射能量,最终坍塌到原子核上。
原子的光谱应当是连续光谱,即波长的变化呈连续分布。
卢瑟福原子结构核式模型推论
那么,实际情况如何呢?
研究原子结构的方法——原子光谱
氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱。
在一个被抽成真空、两端含有电极的玻璃管中充入低压氢气,然后在两个电极上施加高压,使氢原子在电场的激发下发光,发出的光经过三棱镜分光后得到如图所示的氢原子光谱图。
尼尔斯·亨利克·戴维·玻尔
核外电子分层排布的原子结构模型
问题3:原子光谱是如何产生的?
K
L
M
N
基态氢原子:处于能量最低状态的氢原子。
K
L
M
N
能量
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
问题3:原子光谱是如何产生的?
不同元素原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
锂、氦、汞的吸收光谱
特征:亮背景、暗线、线状不连续
K
L
M
N
能量
光
K
L
M
N
激发态
基态
光是电子跃迁释放能量的重要形式之一。
问题3:原子光谱是如何产生的?
问题3:原子光谱是如何产生的?
不同元素原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
锂、氦、汞的发射光谱
各种原子的吸收光谱或发射光谱,总称为原子光谱。
特征:暗背景、亮线、 线状不连续
问题4:原子光谱的应用
(1)发现新元素
(3)检验元素
不同元素的焰色试验
(2)鉴定元素
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
1、元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱
C.连续光谱 D.线状光谱
2.请解释钾、钠产生焰色及焰色不同的原因。
钾、钠及其化合物在火上灼烧时,原子中的电子吸收能量,电子从基态跃迁到激发态后,电子不稳定,电子很快跃迁到较低能量的激发态乃至基态时,能量以光的形式释放出来。而释放的光的波长在可见光范围内,因而能使火焰呈现不同的焰色。
钾、钠的原子结构不同电子跃迁是能量变化不同,所以产生的火焰不同
核外电子分层排布的原子结构模型
(1)成功地解释了氢原子光谱是线状光谱的实验事实。
(2)阐明了原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨道的能量是量子化的。
尼尔斯·亨利克·戴维·玻尔
问题5:回忆所学,核外电子运动特点和排布规律是什么?
①含有多个电子的原子里,电子分别在能量不同的区域内运动
②核外电子是分层排布的
③离核较近的电子,能量较低,离核较远的电子,能量较高。
能级与能层
1、 能层——电子层
(1)分类依据:
(2)能层的表示方法及各能层最多容纳的电子数
2n2
在多电子的原子中,核外电子的能量是不同的,按电子的能量差异,
可以将核外电子分成不同的能层。
能层
一
二
三
四
五
六
七
符号
K ?
L ?
M ?
N ?
O
P
Q
最多电子数
?
?
2=2×12
8=2×22
18=2×32
32=2×42
50=2×52
72=2×62
98=2×72
能级与能层
1、 能层——电子层
(3)核外电子的排布规律:
E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)
①先排能量低的电子层,再排能量高的电子层,由里往外。
②每一层最多容纳电子数:2n2个。
③最外层电子数不超过8个(K层为最外层时不超过2个)。
④次外层电子数不超过18个,倒数第三层不超过32个。
问题6:分析钠原子光谱时发现:即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。对于这个现象,你会提出何种假设?
钠原子光谱
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
2、 能级
在多电子原子中,同一能层的电子,能量也可能 ,还可以把它们分成 。
不同
能级
(1)分类依据:
能层是楼层
能级是楼梯的阶梯
能量越来越高
同一能层各能级
能量越来越高
2、 能级
(2)符号 :任一能层的能级都是从 s 能级开始,依次称p、d、f、g能级……
能级数=该能层序数
在同一能层中,能级的能量高低是ns
能级数
1
s
2
s、p
3
s、p、d
4
s、p、d、f
n
n
能层
K
L
M
N
O
能级
…
最多容纳电子
…
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
(3)能级表示方法及各能级最多容纳的电子数
各能级可容 纳的最多电子数依次为1、3、5、7……的二倍
不同能层中符号相同的能级所容纳的最多电子数 。
相同
问题7:第五能层最多可以容纳多少个电子?
分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2
5p能级 2×3=6
5d能级 2×5=10
5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
(1)2d表示L层上的d能级( )
(2)同一原子中,1s、2s、3s电子的能量逐渐减小( )
(3)s能级的能量一定比p能级的能量低( )
(4)各能级最多可容纳的电子数按s、p、d、f……的顺序依次为自然数中的奇数序列1、3、5、7……的2倍( )
(5)4s、4p、4d、4f能级的能量的高低顺序为E(4s)<E(4p)<E(4d)<E(4f)( )
×
√
×
×
√
