2.2 课时3 杂化轨道理论 课件 (共31张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时3 杂化轨道理论 课件 (共31张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:38:56 | ||
图片预览






文档简介
(共31张PPT)
杂化轨道理论
第二章 分子结构与性质
我们已经知道,甲烷分子的空间结构呈_________,它的4个C-H的键长_____,键角皆为_____。
按照价键理论,甲烷的4个C-H单键都应该是____。
σ键
正四面体形
相同
109°28′
成键电子中,C、H原子提供的是哪个轨道上的电子?
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
按照价键理论应该形成CH2,为什么最终形成的是CH4呢?
1、了解杂化轨道理论的要点和类型;
2、能运用杂化轨道理论解释简单共价分子和离子的空间结构。
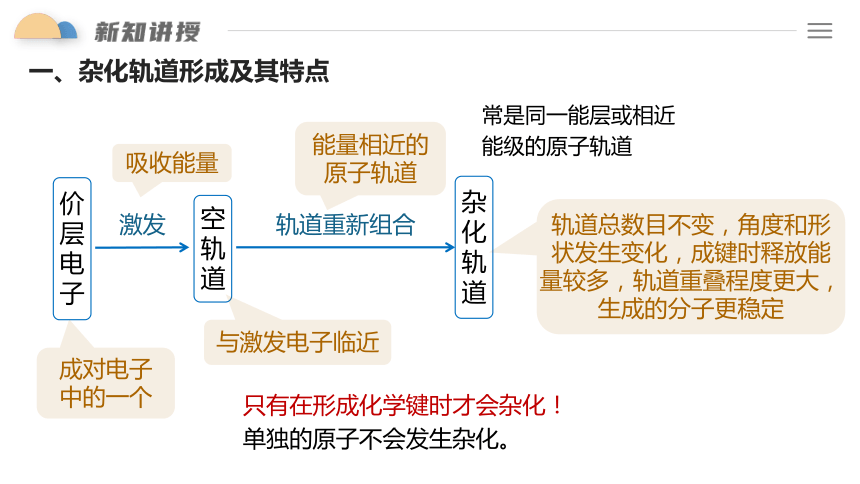
外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
为解决这一矛盾, 1931年鲍林在价键理论的基础上提出了杂化轨道理论,它实际上仍属于现代价键理论。
杂化轨道理论简介
莱纳斯·卡尔·鲍林
(1901年2月28日-1994年8月19日) 美国著名化学家,两获诺贝尔奖
一、杂化轨道形成及其特点
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子
中的一个
与激发电子临近
能量相近的原子轨道
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
只有在形成化学键时才会杂化!
单独的原子不会发生杂化。
常是同一能层或相近能级的原子轨道
甲烷的形成
2s 2p
↑↓
↑
↑
2s 2p
↑
↑
↑
↑
sp3
↑
↑
↑
↑
跃迁
杂化
基态
激发态
杂化轨道
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型
正四面体
H
1s
H
1s
H
1s
H
1s
C
sp3
sp3
109°28′
杂化的条件
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
杂化的特点
杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小
杂化的特点
未参与杂化的p轨道可用于形成π键。
(1)杂化前后轨道数不变
(2)杂化过程中轨道的形状发生变化
(4)杂化后的新轨道能量、形状都相同
(6)杂化轨道只用于形成σ键和容纳孤电子对
(3)杂化后形成的化学键更稳定
(5)杂化后的轨道之间尽可能远离
杂化轨道的类型
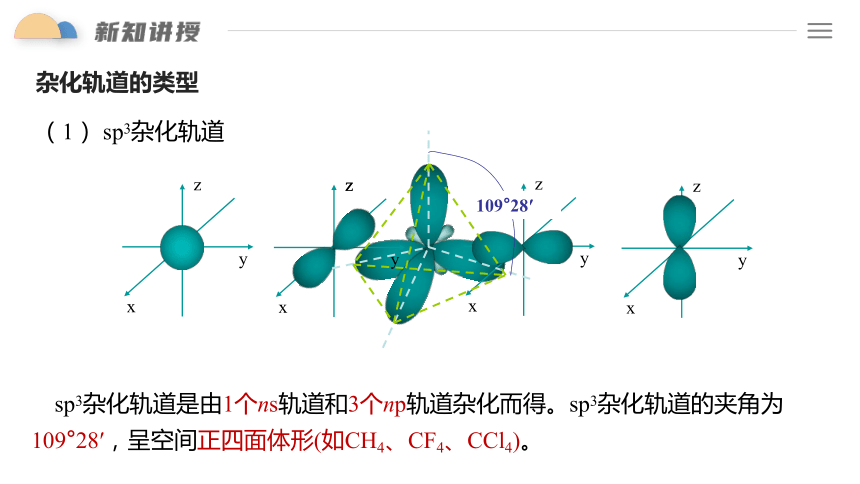
(1) sp3杂化轨道
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道是由1个ns轨道和3个np轨道杂化而得。sp3杂化轨道的夹角为109°28′,呈空间正四面体形(如CH4、CF4、CCl4)。
sp3杂化轨道特征:
①1个ns 轨道与3个np 轨道进行的杂化,形成4个sp3 杂化轨道。
②每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分。
③每两个轨道间的夹角为109 28′,空间构型为正四面体形。
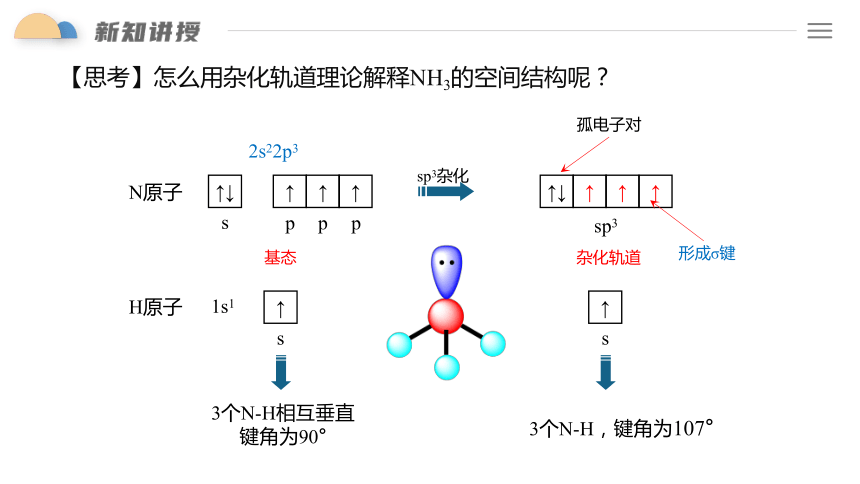
H原子
↑
s
1s1
3个N-H相互垂直
键角为90°
↑
s
3个N-H,键角为107°
N原子
↑↓
s
p
p
p
↑
↑
↑
2s22p3
基态
sp3
↑↓
↑
↑
↑
杂化轨道
【思考】怎么用杂化轨道理论解释NH3的空间结构呢?
孤电子对
sp3杂化
形成σ键
【思考】怎么用杂化轨道理论解释H2O的空间结构呢?
H原子
↑
s
1s1
2个O-H相互垂直
键角为90°
sp3杂化
↑
s
2个O-H,键角为105°
O原子
↑↓
s
p
p
p
↑↓
↑
↑
2s22p4
基态
sp3
↑↓
↑↓
↑
↑
杂化轨道
孤电子对
形成σ键
(2) sp2杂化轨道
x
y
z
z
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由1个ns轨道和2个np轨道杂化而得。sp2杂化轨道间的夹角为120°,呈平面三角形(如BF3)。
未参与杂化的p轨道可用于形成π键。
②每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分。
sp2杂化轨道特征:
①1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
③每两个轨道间的夹角为120°,呈平面三角形。
④ 3个sp2杂化轨道用于形成σ键,未参与杂化的p轨道用于形成π键。
p
sp2
sp2
sp2
分析BF3的中心原子杂化方式。
1个B-F
3个B-F,键角为120°
B原子
↑↓
s
p
p
p
↑
2s22p1
基态
形成σ键
sp2杂化
sp2
↑
↑
↑
杂化轨道
p
F原子
2s22p5
↑↓
s
p
p
p
↑↓
↑↓
↑
↑↓
s
p
p
p
↑↓
↑↓
↑
未杂化轨道
思考与讨论
C原子的2个sp2杂化轨道分别与2个H原子的1S轨道形成2个s-sp2σ键,另一个sp2杂化轨道与另一个C原子的sp2杂化轨道头碰头形成1个σ键。两个C剩余未参与杂化的2p轨道肩并肩形成π键
如何用杂化轨道理论解释CH2=CH2的空间结构呢?
注意:有机物中形成双键的碳原子均为sp2杂化
2s
2p
↑↓
↑
↑
激发
2s
2p
↑
↑
↑
↑
↑
↑
↑
↑
杂化
2p
sp2
头碰头
σ键
肩并肩
肩并肩
σ键
π键
H
H
H
H
乙烯中sp2杂化C原子成键过程
CH2=CH2
(3) sp杂化轨道
x
y
z
x
y
z
z
x
y
z
x
y
z
sp杂化轨道是由1个ns轨道和1个np轨道杂化而得。sp杂化轨道间的夹角为180°,呈直线形(如BeCl2)。分子的空间结构主要取决于原子轨道的杂化类型。
180°
②每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分。
①1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
sp杂化轨道特征:
③两个轨道间的夹角为180°,呈直线型。
④ 2个sp杂化轨道用于形成σ键,未参与杂化的2个p轨道用于形成2个π键。
p
p
sp
sp
分析BeCl2的中心原子杂化方式。
不能形成Be-Cl
2个Be-Cl,键角为180°
Be原子
↑↓
s
p
p
p
2s2
基态
sp
↑
↑
杂化轨道
形成σ键
sp杂化
Cl原子
3s23p5
↑↓
s
p
p
p
↑↓
↑↓
↑
↑↓
s
p
p
p
↑↓
↑↓
↑
p
p
未杂化轨道
思考与讨论
如何用杂化轨道理论解释CH≡CH的空间结构呢?
↑
↑
2s
2p
↑↓
↑
↑
激发
2s
2p
↑
↑
↑
↑
↑
↑
杂化
2p
sp
两个碳原子的1个sp杂化轨道相互重叠形成sp-sp σ键,另外1个杂化轨道与氢原子1s轨道重叠形成两个s-sp σ键,未参与杂化的2个2P轨道相互重叠形成2个π键。
注意:有机物中形成三键的碳原子均为sp杂化
头碰头
σ键
肩并肩
肩并肩
σ键
H
H
乙炔中sp杂化C原子成键过程
π键
π键
CH CH
杂化类型的判断
①因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:中心原子的杂化轨道数=价层电子对数=σ键电子对数(中心原子结合的电子数)+孤电子对数,再由杂化轨道数判断杂化类型。
中心原子的
价层电子对数
规律:
代表物 杂化轨道数 杂化轨道类型
CO2
CH2O
SO2
H2O
0+2=2
sp
0+3=3
sp2
1+2=3
2+2=4
sp2
sp3
2
3
4
sp
sp2
sp3
②通过看中心原子有没有形成双键或三键来判断
若有1个三键或2个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化;
若有1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化;
若全部是单键,则形成sp3杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
→杂化理论和VSEPR模型预测粒子空间结构结果基本一致
价层电子对
互斥模型
杂化轨
道理论
计算价层
电子对数
价层电子对数=σ 键电子对数+中心原子孤电子对数
2
3
4
直线形
平面三角形
四面体形
sp杂化,直线形
sp2杂化,平面三角形
sp3杂化,四面体形
预测分子结构
略去孤电子对
解释分子空间结构
利用VSEPR模型和杂化轨道理论推测粒子结构
孤电子对数
化学式
价层电子对数
σ键电子对数
VSEPR模型
中心原子
杂化类型
粒子的真实空间结构
SO2
H2S
SO3
NCl3
HCN
HClO
2
2
4
四面体形
sp3杂化
V形
1
2
3
平面三角形
sp2杂化
V形
0
3
3
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
2
2
直线形
sp杂化
直线形
2
2
4
四面体形
sp3杂化
V形
利用VSEPR模型和杂化轨道理论推测粒子结构
孤电子对数
化学式
价层电子对数
σ键电子对数
VSEPR模型
中心原子
杂化类型
粒子的真实空间结构
SO42-
NO3-
PO43-
ClO3-
H3O+
0
4
4
四面体形
sp3杂化
正四面体形
0
3
3
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
3
3
CO32-
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
4
4
四面体形
sp3杂化
正四面体形
①价电子对之间的夹角越小,排斥力越小。 ( )
②NH3分子的VSEPR模型与分子空间结构不一致。( )
③五原子分子的空间结构都是正四面体形。( )
④杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
⑤凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
⑥凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
1.判断正误
C
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
3、在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
A
杂化轨道理论
第二章 分子结构与性质
我们已经知道,甲烷分子的空间结构呈_________,它的4个C-H的键长_____,键角皆为_____。
按照价键理论,甲烷的4个C-H单键都应该是____。
σ键
正四面体形
相同
109°28′
成键电子中,C、H原子提供的是哪个轨道上的电子?
C
价层电子轨道表示式
2s
2p
H
价层电子轨道表示式
1s
按照价键理论应该形成CH2,为什么最终形成的是CH4呢?
1、了解杂化轨道理论的要点和类型;
2、能运用杂化轨道理论解释简单共价分子和离子的空间结构。
外界条件下,能量相近的原子轨道混杂起来,重新组合新轨道的过程叫做原子轨道的杂化,杂化后的新轨道就称为杂化轨道。
为解决这一矛盾, 1931年鲍林在价键理论的基础上提出了杂化轨道理论,它实际上仍属于现代价键理论。
杂化轨道理论简介
莱纳斯·卡尔·鲍林
(1901年2月28日-1994年8月19日) 美国著名化学家,两获诺贝尔奖
一、杂化轨道形成及其特点
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子
中的一个
与激发电子临近
能量相近的原子轨道
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
只有在形成化学键时才会杂化!
单独的原子不会发生杂化。
常是同一能层或相近能级的原子轨道
甲烷的形成
2s 2p
↑↓
↑
↑
2s 2p
↑
↑
↑
↑
sp3
↑
↑
↑
↑
跃迁
杂化
基态
激发态
杂化轨道
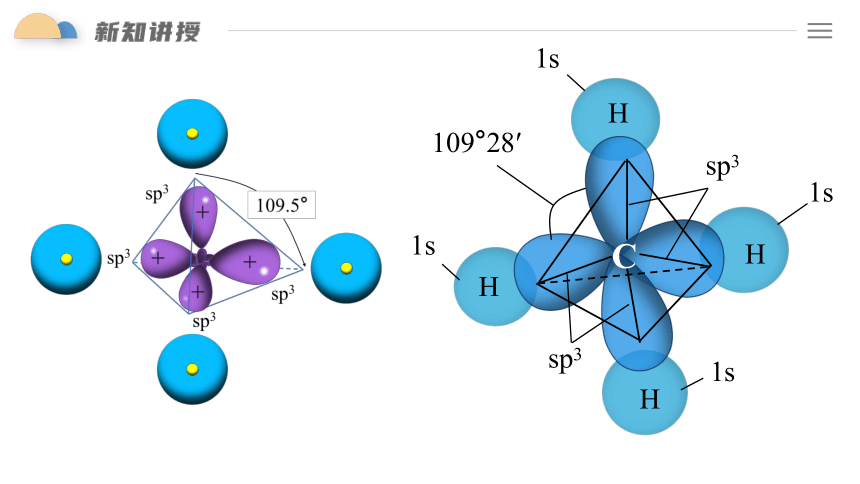
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型
正四面体
H
1s
H
1s
H
1s
H
1s
C
sp3
sp3
109°28′
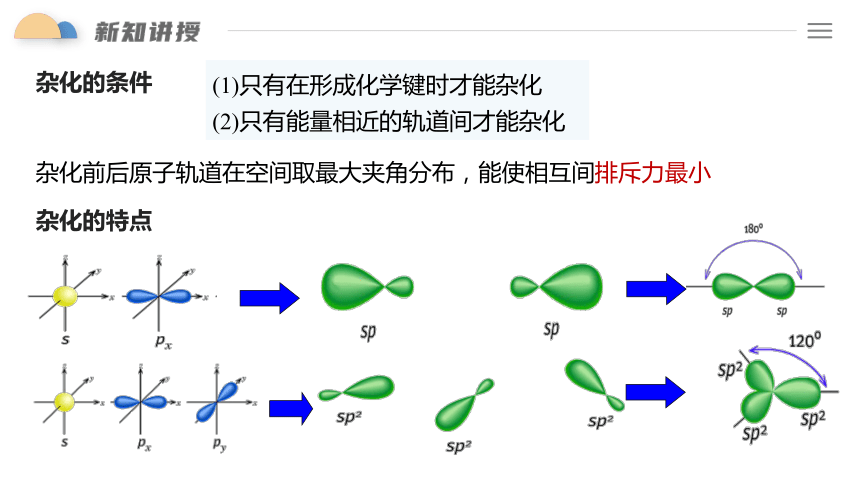
杂化的条件
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
杂化的特点
杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小
杂化的特点
未参与杂化的p轨道可用于形成π键。
(1)杂化前后轨道数不变
(2)杂化过程中轨道的形状发生变化
(4)杂化后的新轨道能量、形状都相同
(6)杂化轨道只用于形成σ键和容纳孤电子对
(3)杂化后形成的化学键更稳定
(5)杂化后的轨道之间尽可能远离
杂化轨道的类型
(1) sp3杂化轨道
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化轨道是由1个ns轨道和3个np轨道杂化而得。sp3杂化轨道的夹角为109°28′,呈空间正四面体形(如CH4、CF4、CCl4)。
sp3杂化轨道特征:
①1个ns 轨道与3个np 轨道进行的杂化,形成4个sp3 杂化轨道。
②每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分。
③每两个轨道间的夹角为109 28′,空间构型为正四面体形。
H原子
↑
s
1s1
3个N-H相互垂直
键角为90°
↑
s
3个N-H,键角为107°
N原子
↑↓
s
p
p
p
↑
↑
↑
2s22p3
基态
sp3
↑↓
↑
↑
↑
杂化轨道
【思考】怎么用杂化轨道理论解释NH3的空间结构呢?
孤电子对
sp3杂化
形成σ键
【思考】怎么用杂化轨道理论解释H2O的空间结构呢?
H原子
↑
s
1s1
2个O-H相互垂直
键角为90°
sp3杂化
↑
s
2个O-H,键角为105°
O原子
↑↓
s
p
p
p
↑↓
↑
↑
2s22p4
基态
sp3
↑↓
↑↓
↑
↑
杂化轨道
孤电子对
形成σ键
(2) sp2杂化轨道
x
y
z
z
x
y
z
x
y
z
x
y
z
120°
sp2杂化轨道是由1个ns轨道和2个np轨道杂化而得。sp2杂化轨道间的夹角为120°,呈平面三角形(如BF3)。
未参与杂化的p轨道可用于形成π键。
②每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分。
sp2杂化轨道特征:
①1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
③每两个轨道间的夹角为120°,呈平面三角形。
④ 3个sp2杂化轨道用于形成σ键,未参与杂化的p轨道用于形成π键。
p
sp2
sp2
sp2
分析BF3的中心原子杂化方式。
1个B-F
3个B-F,键角为120°
B原子
↑↓
s
p
p
p
↑
2s22p1
基态
形成σ键
sp2杂化
sp2
↑
↑
↑
杂化轨道
p
F原子
2s22p5
↑↓
s
p
p
p
↑↓
↑↓
↑
↑↓
s
p
p
p
↑↓
↑↓
↑
未杂化轨道
思考与讨论
C原子的2个sp2杂化轨道分别与2个H原子的1S轨道形成2个s-sp2σ键,另一个sp2杂化轨道与另一个C原子的sp2杂化轨道头碰头形成1个σ键。两个C剩余未参与杂化的2p轨道肩并肩形成π键
如何用杂化轨道理论解释CH2=CH2的空间结构呢?
注意:有机物中形成双键的碳原子均为sp2杂化
2s
2p
↑↓
↑
↑
激发
2s
2p
↑
↑
↑
↑
↑
↑
↑
↑
杂化
2p
sp2
头碰头
σ键
肩并肩
肩并肩
σ键
π键
H
H
H
H
乙烯中sp2杂化C原子成键过程
CH2=CH2
(3) sp杂化轨道
x
y
z
x
y
z
z
x
y
z
x
y
z
sp杂化轨道是由1个ns轨道和1个np轨道杂化而得。sp杂化轨道间的夹角为180°,呈直线形(如BeCl2)。分子的空间结构主要取决于原子轨道的杂化类型。
180°
②每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分。
①1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
sp杂化轨道特征:
③两个轨道间的夹角为180°,呈直线型。
④ 2个sp杂化轨道用于形成σ键,未参与杂化的2个p轨道用于形成2个π键。
p
p
sp
sp
分析BeCl2的中心原子杂化方式。
不能形成Be-Cl
2个Be-Cl,键角为180°
Be原子
↑↓
s
p
p
p
2s2
基态
sp
↑
↑
杂化轨道
形成σ键
sp杂化
Cl原子
3s23p5
↑↓
s
p
p
p
↑↓
↑↓
↑
↑↓
s
p
p
p
↑↓
↑↓
↑
p
p
未杂化轨道
思考与讨论
如何用杂化轨道理论解释CH≡CH的空间结构呢?
↑
↑
2s
2p
↑↓
↑
↑
激发
2s
2p
↑
↑
↑
↑
↑
↑
杂化
2p
sp
两个碳原子的1个sp杂化轨道相互重叠形成sp-sp σ键,另外1个杂化轨道与氢原子1s轨道重叠形成两个s-sp σ键,未参与杂化的2个2P轨道相互重叠形成2个π键。
注意:有机物中形成三键的碳原子均为sp杂化
头碰头
σ键
肩并肩
肩并肩
σ键
H
H
乙炔中sp杂化C原子成键过程
π键
π键
CH CH
杂化类型的判断
①因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:中心原子的杂化轨道数=价层电子对数=σ键电子对数(中心原子结合的电子数)+孤电子对数,再由杂化轨道数判断杂化类型。
中心原子的
价层电子对数
规律:
代表物 杂化轨道数 杂化轨道类型
CO2
CH2O
SO2
H2O
0+2=2
sp
0+3=3
sp2
1+2=3
2+2=4
sp2
sp3
2
3
4
sp
sp2
sp3
②通过看中心原子有没有形成双键或三键来判断
若有1个三键或2个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化;
若有1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化;
若全部是单键,则形成sp3杂化。
③根据杂化轨道之间的夹角判断
④根据杂化轨道的立体构型判断
杂化轨道
之间的夹角
180°
120°
109°28′
sp
sp2
sp3
杂化轨道
的立体构型
直线形
平面三角形
正四面体形或三角锥形
sp
sp2
sp3
→杂化理论和VSEPR模型预测粒子空间结构结果基本一致
价层电子对
互斥模型
杂化轨
道理论
计算价层
电子对数
价层电子对数=σ 键电子对数+中心原子孤电子对数
2
3
4
直线形
平面三角形
四面体形
sp杂化,直线形
sp2杂化,平面三角形
sp3杂化,四面体形
预测分子结构
略去孤电子对
解释分子空间结构
利用VSEPR模型和杂化轨道理论推测粒子结构
孤电子对数
化学式
价层电子对数
σ键电子对数
VSEPR模型
中心原子
杂化类型
粒子的真实空间结构
SO2
H2S
SO3
NCl3
HCN
HClO
2
2
4
四面体形
sp3杂化
V形
1
2
3
平面三角形
sp2杂化
V形
0
3
3
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
2
2
直线形
sp杂化
直线形
2
2
4
四面体形
sp3杂化
V形
利用VSEPR模型和杂化轨道理论推测粒子结构
孤电子对数
化学式
价层电子对数
σ键电子对数
VSEPR模型
中心原子
杂化类型
粒子的真实空间结构
SO42-
NO3-
PO43-
ClO3-
H3O+
0
4
4
四面体形
sp3杂化
正四面体形
0
3
3
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
3
3
CO32-
平面正三角形
sp2杂化
平面正三角形
1
3
4
四面体形
sp3杂化
三角锥形
0
4
4
四面体形
sp3杂化
正四面体形
①价电子对之间的夹角越小,排斥力越小。 ( )
②NH3分子的VSEPR模型与分子空间结构不一致。( )
③五原子分子的空间结构都是正四面体形。( )
④杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。( )
⑤凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形。( )
⑥凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。( )
1.判断正误
C
2.在BrCH=CHBr分子中,C—Br键采用的成键轨道是( )
A.sp-p B.sp2-s
C.sp2-p D.sp3-p
3、在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键
D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键
A
