2.3 课时1 共价键的极性 课件(共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时1 共价键的极性 课件(共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:40:04 | ||
图片预览





文档简介
(共24张PPT)
共价键的极性
第二章 分子结构与性质
1.认识键的极性与分子极性的联系。
2.掌握判断键的极性以及分子极性的方法,熟悉常见分子的极性 。
3.了解键的极性对化学性质的影响,掌握有机酸酸性的影响因素及判断方法。
1、什么是共价键和电负性?
共价键:相邻原子之间通过共用电子对形成强烈的相互作用力。
电负性:用来描述不同元素的原子对键合电子吸引力的大小。
2、写出H2、Cl2、N2、HCl的电子式。
H
H
Cl
Cl
N
N
H
Cl
3、由相同或不同原子形成的共价键,电子对是否会发生偏移
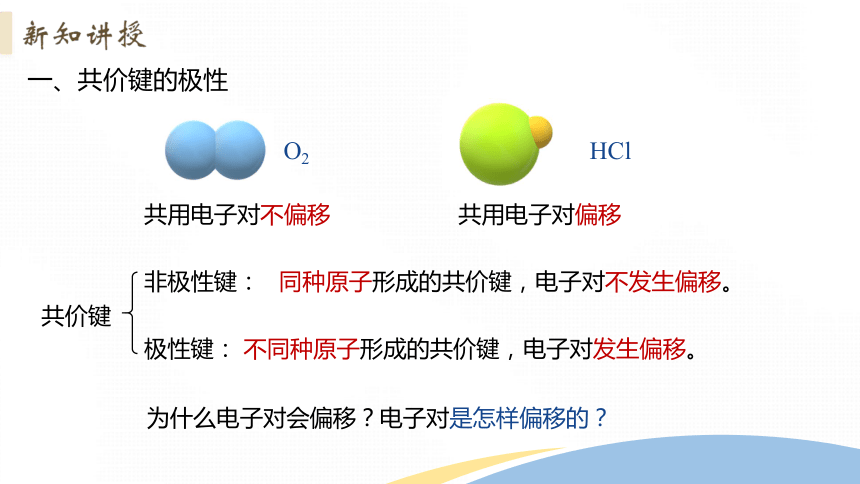
一、共价键的极性
O2
HCl
共用电子对不偏移
共用电子对偏移
共价键
非极性键:
极性键:
同种原子形成的共价键,电子对不发生偏移。
不同种原子形成的共价键,电子对发生偏移。
为什么电子对会偏移?电子对是怎样偏移的?
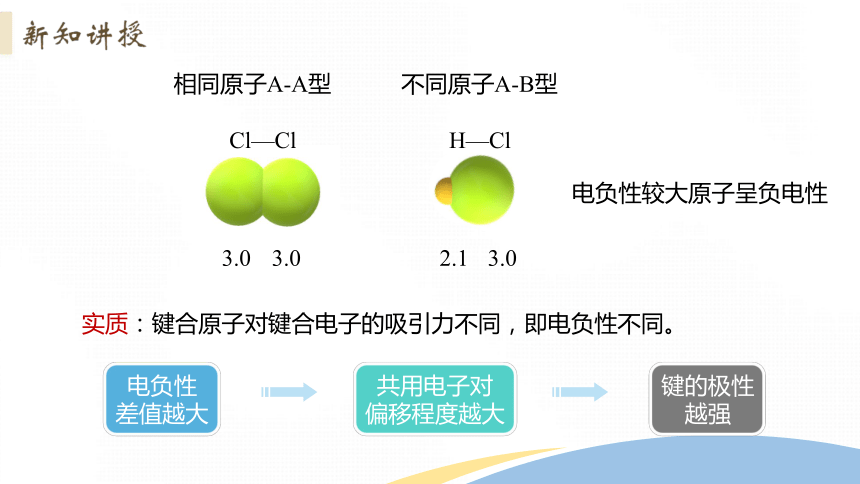
3.0
3.0
3.0
2.1
Cl—Cl
H—Cl
实质:键合原子对键合电子的吸引力不同,即电负性不同。
相同原子A-A型
不同原子A-B型
电负性较大原子呈负电性
电负性
差值越大
共用电子对
偏移程度越大
键的极性
越强
指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
极性键和非极性键
非极性键
极性键
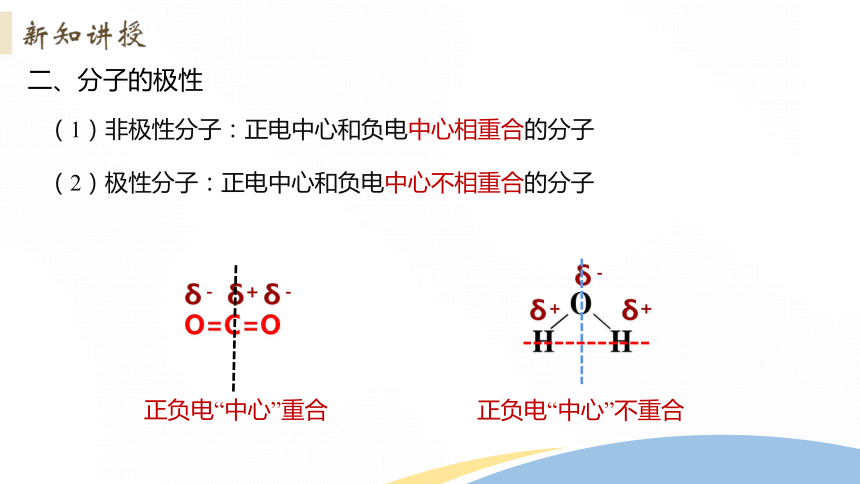
二、分子的极性
(1)非极性分子:正电中心和负电中心相重合的分子
(2)极性分子:正电中心和负电中心不相重合的分子
O=C=O
δ+
δ-
δ-
正负电“中心”重合
δ+
δ+
δ-
正负电“中心”不重合
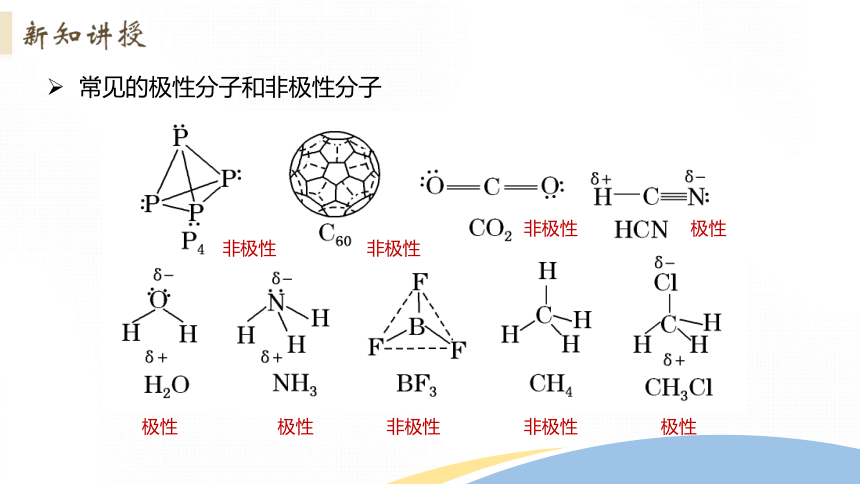
常见的极性分子和非极性分子
非极性
非极性
非极性
极性
极性
极性
非极性
非极性
极性
分子极性的判断方法
方法一:根据正电中心和负电中心是否重合来判断:
若正电中心和负电中心不重合
—极性分子
若正电中心和负电中心重合
—非极性分子
分子极性的判断方法
若分子中各个键的极性的向量和等于零, 则为非极性分子(极性抵消)
若分子中各个键的极性的向量和不等于零, 则为极性分子(极性不抵消)
方法二:根据化学键的极性的向量和是否为0来判断:
CO2是直线形、结构对称,两个C=O的极性互相抵消,所以整个分子没有极性,电荷分布均匀,是非极性分子。
δ+
δ-
δ-
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
平面三角形,结构对称,键的极性互相抵消 ,是非极性分子
正四面体形 ,结构对称,键的极性互相抵消,是非极性分子
若各个键的极性的向量和等于零(分子空间结构对称),为非极性分子。
δ+
δ-
δ+
δ-
δ+
δ+
δ-
δ-
δ+
δ+
δ+
若各个键的极性的向量和不等于零(分子空间结构不对称),则为极性分子。
O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消,整个分子电荷分布不均匀,是极性分子。
三角锥形, 不对称分子,键的极性不能抵消,是极性分子。
105
107
分子极性的判断方法
若对称,则为非极性分子
若不对称,则为极性分子
直线形
平面正三角形
正四面体
V形
三角锥形
四面体
空间结构
HCN是极性分子
分子极性的判断方法
方法三:根据分子中心原子有无孤电子对来判断来判断:
若中心原子有孤电子对或无孤电子对但键长不同,则为极性分子。
多原子分子
(原子数≥3)
若中心原子无孤电子对且键长均相等,为非极性分子;
如:CH4
如: NH3 ( 有孤电子对) 、
CH3CI(无孤电子对但键长不同)
分子极性的判断方法
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
如:
方法四:根据中心原子的化合价来判断
对于ABn型分子
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
中心原子化合价的绝对值
该元素的价电子数
该分子为极性分子
≠
1.只含有非极性键的双原子分子或多原子分子大多是非极性分子。
2.含有极性键的双原子分子都是极性分子。
3.含有极性键的多原子分子,空间构型对称的是非极性分子;空间构型不对称的是极性分子。
4.判断ABn型分子极性的经验规律:
若中心原子A的化合价的绝对值等于该元素所在的主族序数(价电子数),则为非极性分子;若不等,则为极性分子。
若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
H2 O2、 Cl2 是非极性分子;HCl是极性分子
都是非极性分子
CO2、BF3、CH4都是非极性分子,HCN、H2O、NH3、CH3Cl都是极性分子
O3
H2O2
1、O3分子中的共价键是极性键,是V形分子,其空间结构不对称,故O3为极性分子。
δ+
δ-
δ-
2、H2O2分子不是直线形分子,两个H原子犹如在半展开的书的两面上,即空间结构不对称,为极性分子。
补充
科学 技术 社会
表面活性剂的去污原理
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
表面活性剂:
有机分子,一端有极性(亲水基团),另一端非极性(疏水基团)
科学 技术 社会
细胞膜是双分子膜,为什么双分子膜以头向外而尾向内的方式排列?
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团,尾基是非极性基 。
三、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
三、键的极性对化学性质的影响
1. CF3COOH的酸性大于CCl3COOH,解释原因。
由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
三、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
同理,由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸羧基中的羟基的极性最大,更易电离出氢离子 。
三、键的极性对化学性质的影响
2. 为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烷基是推电子基团,即将电子推向羟基,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烷基加长,酸性的差异越来越小。
共价键的极性
第二章 分子结构与性质
1.认识键的极性与分子极性的联系。
2.掌握判断键的极性以及分子极性的方法,熟悉常见分子的极性 。
3.了解键的极性对化学性质的影响,掌握有机酸酸性的影响因素及判断方法。
1、什么是共价键和电负性?
共价键:相邻原子之间通过共用电子对形成强烈的相互作用力。
电负性:用来描述不同元素的原子对键合电子吸引力的大小。
2、写出H2、Cl2、N2、HCl的电子式。
H
H
Cl
Cl
N
N
H
Cl
3、由相同或不同原子形成的共价键,电子对是否会发生偏移
一、共价键的极性
O2
HCl
共用电子对不偏移
共用电子对偏移
共价键
非极性键:
极性键:
同种原子形成的共价键,电子对不发生偏移。
不同种原子形成的共价键,电子对发生偏移。
为什么电子对会偏移?电子对是怎样偏移的?
3.0
3.0
3.0
2.1
Cl—Cl
H—Cl
实质:键合原子对键合电子的吸引力不同,即电负性不同。
相同原子A-A型
不同原子A-B型
电负性较大原子呈负电性
电负性
差值越大
共用电子对
偏移程度越大
键的极性
越强
指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
极性键和非极性键
非极性键
极性键
二、分子的极性
(1)非极性分子:正电中心和负电中心相重合的分子
(2)极性分子:正电中心和负电中心不相重合的分子
O=C=O
δ+
δ-
δ-
正负电“中心”重合
δ+
δ+
δ-
正负电“中心”不重合
常见的极性分子和非极性分子
非极性
非极性
非极性
极性
极性
极性
非极性
非极性
极性
分子极性的判断方法
方法一:根据正电中心和负电中心是否重合来判断:
若正电中心和负电中心不重合
—极性分子
若正电中心和负电中心重合
—非极性分子
分子极性的判断方法
若分子中各个键的极性的向量和等于零, 则为非极性分子(极性抵消)
若分子中各个键的极性的向量和不等于零, 则为极性分子(极性不抵消)
方法二:根据化学键的极性的向量和是否为0来判断:
CO2是直线形、结构对称,两个C=O的极性互相抵消,所以整个分子没有极性,电荷分布均匀,是非极性分子。
δ+
δ-
δ-
δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
平面三角形,结构对称,键的极性互相抵消 ,是非极性分子
正四面体形 ,结构对称,键的极性互相抵消,是非极性分子
若各个键的极性的向量和等于零(分子空间结构对称),为非极性分子。
δ+
δ-
δ+
δ-
δ+
δ+
δ-
δ-
δ+
δ+
δ+
若各个键的极性的向量和不等于零(分子空间结构不对称),则为极性分子。
O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消,整个分子电荷分布不均匀,是极性分子。
三角锥形, 不对称分子,键的极性不能抵消,是极性分子。
105
107
分子极性的判断方法
若对称,则为非极性分子
若不对称,则为极性分子
直线形
平面正三角形
正四面体
V形
三角锥形
四面体
空间结构
HCN是极性分子
分子极性的判断方法
方法三:根据分子中心原子有无孤电子对来判断来判断:
若中心原子有孤电子对或无孤电子对但键长不同,则为极性分子。
多原子分子
(原子数≥3)
若中心原子无孤电子对且键长均相等,为非极性分子;
如:CH4
如: NH3 ( 有孤电子对) 、
CH3CI(无孤电子对但键长不同)
分子极性的判断方法
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
如:
方法四:根据中心原子的化合价来判断
对于ABn型分子
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
中心原子化合价的绝对值
该元素的价电子数
该分子为极性分子
≠
1.只含有非极性键的双原子分子或多原子分子大多是非极性分子。
2.含有极性键的双原子分子都是极性分子。
3.含有极性键的多原子分子,空间构型对称的是非极性分子;空间构型不对称的是极性分子。
4.判断ABn型分子极性的经验规律:
若中心原子A的化合价的绝对值等于该元素所在的主族序数(价电子数),则为非极性分子;若不等,则为极性分子。
若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。
H2 O2、 Cl2 是非极性分子;HCl是极性分子
都是非极性分子
CO2、BF3、CH4都是非极性分子,HCN、H2O、NH3、CH3Cl都是极性分子
O3
H2O2
1、O3分子中的共价键是极性键,是V形分子,其空间结构不对称,故O3为极性分子。
δ+
δ-
δ-
2、H2O2分子不是直线形分子,两个H原子犹如在半展开的书的两面上,即空间结构不对称,为极性分子。
补充
科学 技术 社会
表面活性剂的去污原理
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
表面活性剂:
有机分子,一端有极性(亲水基团),另一端非极性(疏水基团)
科学 技术 社会
细胞膜是双分子膜,为什么双分子膜以头向外而尾向内的方式排列?
细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团,尾基是非极性基 。
三、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
三、键的极性对化学性质的影响
1. CF3COOH的酸性大于CCl3COOH,解释原因。
由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
三、键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
同理,由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸羧基中的羟基的极性最大,更易电离出氢离子 。
三、键的极性对化学性质的影响
2. 为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烷基是推电子基团,即将电子推向羟基,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烷基加长,酸性的差异越来越小。
