2.2 课时2 杂化轨道理论 课件(共21张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2 课时2 杂化轨道理论 课件(共21张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |
|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 00:00:00 | ||
图片预览




文档简介
(共21张PPT)
杂化轨道理论
第二章 分子结构与性质
1、了解杂化轨道理论的要点和类型;
2、能运用杂化轨道理论解释简单共价分子和离子的空间结构。
画出基态碳原子、氢原子的核外电子排布图
C原子
1s2
2s2
2p2
H原子
1s1
思考:为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
↑
↑
↑
↑
跃迁
思考:为何分子空间结构是正四面体形?
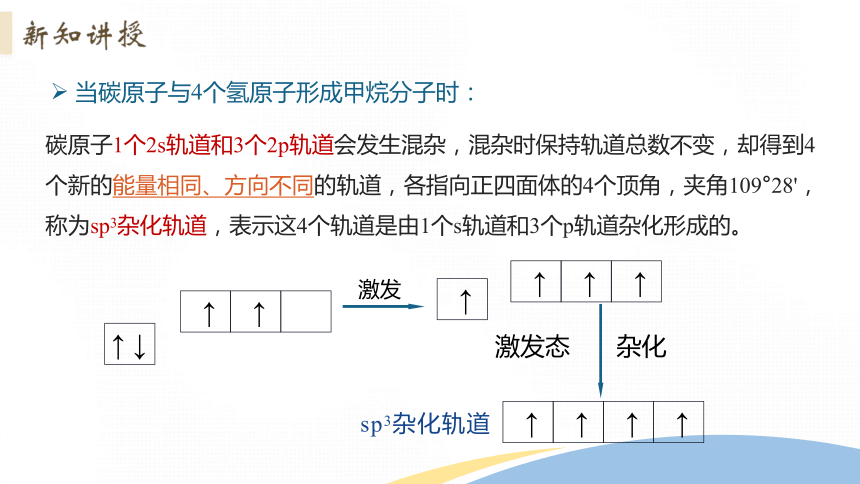
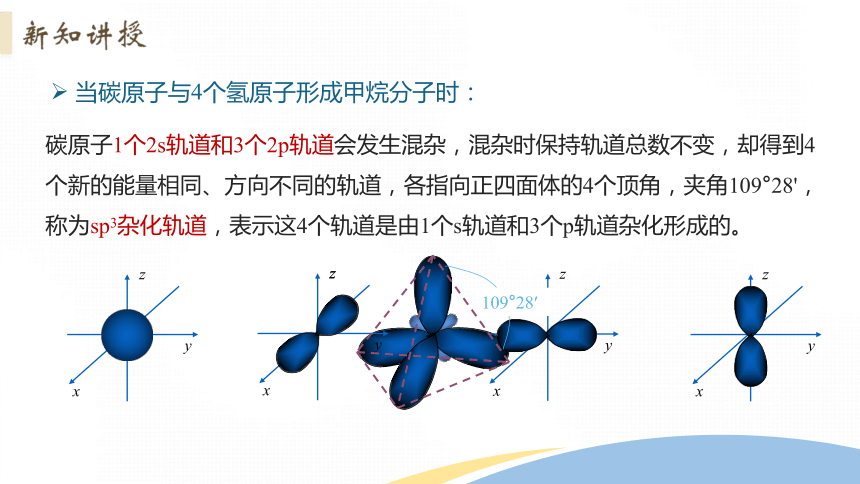
当碳原子与4个氢原子形成甲烷分子时:
sp3杂化轨道
↑ ↓
↑
↑
激发
↑
↑
↑
↑
激发态
杂化
↑
↑
↑
↑
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
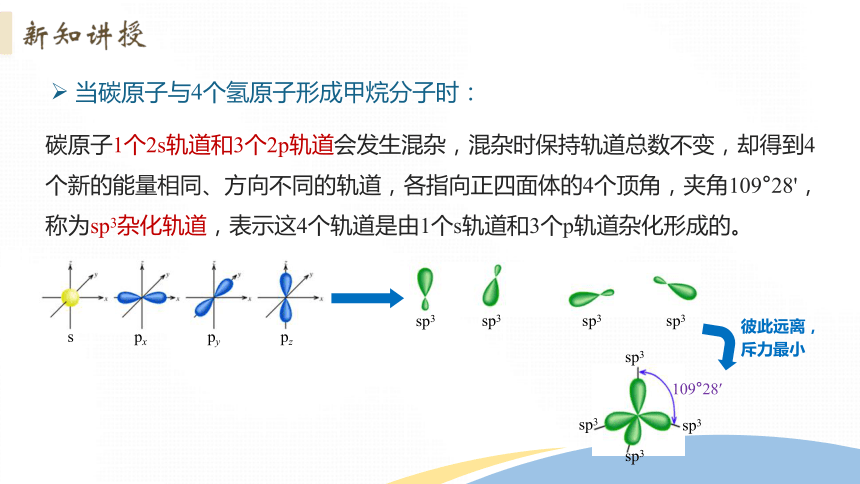
当碳原子与4个氢原子形成甲烷分子时:
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
彼此远离,
斥力最小
s px py pz
sp3
sp3
sp3
sp3
sp3
sp3
sp3
sp3
109°28′
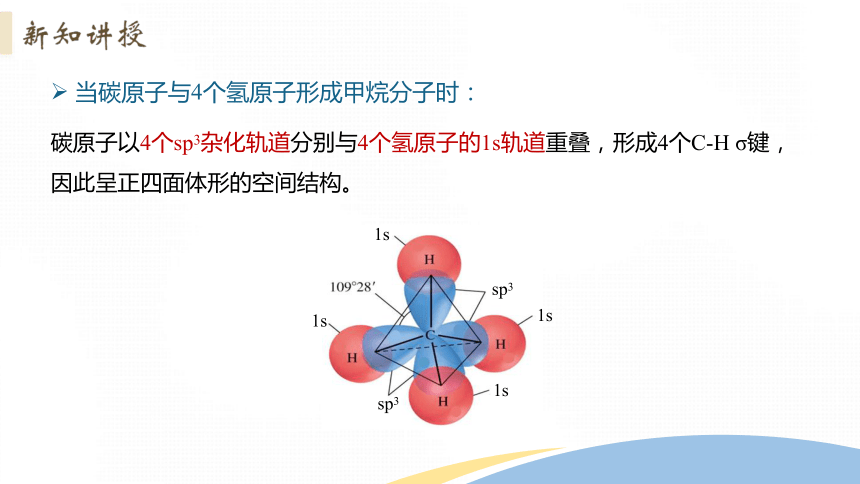
当碳原子与4个氢原子形成甲烷分子时:
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
sp3
sp3
1s
1s
1s
1s
当碳原子与4个氢原子形成甲烷分子时:
一、原子轨道的杂化
(1)在形成分子(化学键)时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组能量相同、方向不同的新轨道的过程。
(2)原子轨道组合杂化后形成的一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
美国化学家鲍林
【思考】BF3是平面三角形构型, 分子中键角均为120o;试用杂化轨道理论加以说明。
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
杂化
↑
↑
↑
未杂化轨道
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
【思考】气态BeCl2是直线型分子构型,分子中键角为180o 。试用杂化轨道理论加以说明。
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。2个sp杂化轨道在一条直线上,轨道间夹角180°
(3)杂化轨道的特点
杂化前后轨道数目不变
杂化后轨道成分、能量、形状、方向发生改变
杂化轨道之间要满足最小排斥、最大夹角原理
杂化轨道只容纳孤电子对和形成σ键
未参与杂化的p轨道可用于形成π键
杂化轨道数目=孤电子对数+σ键数=价层电子对数
即:
能量相近
数目不变
形状方向改变
成键能力增强
排斥力达最小
2s
2p
C的基态
2s
2p
激发态
sp2
sp2 杂化态
激发
杂化
pz
乙烯分子中碳原子的杂化方式及成键过程
120°
四个s-sp2 C-H σ键
1个sp2-sp2 C-C σ键
1个p-p C-C π键
乙炔分子中碳原子的杂化方式及成键过程
2s
2p
C的基态
2s
2p
激发态
sp
sp 杂化态
激发
杂化
pz
py
π键
π键
σ键
2个s-sp C-H σ键
1个sp-sp σ键
2个p-p π键
(4)杂化类型的判断
①杂化轨道数=中心原子的价层电子对数
sp3
sp2
sp
4
3
2
中心原子的价层电子对数
杂化方式
杂化轨道数
4
3
2
化学式 中心原子 孤电子对数 中心原子结合的原子数 VSEPR模型 中心原子杂化类型
HCN
SO2
NH2-
BF3
H3O+
SiCl4
CHCl3
NH4+
SO42-
sp
0
1
2
0
1
0
0
0
2
2
2
3
3
4
4
4
0
4
直线形
平面三角形
平面三角形
四面体形
四面体形
四面体形
四面体形
四面体形
四面体形
sp2
sp2
sp3
sp3
sp3
sp3
sp3
sp3
(4)杂化类型的判断
②根据分子空间构型
四面体形
sp3
sp2
sp
三角锥形
平面三角形
V形
直线形
sp3或
sp2
sp3
(4)杂化类型的判断
③碳原子杂化方式的判断
碳原子在化合物中一般形成4对共用电子对,无孤电子对
C
sp3
C
sp2
C
C
或
sp
1
2
3
4
5
6
7
8
9
其他的杂化方式
SF6
sp3d2杂化
正八面体形
价层电子对数:5
价层电子对数:6
PCl5
sp3d杂化
三角双锥形
1.VSEPR模型呈四面体形的分子中心原子一般采取sp3杂化,如H2O和NH3,试用杂化轨道理论解释H2O和NH3分子的空间结构。
H2O和NH3分子中心原子都采取sp3杂化,水分子的氧原子的sp3杂化轨道有2个被孤电子对占据,分子空间结构呈V形,氨分子的氮原子的sp3杂化轨道中有1个被孤电子对占据,分子空间结构呈三角锥形,孤电子对对成键电子的排斥力大于成键电子对之间的排斥力,所以键角小于109°28′。
1.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
2.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
A
3.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )
A.CH≡CH B.CO2
C.BeCl2 D.BF3
C
4.下列有关甲醛(HCHO)分子的说法正确的是( )
①C原子采取sp杂化 ②甲醛分子为三角锥形结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A.①② B.②③
C.③④ D.①④
C
杂化轨道理论
第二章 分子结构与性质
1、了解杂化轨道理论的要点和类型;
2、能运用杂化轨道理论解释简单共价分子和离子的空间结构。
画出基态碳原子、氢原子的核外电子排布图
C原子
1s2
2s2
2p2
H原子
1s1
思考:为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
↑
↑
↑
↑
跃迁
思考:为何分子空间结构是正四面体形?
当碳原子与4个氢原子形成甲烷分子时:
sp3杂化轨道
↑ ↓
↑
↑
激发
↑
↑
↑
↑
激发态
杂化
↑
↑
↑
↑
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当碳原子与4个氢原子形成甲烷分子时:
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
彼此远离,
斥力最小
s px py pz
sp3
sp3
sp3
sp3
sp3
sp3
sp3
sp3
109°28′
当碳原子与4个氢原子形成甲烷分子时:
碳原子1个2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28',称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
sp3
sp3
1s
1s
1s
1s
当碳原子与4个氢原子形成甲烷分子时:
一、原子轨道的杂化
(1)在形成分子(化学键)时,由于原子的相互影响,若干不同类型能量相近的原子轨道混合起来,重新组合成一组能量相同、方向不同的新轨道的过程。
(2)原子轨道组合杂化后形成的一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
美国化学家鲍林
【思考】BF3是平面三角形构型, 分子中键角均为120o;试用杂化轨道理论加以说明。
2s
2p
↑↓
↑
基态
激发
2s
2p
↑
↑
激发态
↑
杂化
↑
↑
↑
未杂化轨道
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
【思考】气态BeCl2是直线型分子构型,分子中键角为180o 。试用杂化轨道理论加以说明。
2s
2p
↑↓
基态
激发
2s
2p
↑
↑
激发态
杂化
sp杂化轨道
↑
↑
未杂化轨道
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。2个sp杂化轨道在一条直线上,轨道间夹角180°
(3)杂化轨道的特点
杂化前后轨道数目不变
杂化后轨道成分、能量、形状、方向发生改变
杂化轨道之间要满足最小排斥、最大夹角原理
杂化轨道只容纳孤电子对和形成σ键
未参与杂化的p轨道可用于形成π键
杂化轨道数目=孤电子对数+σ键数=价层电子对数
即:
能量相近
数目不变
形状方向改变
成键能力增强
排斥力达最小
2s
2p
C的基态
2s
2p
激发态
sp2
sp2 杂化态
激发
杂化
pz
乙烯分子中碳原子的杂化方式及成键过程
120°
四个s-sp2 C-H σ键
1个sp2-sp2 C-C σ键
1个p-p C-C π键
乙炔分子中碳原子的杂化方式及成键过程
2s
2p
C的基态
2s
2p
激发态
sp
sp 杂化态
激发
杂化
pz
py
π键
π键
σ键
2个s-sp C-H σ键
1个sp-sp σ键
2个p-p π键
(4)杂化类型的判断
①杂化轨道数=中心原子的价层电子对数
sp3
sp2
sp
4
3
2
中心原子的价层电子对数
杂化方式
杂化轨道数
4
3
2
化学式 中心原子 孤电子对数 中心原子结合的原子数 VSEPR模型 中心原子杂化类型
HCN
SO2
NH2-
BF3
H3O+
SiCl4
CHCl3
NH4+
SO42-
sp
0
1
2
0
1
0
0
0
2
2
2
3
3
4
4
4
0
4
直线形
平面三角形
平面三角形
四面体形
四面体形
四面体形
四面体形
四面体形
四面体形
sp2
sp2
sp3
sp3
sp3
sp3
sp3
sp3
(4)杂化类型的判断
②根据分子空间构型
四面体形
sp3
sp2
sp
三角锥形
平面三角形
V形
直线形
sp3或
sp2
sp3
(4)杂化类型的判断
③碳原子杂化方式的判断
碳原子在化合物中一般形成4对共用电子对,无孤电子对
C
sp3
C
sp2
C
C
或
sp
1
2
3
4
5
6
7
8
9
其他的杂化方式
SF6
sp3d2杂化
正八面体形
价层电子对数:5
价层电子对数:6
PCl5
sp3d杂化
三角双锥形
1.VSEPR模型呈四面体形的分子中心原子一般采取sp3杂化,如H2O和NH3,试用杂化轨道理论解释H2O和NH3分子的空间结构。
H2O和NH3分子中心原子都采取sp3杂化,水分子的氧原子的sp3杂化轨道有2个被孤电子对占据,分子空间结构呈V形,氨分子的氮原子的sp3杂化轨道中有1个被孤电子对占据,分子空间结构呈三角锥形,孤电子对对成键电子的排斥力大于成键电子对之间的排斥力,所以键角小于109°28′。
1.下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
B
2.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
A
3.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )
A.CH≡CH B.CO2
C.BeCl2 D.BF3
C
4.下列有关甲醛(HCHO)分子的说法正确的是( )
①C原子采取sp杂化 ②甲醛分子为三角锥形结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A.①② B.②③
C.③④ D.①④
C
