2.3 课时3 分子间作用力(范德华力 氢键) 课件 (共29张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时3 分子间作用力(范德华力 氢键) 课件 (共29张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:42:56 | ||
图片预览





文档简介
(共29张PPT)
分子间作用力
(范德华力 氢键)
第二章 分子结构与性质
1、认识分子间存在相互作用,知道范德华力是常见的分子间作用力。
2、能说明范德华力对物质熔点、沸点等性质的影响,形成“结构决定性质”的基本概念。
3、知道氢键是常见的分子间作用力,能说明氢键对物质熔点、沸点等性质的影响,能举例说明氢键对于生命的重大意义。
为什么下雪不冷,化雪冷呢?
雪融化现象是物理变化还是化学变化?
雪过程中有没有破坏其中的化学键?
冰雪
水
水蒸气
(固)
(液)
(气)
分子间距离增大
雪融化需要吸收热量;水变成水蒸气仍然需要吸收热量。
吸收的热量用于破坏某种分子间作用力,这说明水分子之间存在着相互作用力。
思考:吸收的热量去哪里了呢?
H2O (l)
H2O (g)
一、分子间作用力(范德华力)
(1)概念:分子间普遍存在作用力,这类分子间作用力称为范德华力
(2)本质:分子之间的静电作用
它使得许多物质能以一定的凝聚力(固态和液态)存在
(3)特征:①只存在于分子之间,分子充分接近(300~500pm)时才有范德华力
②范德华力很弱,比化学键的键能小1-2个数量级
③范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
1.范德华力及其对物质性质的影响
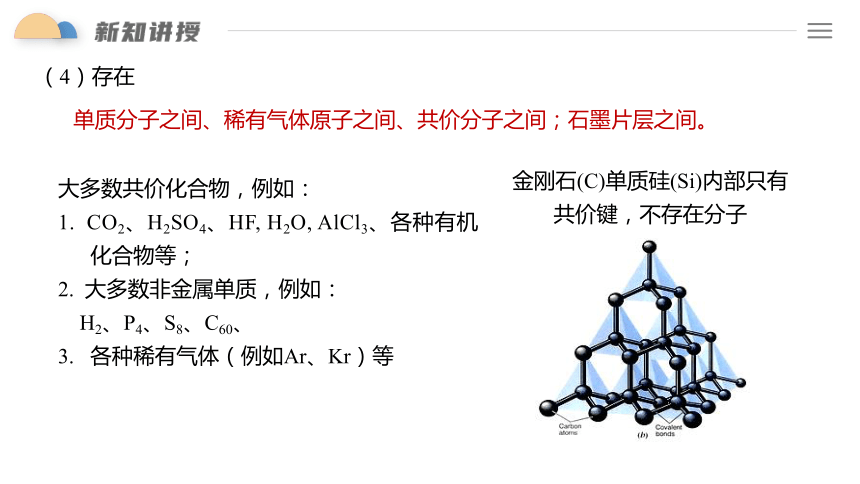
(4)存在
单质分子之间、稀有气体原子之间、共价分子之间;石墨片层之间。
金刚石(C)单质硅(Si)内部只有共价键,不存在分子
大多数共价化合物,例如:
1. CO2、H2SO4、HF, H2O, AlCl3、各种有机化合物等;
2. 大多数非金属单质,例如:
H2、P4、S8、C60、
3. 各种稀有气体(例如Ar、Kr)等
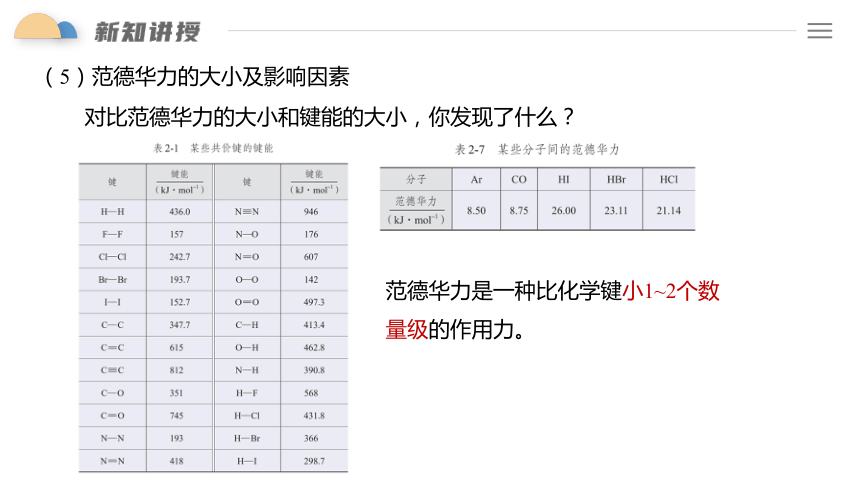
(5)范德华力的大小及影响因素
对比范德华力的大小和键能的大小,你发现了什么?
范德华力是一种比化学键小1~2个数量级的作用力。
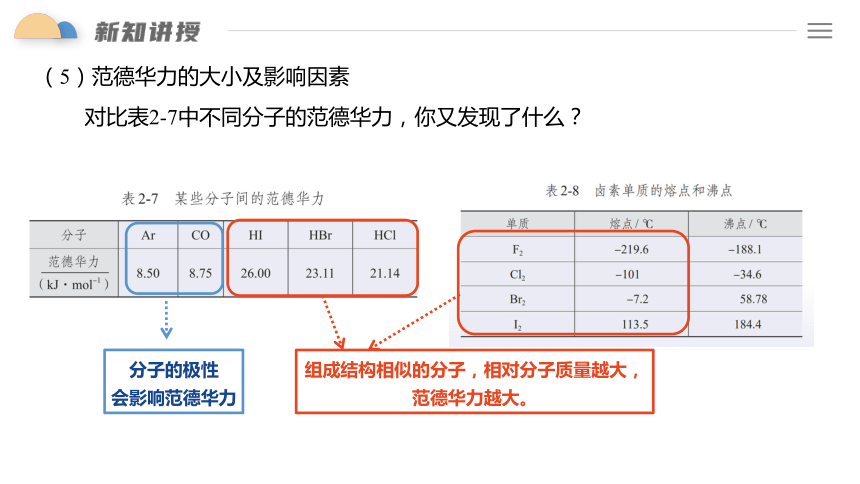
(5)范德华力的大小及影响因素
对比表2-7中不同分子的范德华力,你又发现了什么?
分子的极性
会影响范德华力
组成结构相似的分子,相对分子质量越大,
范德华力越大。
结论:一般,组成和性质相似的分子,相对分子质量越大,
范德华力越大,物质的熔、沸点越高。
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
【思考】怎样解释卤素单质从F2~I2的熔、沸点越来越高?
Cl2、Br2、I2的相对分子质量依次增大
范德华力依次增大
熔、沸点依次增大
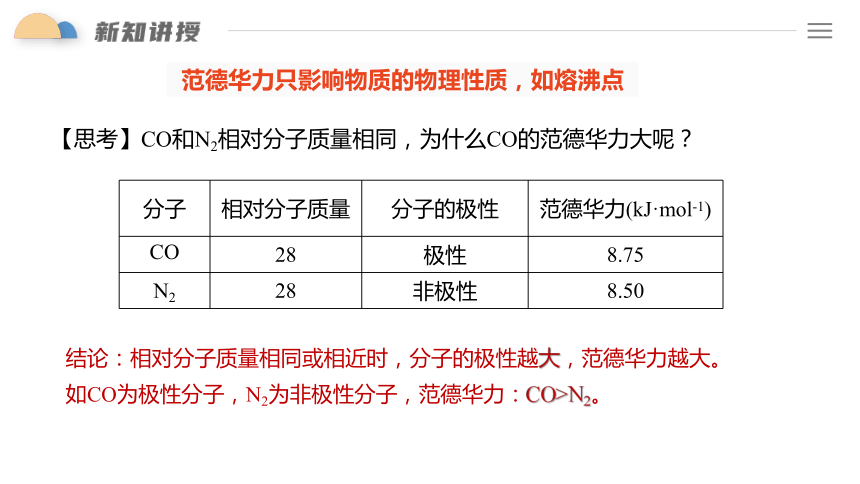
范德华力只影响物质的物理性质,如熔沸点
【思考】CO和N2相对分子质量相同,为什么CO的范德华力大呢?
范德华力只影响物质的物理性质,如熔沸点
结论:相对分子质量相同或相近时,分子的极性越大,范德华力越大。
如CO为极性分子,N2为非极性分子,范德华力:CO>N2。
分子 相对分子质量 分子的极性 范德华力(kJ·mol-1)
CO 28 极性 8.75
N2 28 非极性 8.50
【思考】正戊烷、异戊烷、新戊烷的相对分子质量相同,为什么熔沸点不同呢?
范德华力只影响物质的物理性质,如熔沸点
结论:互为同分异构体的分子,支链越多、越分散,分子间范德华力越弱,熔、沸点就越低
单质 相对分子质量 沸点/℃
正戊烷 72 36.1
异戊烷 72 28
新戊烷 72 10
物质的熔、沸点
越高
分子的极性
越大
相对分子质量越大
范德华力
越大
决定
决定
键能大小影响分子的热稳定性,范德华力的大小影响物质的熔沸点
1.范德华力是一种较弱的化学键( )
2.范德华力是分子间存在的较强的相互作用( )
3.范德华力直接影响所有物质的熔、沸点( )
4.稀有气体的分子间存在范德华力( )
5.冰融化时,分子中H—O键发生断裂( )
6.由于H—O键比H—S键牢固,所以H2O的熔沸点比H2S的高( )
7.在由分子构成的物质中,分子间作用力越大,该物质越稳定( )
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
对于同一主族非金属元素氢化物而言,从上到下,相对分子质量逐渐增大,范德华力逐渐增大,熔沸点逐渐升高。而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用。
这种作用力就是氢键。
一些氢化物的沸点
二、分子间作用力(氢键)
在水分子的O—H中,共用电子对强烈的偏向O,使H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中电负性很大的O的孤电子对产生静电作用,这种静电作用就是氢键。
静电吸引
氢键
电负性大
半径小
几乎成为“裸露”的质子
二、分子间作用力(氢键)
2.表示方法:氢键通常用 表示,其中X、Y为 ,“—”表示 ,“┅”表示形成的 。
1.概念:由已经与 _很大的原子形成共价键的_______(如水分子中的氢)与另一个 很大的原子(如水分子中的氧)之间的作用力。
电负性
氢原子
电负性
X-H┅Y-
共价键
氢键
N、O、F
①氢键不属于化学键:化学键>氢键>范德华力。
②分子有氢键就一定有范德华力,有范德华力不一定有氢键。
③与氢原子形成氢键时,电负性越大,氢键越强。
④分子间氢键会使物质熔、沸点大大增加。
⑤氢键具有一定的方向性和饱和性。
3.氢键特征:
饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
方向性:X—H···Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
氢键有键长、键能
*氢键键长一般定义为A—H···B的长度,而不是H···B的长度。
氢键比化学键的键能小1~2个数量级,但比范德华力强。
强度:化学键 > 氢键 > 范德华力
4.氢键分类
②分子内氢键(不属于分子间作用力)
① 分子间氢键(属于分子间作用力)
邻羟基苯甲醛
对羟基苯甲醛
如:H2O、NH3、HF、C2H5OH、
CH3COOH相互之间。
沸点:分子间氢键>分子内氢键
如: 当苯酚在邻位上有—CHO、—COOH、
—NO2和 —OH时,可形成分子内的氢键。
分子内氢键可以使分子更稳定。且分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
熔点115 ℃
沸点246.6℃
熔点2 ℃
沸点196.5℃
5.氢键的对物质性质的影响
(1)氢键对物质熔、沸点的影响
VA~VIA族元素的氢化物中,NH3、H2O和HF的熔沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
名称 相对分子质量 沸点/℃
甲醇 32 65
乙烷 30 -89
乙醇 46 78
丙烷 44 -42
正丙醇 60 97
正丁烷 58 -0.5
(2)氢键对物质密度的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml)
0.00 100.00 0.9998 1.0000
冰的密度比液体水小?
冰中一个水分子
周围有4个水分子
冰的结构
冰融化,分子间空隙减小
在冰中每个水分子被4个水分子包围形成变形的正四面体
一个水分子可形成二个氢键。因此1mol冰中有2mol氢键
常温下液态水中除了含有简单H2O外,还含有通过氢键联系在一起的缔合分子(H2O)2、(H2O)3……(H2O)n等。一个水分子的氧原子与另一个水分子的氢原子沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有H2O全部缔合——结冰后,所有的H2O按一定的方向全部形成了氢键,成为晶体,因此在冰的结构中形成许多空隙,体积膨胀,密度减小。故冰的体积大于等质量的水的体积,冰的密度小于水的密度。
思考与讨论
H2O、HF、NH3沸点依次降低的原因
已知固态H2O、HF、NH3的氢键键能和结构如下:
单个氢键的键能是(HF)n>冰>(NH3)n,
而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n
注意:氢键的键长一般定义为A—H…B的长度,而不是H…B的长度
科学 技术 社会
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
生物大分子中的氢键
科学 技术 社会
生物大分子中的氢键
作用力类型 范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质 的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强(主要影响化学性质)
1.正误判断,正确的打“√”,错误的打“×”。
①乙醇分子和水分子间只存在范德华力。( )
②氢键(X—H Y)中三原子在一条直线上时,作用力最强。( )
③“X—H Y”三原子不在一条直线上时,也能形成氢键。( )
④H2O比H2S稳定是因为水分子间存在氢键。( )
⑤可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键。( )
⑥卤素单质、卤素氢化物、卤素碳化物(即 CX4)的熔、沸点均随着相对分子质量的增大而升高。( )
2.下列事实与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点低
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②④⑤
B
3.下列说法不正确的是
A.分子间作用力是分子间相互作用力的总称,包括氢键与范德华力
B.分子间氢键的形成除使物质的熔点、沸点升高外,对物质的溶解、电离等也都有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛存在于自然界中
D
分子间作用力
(范德华力 氢键)
第二章 分子结构与性质
1、认识分子间存在相互作用,知道范德华力是常见的分子间作用力。
2、能说明范德华力对物质熔点、沸点等性质的影响,形成“结构决定性质”的基本概念。
3、知道氢键是常见的分子间作用力,能说明氢键对物质熔点、沸点等性质的影响,能举例说明氢键对于生命的重大意义。
为什么下雪不冷,化雪冷呢?
雪融化现象是物理变化还是化学变化?
雪过程中有没有破坏其中的化学键?
冰雪
水
水蒸气
(固)
(液)
(气)
分子间距离增大
雪融化需要吸收热量;水变成水蒸气仍然需要吸收热量。
吸收的热量用于破坏某种分子间作用力,这说明水分子之间存在着相互作用力。
思考:吸收的热量去哪里了呢?
H2O (l)
H2O (g)
一、分子间作用力(范德华力)
(1)概念:分子间普遍存在作用力,这类分子间作用力称为范德华力
(2)本质:分子之间的静电作用
它使得许多物质能以一定的凝聚力(固态和液态)存在
(3)特征:①只存在于分子之间,分子充分接近(300~500pm)时才有范德华力
②范德华力很弱,比化学键的键能小1-2个数量级
③范德华力无方向性和饱和性。只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
1.范德华力及其对物质性质的影响
(4)存在
单质分子之间、稀有气体原子之间、共价分子之间;石墨片层之间。
金刚石(C)单质硅(Si)内部只有共价键,不存在分子
大多数共价化合物,例如:
1. CO2、H2SO4、HF, H2O, AlCl3、各种有机化合物等;
2. 大多数非金属单质,例如:
H2、P4、S8、C60、
3. 各种稀有气体(例如Ar、Kr)等
(5)范德华力的大小及影响因素
对比范德华力的大小和键能的大小,你发现了什么?
范德华力是一种比化学键小1~2个数量级的作用力。
(5)范德华力的大小及影响因素
对比表2-7中不同分子的范德华力,你又发现了什么?
分子的极性
会影响范德华力
组成结构相似的分子,相对分子质量越大,
范德华力越大。
结论:一般,组成和性质相似的分子,相对分子质量越大,
范德华力越大,物质的熔、沸点越高。
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
【思考】怎样解释卤素单质从F2~I2的熔、沸点越来越高?
Cl2、Br2、I2的相对分子质量依次增大
范德华力依次增大
熔、沸点依次增大
范德华力只影响物质的物理性质,如熔沸点
【思考】CO和N2相对分子质量相同,为什么CO的范德华力大呢?
范德华力只影响物质的物理性质,如熔沸点
结论:相对分子质量相同或相近时,分子的极性越大,范德华力越大。
如CO为极性分子,N2为非极性分子,范德华力:CO>N2。
分子 相对分子质量 分子的极性 范德华力(kJ·mol-1)
CO 28 极性 8.75
N2 28 非极性 8.50
【思考】正戊烷、异戊烷、新戊烷的相对分子质量相同,为什么熔沸点不同呢?
范德华力只影响物质的物理性质,如熔沸点
结论:互为同分异构体的分子,支链越多、越分散,分子间范德华力越弱,熔、沸点就越低
单质 相对分子质量 沸点/℃
正戊烷 72 36.1
异戊烷 72 28
新戊烷 72 10
物质的熔、沸点
越高
分子的极性
越大
相对分子质量越大
范德华力
越大
决定
决定
键能大小影响分子的热稳定性,范德华力的大小影响物质的熔沸点
1.范德华力是一种较弱的化学键( )
2.范德华力是分子间存在的较强的相互作用( )
3.范德华力直接影响所有物质的熔、沸点( )
4.稀有气体的分子间存在范德华力( )
5.冰融化时,分子中H—O键发生断裂( )
6.由于H—O键比H—S键牢固,所以H2O的熔沸点比H2S的高( )
7.在由分子构成的物质中,分子间作用力越大,该物质越稳定( )
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸
点
/℃
周期
对于同一主族非金属元素氢化物而言,从上到下,相对分子质量逐渐增大,范德华力逐渐增大,熔沸点逐渐升高。而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他作用。
这种作用力就是氢键。
一些氢化物的沸点
二、分子间作用力(氢键)
在水分子的O—H中,共用电子对强烈的偏向O,使H几乎成为“裸露”的质子,其显正电性,它能与另一个水分子中电负性很大的O的孤电子对产生静电作用,这种静电作用就是氢键。
静电吸引
氢键
电负性大
半径小
几乎成为“裸露”的质子
二、分子间作用力(氢键)
2.表示方法:氢键通常用 表示,其中X、Y为 ,“—”表示 ,“┅”表示形成的 。
1.概念:由已经与 _很大的原子形成共价键的_______(如水分子中的氢)与另一个 很大的原子(如水分子中的氧)之间的作用力。
电负性
氢原子
电负性
X-H┅Y-
共价键
氢键
N、O、F
①氢键不属于化学键:化学键>氢键>范德华力。
②分子有氢键就一定有范德华力,有范德华力不一定有氢键。
③与氢原子形成氢键时,电负性越大,氢键越强。
④分子间氢键会使物质熔、沸点大大增加。
⑤氢键具有一定的方向性和饱和性。
3.氢键特征:
饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
方向性:X—H···Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
氢键有键长、键能
*氢键键长一般定义为A—H···B的长度,而不是H···B的长度。
氢键比化学键的键能小1~2个数量级,但比范德华力强。
强度:化学键 > 氢键 > 范德华力
4.氢键分类
②分子内氢键(不属于分子间作用力)
① 分子间氢键(属于分子间作用力)
邻羟基苯甲醛
对羟基苯甲醛
如:H2O、NH3、HF、C2H5OH、
CH3COOH相互之间。
沸点:分子间氢键>分子内氢键
如: 当苯酚在邻位上有—CHO、—COOH、
—NO2和 —OH时,可形成分子内的氢键。
分子内氢键可以使分子更稳定。且分子内氢键会削弱分子间氢键形成,故一般熔沸点较低。
熔点115 ℃
沸点246.6℃
熔点2 ℃
沸点196.5℃
5.氢键的对物质性质的影响
(1)氢键对物质熔、沸点的影响
VA~VIA族元素的氢化物中,NH3、H2O和HF的熔沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
名称 相对分子质量 沸点/℃
甲醇 32 65
乙烷 30 -89
乙醇 46 78
丙烷 44 -42
正丙醇 60 97
正丁烷 58 -0.5
(2)氢键对物质密度的影响
水的熔点(℃) 水的沸点(℃) 水在0 ℃时密度(g/ml) 水在4 ℃时密度(g/ml)
0.00 100.00 0.9998 1.0000
冰的密度比液体水小?
冰中一个水分子
周围有4个水分子
冰的结构
冰融化,分子间空隙减小
在冰中每个水分子被4个水分子包围形成变形的正四面体
一个水分子可形成二个氢键。因此1mol冰中有2mol氢键
常温下液态水中除了含有简单H2O外,还含有通过氢键联系在一起的缔合分子(H2O)2、(H2O)3……(H2O)n等。一个水分子的氧原子与另一个水分子的氢原子沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有H2O全部缔合——结冰后,所有的H2O按一定的方向全部形成了氢键,成为晶体,因此在冰的结构中形成许多空隙,体积膨胀,密度减小。故冰的体积大于等质量的水的体积,冰的密度小于水的密度。
思考与讨论
H2O、HF、NH3沸点依次降低的原因
已知固态H2O、HF、NH3的氢键键能和结构如下:
单个氢键的键能是(HF)n>冰>(NH3)n,
而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n
注意:氢键的键长一般定义为A—H…B的长度,而不是H…B的长度
科学 技术 社会
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
生物大分子中的氢键
科学 技术 社会
生物大分子中的氢键
作用力类型 范德华力 氢键 共价键
作用微粒 分子 H与N、O、F 原子
强度比较 共价键>氢键>范德华力 影响因素 组成和结构相似的物质,相对分子质量越大,范德华力越大 形成氢键元素的电负性 原子半径
对性质 的影响 影响物质的熔点、沸点、溶解度等物理性质 分子间氢键使熔、沸点升高,溶解度增大 键能越大,稳定性越强(主要影响化学性质)
1.正误判断,正确的打“√”,错误的打“×”。
①乙醇分子和水分子间只存在范德华力。( )
②氢键(X—H Y)中三原子在一条直线上时,作用力最强。( )
③“X—H Y”三原子不在一条直线上时,也能形成氢键。( )
④H2O比H2S稳定是因为水分子间存在氢键。( )
⑤可燃冰(CH4·8H2O)中甲烷分子与水分子间形成了氢键。( )
⑥卤素单质、卤素氢化物、卤素碳化物(即 CX4)的熔、沸点均随着相对分子质量的增大而升高。( )
2.下列事实与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、醋酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HCl比HI的沸点低
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.①②③④⑤ B.①②③⑤
C.①②③④ D.①②④⑤
B
3.下列说法不正确的是
A.分子间作用力是分子间相互作用力的总称,包括氢键与范德华力
B.分子间氢键的形成除使物质的熔点、沸点升高外,对物质的溶解、电离等也都有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛存在于自然界中
D
