2.3 课时4 溶解性 分子的手性 课件 (共24张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时4 溶解性 分子的手性 课件 (共24张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:45:51 | ||
图片预览





文档简介
(共24张PPT)
溶解性 分子的手性
第二章 分子结构与性质
1、知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2、结合实例初步认识分子的手性对其性质的影响。
青蒿素的提取
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”。
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
一、溶解性
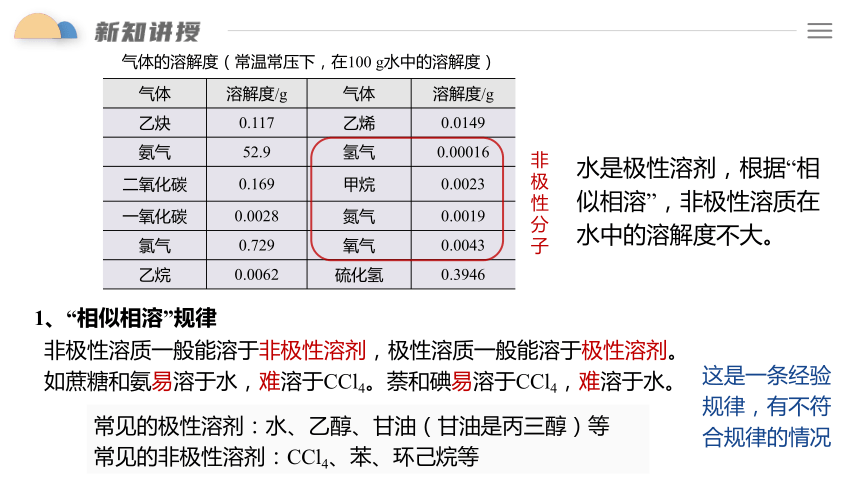
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
如蔗糖和氨易溶于水,难溶于CCl4。萘和碘易溶于CCl4,难溶于水。
1、“相似相溶”规律
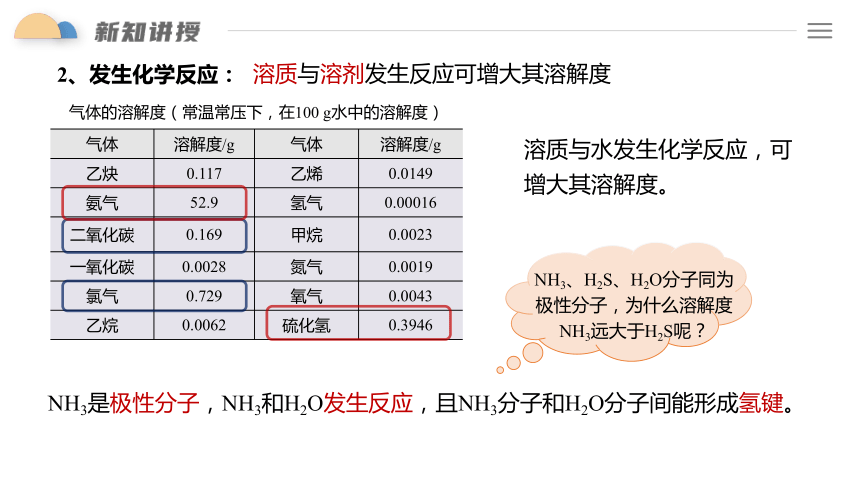
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
非
极
性
分
子
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大。
常见的极性溶剂:水、乙醇、甘油(甘油是丙三醇)等
常见的非极性溶剂:CCl4、苯、环己烷等
这是一条经验规律,有不符合规律的情况
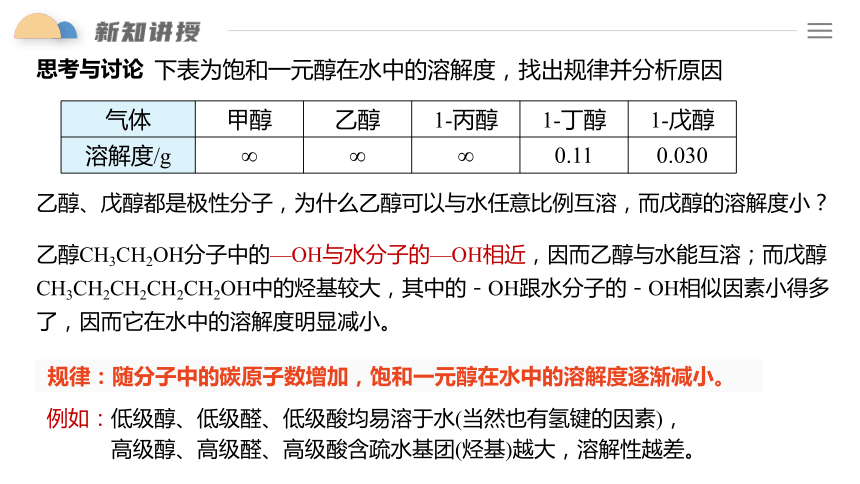
思考与讨论
乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它在水中的溶解度明显减小。
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
规律:随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
例如:低级醇、低级醛、低级酸均易溶于水(当然也有氢键的因素),
高级醇、高级醛、高级酸含疏水基团(烃基)越大,溶解性越差。
气体 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
下表为饱和一元醇在水中的溶解度,找出规律并分析原因
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
溶质与水发生化学反应,可增大其溶解度。
溶质与溶剂发生反应可增大其溶解度
2、发生化学反应:
NH3、H2S、H2O分子同为
极性分子,为什么溶解度NH3远大于H2S呢?
NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键。
思考与讨论
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
思考与讨论
2.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?
油漆是极性较小的分子,有机溶剂(如乙酸乙酯)也是极性较小的溶剂,而水为极性较大的溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
思考与讨论
[实验现象]
实验结论:I2 在 CCl4 中溶解性比在水中好。
[分析]下列哪些是极性分子,哪些是非极性分子?H2O CCl4 I2
H2O为极性分子,CCl4、I2 为非极性分子。非极性溶质一般能溶于非极性溶剂。
为什么碘在四氯化碳中的溶解度大于其在水中的溶解度?
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI
振荡
已知:
I2 + I- I3-
2、下列现象不能用“相似相溶”规律解释的是 ( )
A. 氯化氢易溶于水 B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4 D. 酒精易溶于水
1、已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关 于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样
B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大
D. 无法比较
C
B
3.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CCl4和SiCl4的熔点
B.对羟基苯甲醛( )和邻羟基苯甲醛( )的沸点
C.I2在水中的溶解度和I2在CCl4溶液中的溶解度
D.NH3和HF的沸点
B
4.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
D
碳原子结合的四个原子或原子团各不相同
自然界中生命体的对称美
思考:你的左右手能够完全重叠么?
二、分子的手性
试一试:是否叠合?
两个分子互为镜像,不能相互叠合
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。(或对映异构体)
1、手性异构体
2、手性分子:有手性异构体的分子
注意:
(1)手性分子的物质不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质组成、结构几乎完全相同,化学性质几乎完全相同
Cl
Br
H
F
Cl
Br
H
F
CHFClBr
CH2ClBr
绕轴旋转
能叠合
能叠合,是同种分子,不是手性分子
绕轴旋转
不能叠合
不能叠合,是手性分子
基于甲烷正四面体的结构,思考CH2ClBr 和 CHFClBr 的分子模型,及其镜像分子模型,思考二者能否完全叠合?是否为手性分子?
3、手性碳原子的判断方法
如果分子的手性是由于原子或基团围绕某一点的非对称排列而产生的,这个点就是手性中心。
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
归纳:手性分子的判断方法
(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分子。如图:
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。含有两个手性碳原子的有机物分子不一定是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
(3)用旋光仪测量物质的旋光度,判断是否具有光学活性。
4. 手性分子的应用
(1) 合成手性药物 (2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
化学史上十项最美实验之首——巴斯德分离左右型酒石酸盐
一对手性酒石酸盐晶体
巴斯德在研究酒石酸盐时,发现有两种互为手性异构的形式,并用镊子将这两种晶体分离出。这是人类首次发现分子的手性并成功地通过手工拆分出手性异构体。
显微镜观察晶体结构
1、下列物质的分子中不具有手性碳原子的是( )
A. B . H2N CH2 COOH
C. CH2OH CH(OH) CHO D. CH3 CH(NH2) COOH
OH
CHCH3
B
2、莽草酸的结构简式如图所示(分子中只有C、H、O三种原子)。 其分子中手性碳原子的个数为( )
A.1 B.2 C.3 D.4
C
3.下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH
C.CH3CHOHCOOH D.CH3COCH2CH3
D
﹡
﹡
﹡
4.标出手性碳原子?
﹡
﹡
﹡
﹡
﹡
﹡
﹡
溶解性 分子的手性
第二章 分子结构与性质
1、知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2、结合实例初步认识分子的手性对其性质的影响。
青蒿素的提取
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”。
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
为什么需要用乙醚来提取青蒿素,用水不可以呢?
CH3CH2—O—CH2CH3
乙醚
青蒿素
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,
在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
一、溶解性
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
如蔗糖和氨易溶于水,难溶于CCl4。萘和碘易溶于CCl4,难溶于水。
1、“相似相溶”规律
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
非
极
性
分
子
水是极性溶剂,根据“相似相溶”,非极性溶质在水中的溶解度不大。
常见的极性溶剂:水、乙醇、甘油(甘油是丙三醇)等
常见的非极性溶剂:CCl4、苯、环己烷等
这是一条经验规律,有不符合规律的情况
思考与讨论
乙醇CH3CH2OH分子中的—OH与水分子的—OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它在水中的溶解度明显减小。
乙醇、戊醇都是极性分子,为什么乙醇可以与水任意比例互溶,而戊醇的溶解度小?
规律:随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
例如:低级醇、低级醛、低级酸均易溶于水(当然也有氢键的因素),
高级醇、高级醛、高级酸含疏水基团(烃基)越大,溶解性越差。
气体 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
下表为饱和一元醇在水中的溶解度,找出规律并分析原因
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 硫化氢 0.3946
气体的溶解度(常温常压下,在100 g水中的溶解度)
溶质与水发生化学反应,可增大其溶解度。
溶质与溶剂发生反应可增大其溶解度
2、发生化学反应:
NH3、H2S、H2O分子同为
极性分子,为什么溶解度NH3远大于H2S呢?
NH3是极性分子,NH3和H2O发生反应,且NH3分子和H2O分子间能形成氢键。
思考与讨论
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
思考与讨论
2.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?
油漆是极性较小的分子,有机溶剂(如乙酸乙酯)也是极性较小的溶剂,而水为极性较大的溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
思考与讨论
[实验现象]
实验结论:I2 在 CCl4 中溶解性比在水中好。
[分析]下列哪些是极性分子,哪些是非极性分子?H2O CCl4 I2
H2O为极性分子,CCl4、I2 为非极性分子。非极性溶质一般能溶于非极性溶剂。
为什么碘在四氯化碳中的溶解度大于其在水中的溶解度?
I2 溶于水中
溶液呈黄色
加入 CCl4
振荡
I2 溶于 CCl4 中
溶液呈紫红色
加入 KI
振荡
已知:
I2 + I- I3-
2、下列现象不能用“相似相溶”规律解释的是 ( )
A. 氯化氢易溶于水 B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4 D. 酒精易溶于水
1、已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关 于 O3 和 O2 在水中的溶解度叙述正确的是( )
A. O3 在水中的溶解度和 O2 一样
B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大
D. 无法比较
C
B
3.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CCl4和SiCl4的熔点
B.对羟基苯甲醛( )和邻羟基苯甲醛( )的沸点
C.I2在水中的溶解度和I2在CCl4溶液中的溶解度
D.NH3和HF的沸点
B
4.下列对分子性质的解释中,不正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.乳酸( )分子中含有一个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.SO2易溶于水只是因为相似相溶原理
D
碳原子结合的四个原子或原子团各不相同
自然界中生命体的对称美
思考:你的左右手能够完全重叠么?
二、分子的手性
试一试:是否叠合?
两个分子互为镜像,不能相互叠合
具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体。(或对映异构体)
1、手性异构体
2、手性分子:有手性异构体的分子
注意:
(1)手性分子的物质不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质组成、结构几乎完全相同,化学性质几乎完全相同
Cl
Br
H
F
Cl
Br
H
F
CHFClBr
CH2ClBr
绕轴旋转
能叠合
能叠合,是同种分子,不是手性分子
绕轴旋转
不能叠合
不能叠合,是手性分子
基于甲烷正四面体的结构,思考CH2ClBr 和 CHFClBr 的分子模型,及其镜像分子模型,思考二者能否完全叠合?是否为手性分子?
3、手性碳原子的判断方法
如果分子的手性是由于原子或基团围绕某一点的非对称排列而产生的,这个点就是手性中心。
当碳原子连接4 个不同的原子或基团时,该碳原子就是一个手性中心,称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
归纳:手性分子的判断方法
(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分子。如图:
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。含有两个手性碳原子的有机物分子不一定是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
(3)用旋光仪测量物质的旋光度,判断是否具有光学活性。
4. 手性分子的应用
(1) 合成手性药物 (2) 合成手性催化剂
手性合成、手性催化方面做出贡献的科学家
化学史上十项最美实验之首——巴斯德分离左右型酒石酸盐
一对手性酒石酸盐晶体
巴斯德在研究酒石酸盐时,发现有两种互为手性异构的形式,并用镊子将这两种晶体分离出。这是人类首次发现分子的手性并成功地通过手工拆分出手性异构体。
显微镜观察晶体结构
1、下列物质的分子中不具有手性碳原子的是( )
A. B . H2N CH2 COOH
C. CH2OH CH(OH) CHO D. CH3 CH(NH2) COOH
OH
CHCH3
B
2、莽草酸的结构简式如图所示(分子中只有C、H、O三种原子)。 其分子中手性碳原子的个数为( )
A.1 B.2 C.3 D.4
C
3.下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH
C.CH3CHOHCOOH D.CH3COCH2CH3
D
﹡
﹡
﹡
4.标出手性碳原子?
﹡
﹡
﹡
﹡
﹡
﹡
﹡
