2.3 课时3 溶解性 分子的手性 课件 (共25张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3 课时3 溶解性 分子的手性 课件 (共25张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:47:39 | ||
图片预览







文档简介
(共25张PPT)
溶解性 分子的手性
第二章 分子结构与性质
1、知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2、结合实例初步认识分子的手性对其性质的影响。
物质在水中的溶解度受哪些外因影响?
固体
(1)大多数固体物质的溶解度随温度升高而增大,如KNO3, NH4Cl。
(2)少数固体物质的溶解度受温度的影响很小,如NaCl。
(3)极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。
气体
①温度:温度越高,气体溶解度越小。
②压强:压强越大,气体溶解度越大。
分子极性也影响物质的溶解,即“相似相溶”
相似相溶:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
H2O——极性溶剂
CCl4——非极性溶剂
Br2、I2——非极性分子
蔗糖——极性分子
蔗糖易溶于水,难溶于CCl4
Br2、I2易溶于CCl4 ,难溶于水
下表为饱和一元醇在水中的溶解度,找出规律并分析原因
气体 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
C2H5OH 中的 —OH 和 H2O 中的 —OH 相近,因而乙醇易溶于水。
戊醇(CH3CH2CH2CH2CH2OH)中烃基较大,其 —OH 跟水分子中的 —OH 相似性差异较大,因此它在水中溶解度明显减小。
随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
若溶质与溶剂能形成氢键 ,
可增大其溶解度。
同为非极性分子,为什么CO2、Cl2在水(极性溶剂)中具有较好的溶解度?
气体 二氧化碳 氯气 氢气 氮气 氧气
溶解度/g 0.169 0.729 0.00016 0.0019 0.0043
若溶质与溶剂能发生化学反应,可增大其溶解度。
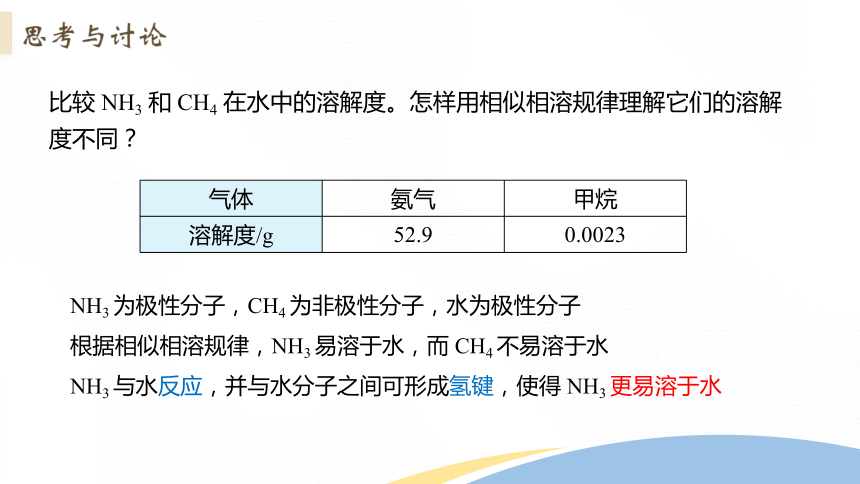
比较 NH3 和 CH4 在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
气体 氨气 甲烷
溶解度/g 52.9 0.0023
NH3 为极性分子,CH4 为非极性分子,水为极性分子
根据相似相溶规律,NH3 易溶于水,而 CH4 不易溶于水
NH3 与水反应,并与水分子之间可形成氢键,使得 NH3 更易溶于水
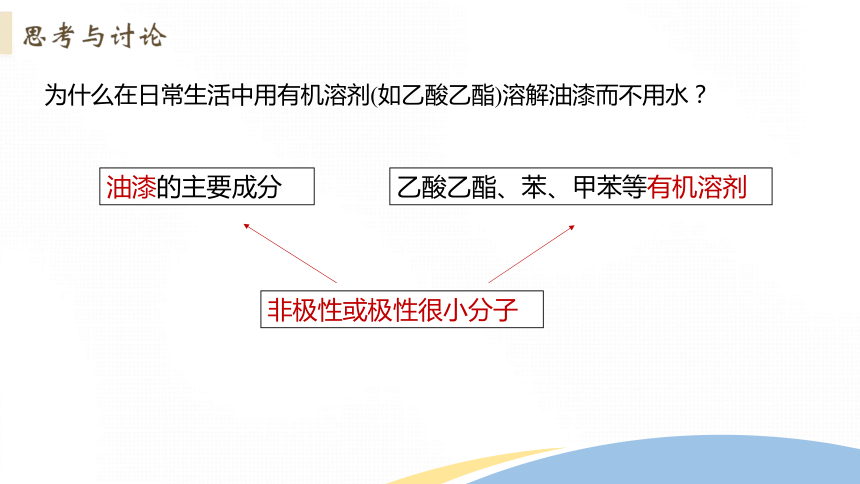
为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
KI3 易溶于水,碘单质参与发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,下层溶液紫红色变浅
1、碘是非极性分子,在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯化碳。因此水层颜色明显变浅,而CCl4层呈紫红色。
2、碘水中加人浓的KI溶液后,由于发生反应:I2+I- I3-,碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
一、溶解性
物质在水中溶解性的影响因素
分子的极性
分子结构的相似性
是否发生化学反应
能否形成氢键
二、分子的手性
活动:搭建两个CH2ClBr球棍模型
Cl
Br
H
H
如果将CH2ClBr中的一个H换成F,CHFClBr的球棍模型是否完全重叠?
Cl
H
H
Br
能完全重叠,
是同种分子
Cl
Br
H
F
Cl
Br
H
F
两个分子互为镜像,但不能相互叠合
镜子
Cl
Br
H
F
Cl
Br
H
F
两个分子互为手性关系,具有手性关系的分子称为手性分子。
手性的基本特征就是物体与镜像的关系,看似对称,但无论怎样旋转,它们都无法重合。
镜子
二、分子的手性
三维空间里不能重叠。
完全相同的组成和原子排列
如同左右手一样互为镜像
有手性异构体的分子
2、手性分子
1、手性异构体(或对映异构)
3、手性碳原子的判断方法
①当碳原子连接4 个不同的原子或基团时,该碳原子称
为手性碳原子, 标记为﹡。
②手性碳原子一定是饱和碳原子。
当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
4. 手性合成:
目前世界上使用的药物总数约为1900种,手性药物大约占50%以上,在临床常用的200种药物中,手性药物多达114种。
如日常用于消炎杀菌的氧氟沙星、治疗冠心病的氨氯地平等都是手性药物。
4. 手性合成:
对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
开发和服用有效的单一手性的药物不仅可以排除由于无效(或不良)手性异构体所引起的毒副作用,还能减少用药剂量和人体对无效手性异构体的代谢负担,提高药物的专一性。
4. 手性合成:
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
1、 下列说法中正确的是( )
A、分子间作用力越大,分子越稳定
B、分子间作用力越大,物质的熔、沸点越高
C、相对分子质量越大,其分子间作用力越大
D、分子间只存在范德华力
B
2、下列与氢键有关的说法中错误的是( )
A、卤化氢中HF沸点较高,是由于HF分子间存在氢键
B、邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛
( )的熔、沸点低
C、氨水中存在分子间氢键
D、形成氢键A—H B—的三个原子总在一条直线上
D
3.下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF、NH3都极易溶于水
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
B
4、下列分子中含有手性碳原子的是
A.CH2Cl2 B.CH3CH2OH C.CH3CH(CH3)2 D.CH3CH(CH3)CHClCOOH
D
5、维生素C的结构简式是 ,它能防治坏血病,该分子中有几个手性碳原子
A.1 B.2 C.3 D.4
B
*
*
溶解性 分子的手性
第二章 分子结构与性质
1、知道物质的溶解性与分子结构的关系,了解“相似相溶”规律。
2、结合实例初步认识分子的手性对其性质的影响。
物质在水中的溶解度受哪些外因影响?
固体
(1)大多数固体物质的溶解度随温度升高而增大,如KNO3, NH4Cl。
(2)少数固体物质的溶解度受温度的影响很小,如NaCl。
(3)极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。
气体
①温度:温度越高,气体溶解度越小。
②压强:压强越大,气体溶解度越大。
分子极性也影响物质的溶解,即“相似相溶”
相似相溶:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
H2O——极性溶剂
CCl4——非极性溶剂
Br2、I2——非极性分子
蔗糖——极性分子
蔗糖易溶于水,难溶于CCl4
Br2、I2易溶于CCl4 ,难溶于水
下表为饱和一元醇在水中的溶解度,找出规律并分析原因
气体 甲醇 乙醇 1-丙醇 1-丁醇 1-戊醇
溶解度/g ∞ ∞ ∞ 0.11 0.030
C2H5OH 中的 —OH 和 H2O 中的 —OH 相近,因而乙醇易溶于水。
戊醇(CH3CH2CH2CH2CH2OH)中烃基较大,其 —OH 跟水分子中的 —OH 相似性差异较大,因此它在水中溶解度明显减小。
随分子中的碳原子数增加,饱和一元醇在水中的溶解度逐渐减小。
若溶质与溶剂能形成氢键 ,
可增大其溶解度。
同为非极性分子,为什么CO2、Cl2在水(极性溶剂)中具有较好的溶解度?
气体 二氧化碳 氯气 氢气 氮气 氧气
溶解度/g 0.169 0.729 0.00016 0.0019 0.0043
若溶质与溶剂能发生化学反应,可增大其溶解度。
比较 NH3 和 CH4 在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
气体 氨气 甲烷
溶解度/g 52.9 0.0023
NH3 为极性分子,CH4 为非极性分子,水为极性分子
根据相似相溶规律,NH3 易溶于水,而 CH4 不易溶于水
NH3 与水反应,并与水分子之间可形成氢键,使得 NH3 更易溶于水
为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
KI3 易溶于水,碘单质参与发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,下层溶液紫红色变浅
1、碘是非极性分子,在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯化碳。因此水层颜色明显变浅,而CCl4层呈紫红色。
2、碘水中加人浓的KI溶液后,由于发生反应:I2+I- I3-,碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
一、溶解性
物质在水中溶解性的影响因素
分子的极性
分子结构的相似性
是否发生化学反应
能否形成氢键
二、分子的手性
活动:搭建两个CH2ClBr球棍模型
Cl
Br
H
H
如果将CH2ClBr中的一个H换成F,CHFClBr的球棍模型是否完全重叠?
Cl
H
H
Br
能完全重叠,
是同种分子
Cl
Br
H
F
Cl
Br
H
F
两个分子互为镜像,但不能相互叠合
镜子
Cl
Br
H
F
Cl
Br
H
F
两个分子互为手性关系,具有手性关系的分子称为手性分子。
手性的基本特征就是物体与镜像的关系,看似对称,但无论怎样旋转,它们都无法重合。
镜子
二、分子的手性
三维空间里不能重叠。
完全相同的组成和原子排列
如同左右手一样互为镜像
有手性异构体的分子
2、手性分子
1、手性异构体(或对映异构)
3、手性碳原子的判断方法
①当碳原子连接4 个不同的原子或基团时,该碳原子称
为手性碳原子, 标记为﹡。
②手性碳原子一定是饱和碳原子。
当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
4. 手性合成:
目前世界上使用的药物总数约为1900种,手性药物大约占50%以上,在临床常用的200种药物中,手性药物多达114种。
如日常用于消炎杀菌的氧氟沙星、治疗冠心病的氨氯地平等都是手性药物。
4. 手性合成:
对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
开发和服用有效的单一手性的药物不仅可以排除由于无效(或不良)手性异构体所引起的毒副作用,还能减少用药剂量和人体对无效手性异构体的代谢负担,提高药物的专一性。
4. 手性合成:
2001年,诺贝尔化学奖授予三位用手性催化剂生产手性药物的化学家。用他们的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构分子,这种独特的合成方法称为手性合成。手性合成的药物生产造福人类并带来巨大的经济效益。
1、 下列说法中正确的是( )
A、分子间作用力越大,分子越稳定
B、分子间作用力越大,物质的熔、沸点越高
C、相对分子质量越大,其分子间作用力越大
D、分子间只存在范德华力
B
2、下列与氢键有关的说法中错误的是( )
A、卤化氢中HF沸点较高,是由于HF分子间存在氢键
B、邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛
( )的熔、沸点低
C、氨水中存在分子间氢键
D、形成氢键A—H B—的三个原子总在一条直线上
D
3.下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF、NH3都极易溶于水
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
B
4、下列分子中含有手性碳原子的是
A.CH2Cl2 B.CH3CH2OH C.CH3CH(CH3)2 D.CH3CH(CH3)CHClCOOH
D
5、维生素C的结构简式是 ,它能防治坏血病,该分子中有几个手性碳原子
A.1 B.2 C.3 D.4
B
*
*
