2.1 课时2 键参数 课件(共21张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.1 课时2 键参数 课件(共21张PPT) 2024-2025学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 846.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 02:51:44 | ||
图片预览







文档简介
(共21张PPT)
键参数
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
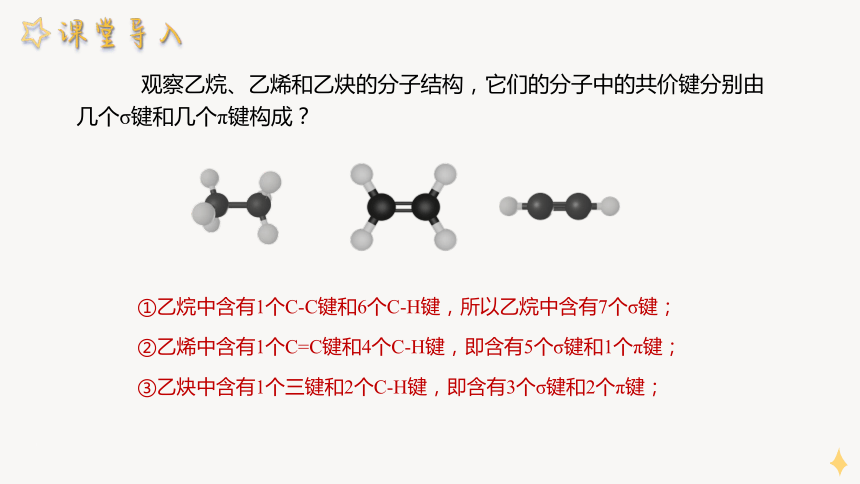
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
在描述两个原子之间的共价键强度时,我们使用“牢固”或“不牢固”这样的描述不够科学、清晰。
是否有参数可以定量描述共价键的强度?
这个参数可能与什么因素相关?
一、键参数——键长
1.定义:
2.特点:
3.对分子性质影响:
两个成键原子的原子核间的距离(简称核间距)
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
影响分子空间结构的因素之一
同周期的C、N、O、F与H之间的共价键键长的变化规律如何?
这种变化规律与原子半径的递变规律有何关联?
同周期的C、N、O、F与H之间的共价键键长F-H < O-H < N-H < C-H。
这一变化规律与同一周期元素原子半径递变规律相同,即F < O < N < C,在成键中一原子都为H原子时,另一个原子的半径大小决定了共价键键长长短,原子半径越大,共价键键长越长。
键 C-H N-H O-H F-H
键长(pm) 109 101 96 92
一、键参数——键角
1.定义:
在多原子分子中,两个化学键的夹角
2.应用:
用于描述多原子分子的空间结构
直线形
角形
三角锥形
一、键参数——键能
1.定义:
在 101.3 kPa、298 K 条件下,断开1mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
2.表示方法:
EA-B
3.应用:
定量地表示化学键的强弱
键能愈大,断开时需要的能量就愈多,化学键就愈牢固;
键能愈小,断开时需要的能量就愈少,化学键就愈不牢固。
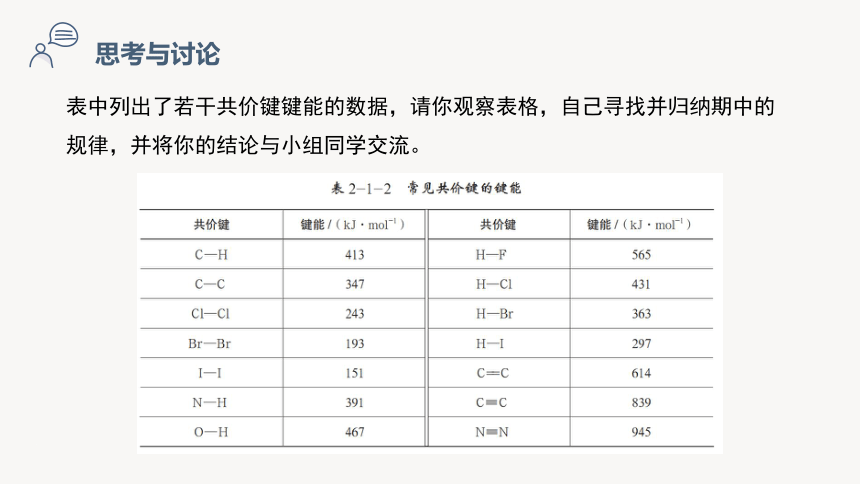
表中列出了若干共价键键能的数据,请你观察表格,自己寻找并归纳期中的规律,并将你的结论与小组同学交流。
(1)同主族的卤原子与H之间的共价键键能的变化规律如何?
同周期的C、N、O、F与H之间的共价键键能的变化规律如何?
同周期的C、N、O、F与H之间的共价键键能自左向右呈逐渐增大(N-H略小于C-H)
键 键能
H-F 568 kJ/mol
H-Cl 431.8 kJ/mol
H-Br 366 kJ/mol
H-I 298.7 kJ/mol
卤化氢中X-H键键能自上而下逐渐减小
键 C-H N-H O-H F-H
键能(kJ/mol) 413.4 390.8 462.8 568
(2)碳碳单键、碳碳双键、碳碳叁键的键能变化趋势如何?它们之间的差值大小是怎样的?从键能的角度谈谈乙烷、乙烯、乙炔的反应活性差别。
碳碳单键、碳碳双键、碳碳叁键的键能逐渐增大,但是新增的π键所对应的键能增量部分不如C-C σ键大。
根据数据可以计算出,C-C之间π键键能约为σ键键能的70%。在反应中仅需吸收较少的能量π键就会被破坏,故而乙烯、乙炔的反应活性高。
键 键能(kJ/mol)
C-C 347
C=C 614
C≡C 839
267
(2)碳碳单键、碳碳双键、碳碳叁键的键长变化趋势如何?
这一变化趋势与它们的键能变化趋势有何关系?
碳碳单键、碳碳双键、碳碳叁键的键长逐渐变短。与键能的变化趋势相比,可以得知,两原子之间的共价键键数越多,键能越大,键长越短。
共价键 键长/pm 键能/(kJ/mol)
C-C 154 347
C=C 134 614
C≡C 121 839
(3)氮氮单键、氮氮双键、氮氮叁键的键能变化趋势如何?它们之间的差值大小是怎样的?从键能的角度谈谈为何N2非常稳定。
氮氮单键、氮氮双键、氮氮叁键的键能逐渐增大,但是新增的π键所对应的键能增量部分比N-N σ键大。这是由于N2分子的π键具有一定的特殊性。
氮氮叁键键能高达945 kJ·mol-1,反应中变为氮原子需要吸收非常多的能量。一般条件无法满足该能量条件,故N2非常稳定。
键 键能(kJ/mol)
N-N 193
N=N 418
N≡N 945
225
(4)C-C单键的键能为347.7 kJ·mol-1,N-N单键、O-O单键、F-F单键的键能分别为193 kJ·mol-1 , 142 kJ·mol-1 , 157 kJ·mol-1 ,为何N、O、F三种元素的单键键能明显偏小?
N、O、F三种元素的原子半径都很小,核外电子集中在一个较小区域内,负电密度较大。
形成共价键时两原子彼此靠近,电子间的排斥较剧烈,导致能量升高。这一因素部分抵消了形成共价键时能量降低的结果。
(5)O-O单键的键能为142 kJ·mol-1 ,这一数据与含O-O单键的物质的化学性质有何关联?列举一个你学过的含O-O单键的物质,结合其性质进行说明。
含O-O单键的常见物质之一是H2O2,它在室温、无催化剂的条件下会逐渐分解为水和氧气,在加热或催化剂的条件下会更迅速的分解。
因O-O单键键能很小,提供较少能量就促使其断裂。同时生成的O2和H2O中的O-O双键,H-O单键键能均很大,产物很稳定。故一般含O-O单键的物质都容易分解。用作消毒剂的过氧乙酸也含有O-O单键。
键 键能(kJ/mol)
O-O 142
O=O 497.3
H-O 462.8
(6)N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
由于N≡N、O=O、F-F的键能依次减小,同时N-H、O-H、F-H键键能依次增大。
即旧键易断裂,新键形成后很稳定。
故N2、O2、F2跟H2的反应能力依次增强
键 N≡N O=O F-F N-H O-H F-H
键能(kJ/mol) 946 497.3 157 390.8 462.8 568
键参数
键能
键长
键角
决定
分子稳定性
分子空间结构
分子性质
决定
决定
(1)共价键的成键原子只能是非金属原子( )
(2)所有σ键的强度都比π键大( )
(3)在所有分子中都存在化学键( )
(4)s-s σ键与s-p σ键的电子云形状的对称性相同 ( )
(5)σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )
(6)碳碳叁键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )
(7)键长等于成键两原子的半径之和( )
1.判断正误
√
×
×
√
×
×
×
2. 人们常用HX表示卤化氢(X代表F、Cl、Br、I),下列说法中,正确的是
形成共价键的两个原子之间的核间距叫做键长
B. H-F的键长是H-X中最长的
C. H-F是p-p σ键
D. H-F的键能是H-X中最小的。
A
3. 下列说法中,错误的是( )
键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固
键长与共价键的稳定性没有关系
键角是两个相邻共价键之间的夹角,说明共价键有方向性
共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性
B
4. 下列说法中,错误的是( )
氧原子有两个未成对电子,因而能形成两个共价键
氧原子可以形成H2O、H2O2,也可以形成H3O
已知H2O2的分子结构是H-O-O-H,在H2O2中只有σ键没有π键。
已知N2分子的结构是N≡N,在N2中有1个σ键和2个π键
B
键参数
1.知道键能、键长、键角可以用来描述键的强弱和分子的空间结构。
观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
在描述两个原子之间的共价键强度时,我们使用“牢固”或“不牢固”这样的描述不够科学、清晰。
是否有参数可以定量描述共价键的强度?
这个参数可能与什么因素相关?
一、键参数——键长
1.定义:
2.特点:
3.对分子性质影响:
两个成键原子的原子核间的距离(简称核间距)
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
影响分子空间结构的因素之一
同周期的C、N、O、F与H之间的共价键键长的变化规律如何?
这种变化规律与原子半径的递变规律有何关联?
同周期的C、N、O、F与H之间的共价键键长F-H < O-H < N-H < C-H。
这一变化规律与同一周期元素原子半径递变规律相同,即F < O < N < C,在成键中一原子都为H原子时,另一个原子的半径大小决定了共价键键长长短,原子半径越大,共价键键长越长。
键 C-H N-H O-H F-H
键长(pm) 109 101 96 92
一、键参数——键角
1.定义:
在多原子分子中,两个化学键的夹角
2.应用:
用于描述多原子分子的空间结构
直线形
角形
三角锥形
一、键参数——键能
1.定义:
在 101.3 kPa、298 K 条件下,断开1mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
2.表示方法:
EA-B
3.应用:
定量地表示化学键的强弱
键能愈大,断开时需要的能量就愈多,化学键就愈牢固;
键能愈小,断开时需要的能量就愈少,化学键就愈不牢固。
表中列出了若干共价键键能的数据,请你观察表格,自己寻找并归纳期中的规律,并将你的结论与小组同学交流。
(1)同主族的卤原子与H之间的共价键键能的变化规律如何?
同周期的C、N、O、F与H之间的共价键键能的变化规律如何?
同周期的C、N、O、F与H之间的共价键键能自左向右呈逐渐增大(N-H略小于C-H)
键 键能
H-F 568 kJ/mol
H-Cl 431.8 kJ/mol
H-Br 366 kJ/mol
H-I 298.7 kJ/mol
卤化氢中X-H键键能自上而下逐渐减小
键 C-H N-H O-H F-H
键能(kJ/mol) 413.4 390.8 462.8 568
(2)碳碳单键、碳碳双键、碳碳叁键的键能变化趋势如何?它们之间的差值大小是怎样的?从键能的角度谈谈乙烷、乙烯、乙炔的反应活性差别。
碳碳单键、碳碳双键、碳碳叁键的键能逐渐增大,但是新增的π键所对应的键能增量部分不如C-C σ键大。
根据数据可以计算出,C-C之间π键键能约为σ键键能的70%。在反应中仅需吸收较少的能量π键就会被破坏,故而乙烯、乙炔的反应活性高。
键 键能(kJ/mol)
C-C 347
C=C 614
C≡C 839
267
(2)碳碳单键、碳碳双键、碳碳叁键的键长变化趋势如何?
这一变化趋势与它们的键能变化趋势有何关系?
碳碳单键、碳碳双键、碳碳叁键的键长逐渐变短。与键能的变化趋势相比,可以得知,两原子之间的共价键键数越多,键能越大,键长越短。
共价键 键长/pm 键能/(kJ/mol)
C-C 154 347
C=C 134 614
C≡C 121 839
(3)氮氮单键、氮氮双键、氮氮叁键的键能变化趋势如何?它们之间的差值大小是怎样的?从键能的角度谈谈为何N2非常稳定。
氮氮单键、氮氮双键、氮氮叁键的键能逐渐增大,但是新增的π键所对应的键能增量部分比N-N σ键大。这是由于N2分子的π键具有一定的特殊性。
氮氮叁键键能高达945 kJ·mol-1,反应中变为氮原子需要吸收非常多的能量。一般条件无法满足该能量条件,故N2非常稳定。
键 键能(kJ/mol)
N-N 193
N=N 418
N≡N 945
225
(4)C-C单键的键能为347.7 kJ·mol-1,N-N单键、O-O单键、F-F单键的键能分别为193 kJ·mol-1 , 142 kJ·mol-1 , 157 kJ·mol-1 ,为何N、O、F三种元素的单键键能明显偏小?
N、O、F三种元素的原子半径都很小,核外电子集中在一个较小区域内,负电密度较大。
形成共价键时两原子彼此靠近,电子间的排斥较剧烈,导致能量升高。这一因素部分抵消了形成共价键时能量降低的结果。
(5)O-O单键的键能为142 kJ·mol-1 ,这一数据与含O-O单键的物质的化学性质有何关联?列举一个你学过的含O-O单键的物质,结合其性质进行说明。
含O-O单键的常见物质之一是H2O2,它在室温、无催化剂的条件下会逐渐分解为水和氧气,在加热或催化剂的条件下会更迅速的分解。
因O-O单键键能很小,提供较少能量就促使其断裂。同时生成的O2和H2O中的O-O双键,H-O单键键能均很大,产物很稳定。故一般含O-O单键的物质都容易分解。用作消毒剂的过氧乙酸也含有O-O单键。
键 键能(kJ/mol)
O-O 142
O=O 497.3
H-O 462.8
(6)N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
由于N≡N、O=O、F-F的键能依次减小,同时N-H、O-H、F-H键键能依次增大。
即旧键易断裂,新键形成后很稳定。
故N2、O2、F2跟H2的反应能力依次增强
键 N≡N O=O F-F N-H O-H F-H
键能(kJ/mol) 946 497.3 157 390.8 462.8 568
键参数
键能
键长
键角
决定
分子稳定性
分子空间结构
分子性质
决定
决定
(1)共价键的成键原子只能是非金属原子( )
(2)所有σ键的强度都比π键大( )
(3)在所有分子中都存在化学键( )
(4)s-s σ键与s-p σ键的电子云形状的对称性相同 ( )
(5)σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )
(6)碳碳叁键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )
(7)键长等于成键两原子的半径之和( )
1.判断正误
√
×
×
√
×
×
×
2. 人们常用HX表示卤化氢(X代表F、Cl、Br、I),下列说法中,正确的是
形成共价键的两个原子之间的核间距叫做键长
B. H-F的键长是H-X中最长的
C. H-F是p-p σ键
D. H-F的键能是H-X中最小的。
A
3. 下列说法中,错误的是( )
键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固
键长与共价键的稳定性没有关系
键角是两个相邻共价键之间的夹角,说明共价键有方向性
共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性
B
4. 下列说法中,错误的是( )
氧原子有两个未成对电子,因而能形成两个共价键
氧原子可以形成H2O、H2O2,也可以形成H3O
已知H2O2的分子结构是H-O-O-H,在H2O2中只有σ键没有π键。
已知N2分子的结构是N≡N,在N2中有1个σ键和2个π键
B
