5.1 卤代烃 学案 (含答案)2024-2025学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 5.1 卤代烃 学案 (含答案)2024-2025学年高二下学期化学苏教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 644.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 11:28:06 | ||
图片预览




文档简介
卤代烃
学习目标 1.认识卤代烃的组成和结构特点、性质、转化关系及其在生产、生活中的重要应用。2.能举例说明卤代烃在有机合成中的重要应用,体会“绿色化学”思想在有机合成中的重要意义,关注有机化合物的安全使用。
一、卤代烃的性质
1.卤代烃的概念和分类
(1)概念
烃分子中的氢原子被 取代后形成的化合物,可用通式RX表示。
(2)分类
2.卤代烃的物理性质
(1)状态:常温下除 、 、 等少数为气体外,其余多为液体或固体。
(2)沸点:互为同系物的一卤代直链烷烃,它们的沸点随碳原子数的增多而 。
(3)密度:除脂肪烃的 和 外,液态卤代烃密度一般比水 。
(4)溶解性:水中: ,有机溶剂中: ,某些卤代烃是很好的有机溶剂,如 、 和 等。
3.卤代烃的化学性质
(1)消去反应的实验探究
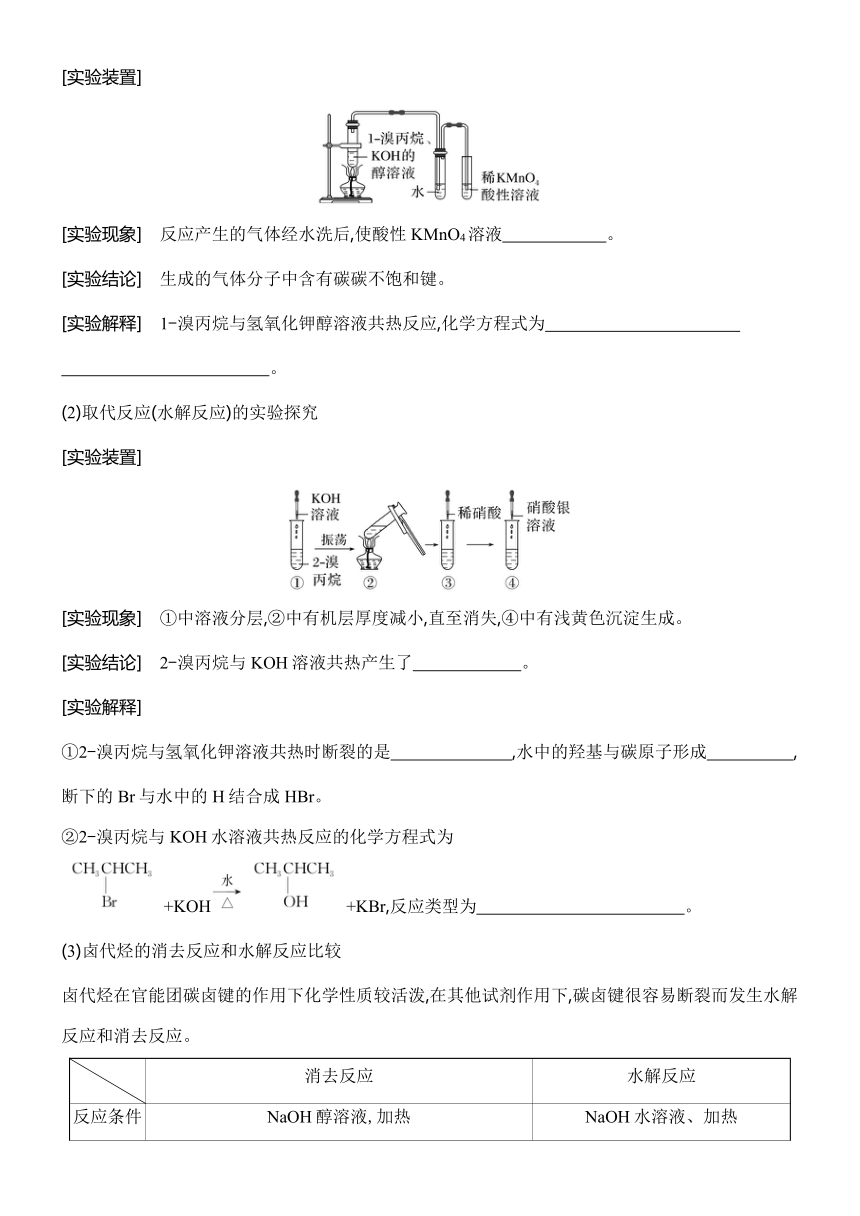
[实验装置]
[实验现象] 反应产生的气体经水洗后,使酸性KMnO4溶液 。
[实验结论] 生成的气体分子中含有碳碳不饱和键。
[实验解释] 1-溴丙烷与氢氧化钾醇溶液共热反应,化学方程式为
。
(2)取代反应(水解反应)的实验探究
[实验装置]
[实验现象] ①中溶液分层,②中有机层厚度减小,直至消失,④中有浅黄色沉淀生成。
[实验结论] 2-溴丙烷与KOH溶液共热产生了 。
[实验解释]
①2-溴丙烷与氢氧化钾溶液共热时断裂的是 ,水中的羟基与碳原子形成 ,断下的Br与水中的H结合成HBr。
②2-溴丙烷与KOH水溶液共热反应的化学方程式为
+KOH+KBr,反应类型为 。
(3)卤代烃的消去反应和水解反应比较
卤代烃在官能团碳卤键的作用下化学性质较活泼,在其他试剂作用下,碳卤键很容易断裂而发生水解反应和消去反应。
消去反应 水解反应
反应条件 NaOH醇溶液,加热 NaOH水溶液、加热
实质 失去HX分子,形成不饱和键 —X被—OH取代
键的 变化 C—X与C—H断裂形成或 与H—X C—X断裂形成C—OH
卤代烃的 结构特点 (1)没有邻位碳原子的卤代烃不能发生消去反应。 (2)有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。如、(CH3)3CCH2Br。 (3)有两个邻位碳原子,且碳原子上均有氢原子时,若不对称则消去反应可能生成两种产物。如:发生消去反应的产物为 CH2==CH—CH2—CH3或CH3—CH==CH—CH3。 (4)二元卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。如CH3—CH2CHCl2生成CH3—C≡CH 含有—X的卤代烃绝大多数都可以水解
化学反 应特点 有机物碳骨架不变,官能团由—X变为或 有机物碳骨架不变,官能团由—X变为—OH
主要产物 烯烃或炔烃 醇(或酚)
[特别提醒]
(1);
(2)。
4.卤代烃中卤素原子的检验
(1)实验流程
R—X
(2)实验要点
①通过水解反应或消去反应将卤素原子转化为卤素离子。
②加热是为了加快水解速率。
③加入稀HNO3酸化,一是为了中和过量的NaOH,防止NaOH与AgNO3反应干扰实验;二是检验生成的沉淀是否溶于稀HNO3。
1.下列化合物既能发生消去反应生成烯烃,又能发生水解反应的有 ( )
① ②(CH3)3CCH2Cl
③(CH3)2CHCH2Cl ④CHCl2—CHBr2
⑤
A.①③ B.②④
C.③⑤ D.②③
2.为了检验2-溴丁烷中含有溴元素,有以下操作,顺序合理的是 ( )
①加AgNO3溶液 ②加NaOH水溶液
③加热 ④加蒸馏水 ⑤加稀硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③
C.②③⑤① D.②①⑤③
3.要检验卤代烃中是否含有溴元素,正确的实验方法是 ( )
A.加入氯水振荡,观察上层是否有红棕色
B.滴加稀硝酸酸化的硝酸银溶液,观察有无淡黄色沉淀生成
C.滴加NaOH溶液共热,然后加入稀硝酸酸化,最后滴加硝酸银溶液,观察有无淡黄色沉淀生成
D.滴加NaOH溶液共热,冷却后滴加硝酸银溶液,观察有无淡黄色沉淀生成
4.用下列实验装置分别验证溴乙烷(沸点38.4 ℃)在不同条件下反应的产物和反应类型。
实验 Ⅰ 向圆底烧瓶中加入15 mL NaOH水溶液;
实验 Ⅱ 向圆底烧瓶中加入15 mL 乙醇和2 g NaOH。
下列说法中错误的是 ( )
A.应采用水浴加热进行实验
B.实验 Ⅱ 可用溴水代替KMnO4溶液,同时省去装置②
C.可用1H核磁共振谱检验Ⅰ中分离提纯后的产物
D.分别向 Ⅰ、Ⅱ 反应后溶液中加入AgNO3溶液,都会产生淡黄色沉淀
二、卤代烃的合理使用
1.使用
(1)用于化工生产、 生产及日常生活中。如选取邻二氯苯为原料,经硝化、氟代、还原、缩合、水解等一系列反应,可合成治疗敏感菌引起的各类感染的“ ”。
(2)溴乙烷是合成药物、农药、染料、香料的重要基础原料,是向有机物分子引入 的重要试剂。
(3)卤代烃除了用于合成药物,还是制备 的原料。氯乙烯是 (PVC)的单体,PVC曾是世界上产量最大的 ,常用于建筑材料、工业制品、地板革、地板砖、人造革、管材、包装膜等。
2.危害
(1) 是人类合成的第一种有机农药。DDT相当 ,能在自然界滞留较长时间,可以在动物体内形成累积性残留,给人体健康和生态环境造成不利影响。
(2)氟氯代烃——人吸入这些气体后会引起神经中枢甚至内脏器官不同程度的中毒反应,挥发性卤代烃有可能造成大气的二次污染,是造成“ ”的罪魁祸首。
3.卤代烃破坏臭氧层原理
氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。
1.马里奥·莫利纳等科学家通过研究提示了大气中臭氧层被破坏的机理,如图所示。下列说法错误的是 ( )
A.CFCl3是四面体结构
B.过程Ⅲ中的O原子可能来自大气中O2或O3的解离
C.整个过程中,CFCl3是O3分解的催化剂
D.紫外线辐射提供破坏化学键的能量
2.卤代烃在生产、生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是 。工业上分离这些多氯代甲烷的方法是 。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构式 (不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如图所示:
乙烯1,2-二氯乙烷氯乙烯聚氯乙烯
反应①的化学方程式为 ,
反应类型为 ;反应②的反应类型为 。
三、卤代烃在有机合成中的重要作用
卤代烃的化学性质比较活泼,能发生许多反应,例如取代反应、消去反应等,从而转化成其他类型的化合物。因此,引入卤原子常常是改变分子性能的第一步反应,在有机合成中起着重要的桥梁作用。
1.卤代烃在合成中的桥梁作用
2.格氏试剂在有机合成中的应用
3.在有机合成中引入卤素原子的方法
(1)不饱和烃与卤素单质、卤化氢等的加成反应
如CH3—CH==CH2+Br2—→CH3CHBrCH2Br。
(2)取代反应
如乙烷与Cl2:CH3CH3+Cl2CH3CH2Cl+HCl,
苯与Br2:+Br2+HBr;
在有机合成中引入卤素原子或引入卤素原子作中间产物,用加成反应而不用取代反应,因为光照下卤代反应产物无法控制,得到的产品纯度低。
4.应用举例
(1)在烃分子中引入羟基
如由乙烯制乙二醇:
CH2==CH2CH2BrCH2BrCH2OHCH2OH。
(2)在特定碳原子上引入卤原子
如由1-溴丙烷制取1,2-二溴丙烷:
CH3—CH2—CH2BrCH3—CH==CH2CH3—CHBr—CH2Br。
(3)改变某些官能团的位置
例如由1-丁烯制取2-丁烯:
CH3—CH2—CH==CH2
CH3—CH==CH—CH3。
(4)增长碳链或构成碳环
例如卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烃在乙醚的存在下与金属镁作用,生成的有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃。
RX+MgRMgX,CH2==CHCH2Cl+RMgCl—→CH2==CHCH2R+MgCl2。
1.卤代烃能发生下列反应2CH3CH2Br+2Na—→CH3CH2CH2CH3+2NaBr。下列有机物可以合成环己烷的是 ( )
A.CH3CH2CH2Br
B.CH3CHBrCH2Br
C.CH3CHBrCH2CH2CH2CH2Br
D.CH2BrCH2CH2CH2CH2CH2Br
2.由2-氯丙烷制取少量1,2-丙二醇()时,需要经过下列哪几步反应 ( )
A.加成反应→消去反应→取代反应
B.消去反应→加成反应→消去反应
C.消去反应→加成反应→取代反应
D.取代反应→消去反应→加成反应
3.根据下面的反应路线及所给信息填空。
A(一氯环己烷)B
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ;③的反应类型是 。
(3)反应④的化学方程式是 。
1.下列关于卤代烃的叙述错误的是 ( )
A.随着碳原子数的增多,一氯代烃的沸点逐渐升高
B.随着碳原子数的增多,一氯代烃的密度逐渐增大
C.等碳原子数的一氯代烃,支链越多,沸点越低
D.等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高
2.在卤代烃R—CH2—CH2—X中化学键如图所示,则下列说法正确的是 ( )
A.当该卤代烃发生水解反应时,被破坏的键是①和③
B.当该卤代烃发生消去反应时,被破坏的键是①和④
C.当该卤代烃发生水解反应时,被破坏的键是①
D.当该卤代烃发生消去反应时,被破坏的键是①和②
3.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,例如:CH3Br+OH-(或NaOH)—→CH3OH+Br-(或NaBr)(反应条件已略去),下列反应的化学方程式中,不正确的是 ( )
A.CH3CH2Br+NaHS—→CH3CH2SH+NaBr
B.CH3I+NaCN—→CH3CN+NaI
C.CH3CH2Cl+CH3ONa—→CH3Cl+CH3CH2ONa
D.CH3CH2Cl+NH3—→ CH3CH2NH2+HCl
4.用如图装置研究1-溴丙烷是否发生消去反应,下列叙述正确的是 ( )
A.②中溶液褪色,是因为其中发生了取代反应
B.②中溶液褪色,可证明1-溴丙烷发生消去反应
C.将②中试剂换成酸性高锰酸钾溶液,可通过现象证明1-溴丙烷发生消去反应
D.向反应后①试管中加入少量AgNO3溶液,可通过现象证明1-溴丙烷发生消去反应
5.有如图所示合成路线:
ABC
(1)上述过程中属于加成反应的有 (填数字序号)。
(2)反应②的化学方程式为 。
(3)反应④为 反应,化学方程式为 。
卤代烃
一、
1.(1)卤素原子 (2)烷烃 烯烃、 芳香烃 多卤代烃
2.(1)一氯甲烷 氯乙烷 氯乙烯 (2)升高 (3)一氟代物 一氯代物 大 (4)不溶 能溶 二氯甲烷 氯仿(CHCl3) 四氯化碳 3.(1)褪色 CH3CH2CH2Br+KOH CH3CH==CH2↑+KBr+H2O
(2)Br- C—Br C—O 取代反应
对点训练
1.C [连接卤原子的碳原子相邻碳原子上含有H原子的卤代烃能发生消去反应,大多数卤代烃都能发生水解反应。①②能发生水解反应但不能发生消去反应,故错误;③⑤能发生水解反应且能发生消去反应生成烯烃,故正确;④能发生水解反应,但发生消去反应生成卤代烃,故错误。]
2.C [2-溴丁烷中的溴元素不是以离子状态存在的,不能与AgNO3溶液直接反应,因此,必须先使它变为溴离子。由题意可知,应先使2-溴丁烷在强碱的水溶液中水解得到溴离子,但反应后溶液显碱性,不能直接加入AgNO3溶液检验,否则Ag+与OH-反应生成AgOH,而AgOH不稳定,分解生成Ag2O沉淀,影响溴离子的检验,故需加入足量稀硝酸使溶液呈酸性,再加AgNO3溶液检验。]
3.C [忽略卤代烃为非电解质,无法电离出卤素离子而错选B;忽略用稀硝酸酸化,而错选D。因为卤代烃水解后的溶液呈碱性,而在碱性环境下不能用AgNO3直接检验卤素离子,故检验卤代烃中卤素种类的正确方法为先通过水解产生卤素离子,再加入稀硝酸酸化,最后加入硝酸银溶液。]
4.D [要验证溴乙烷在不同条件下发生的反应,由于溴乙烷沸点是38.4 ℃,为防止由于加热温度过高导致反应物的挥发,实验时可通过水浴加热方式进行,A正确;在实验 Ⅱ 中溴乙烷与NaOH乙醇溶液共热发生消去反应产生乙烯,通过试管②中的水可除去挥发的乙醇,产生的乙烯能够被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,能够与溴水发生加成反应使溴水褪色。由于乙醇不能与溴水发生反应,故也可用溴水代替KMnO4溶液,同时省去装置②,B正确;溴乙烷、NaOH的水溶液共热发生取代反应产生乙醇,结构简式是CH3CH2OH,分子中含有三种不同位置的H原子,个数比是3∶2∶1,可以用1H核磁共振谱检验 Ⅰ 中分离提纯后的产物,C正确; NaOH会与AgNO3溶液反应产生AgOH白色沉淀,因此检验时应该先加入硝酸酸化,然后再加入AgNO3溶液进行检验,D错误。]
二、
1.(1)药物 诺氟沙星 (2)乙基 (3)高聚物 聚氯乙烯 通用塑料 2.(1)DDT 稳定 (2)臭氧层破坏
对点训练
1.C [过程Ⅰ为CFCl3Cl+CFCl2,过程Ⅱ为Cl+O3O2+ClO,过程Ⅲ为ClO+OO2+Cl。CH4是正四面体结构,CFCl3就相当于用1个F将1个H原子替代,用3个Cl将3个H原子替代,虽然键长、键角有变化,但是还是四面体结构,A正确;由分析可知,过程Ⅲ中的O原子可能来自大气中O2或O3的解离,B正确;CFCl3作为反应物被消耗,CFCl3不是O3分解的催化剂,C错误;断键需要吸收能量,由图可知,紫外线辐射提供能量破坏了C—Cl,D正确。]
2.(1)四氯化碳(或CCl4) 分馏
(2)、、
(3)CH2==CH2+Cl2CH2ClCH2Cl 加成反应 消去反应
解析 (1)四氯化碳的结构是正四面体;甲烷的多氯取代物的组成和结构相似,随着相对分子质量的增大,物质的沸点逐渐升高,可以利用它们之间沸点的差异,采取分馏法进行分离。(2)将F、Cl、Br三种原子的位置互换,可以写出三种同分异构体、、。(3)乙烯(CH2==CH2)转化成1,2-二氯乙烷(CH2ClCH2Cl)的反应属于加成反应,则化学方程式CH2==CH2+Cl2CH2ClCH2Cl,1,2-二氯乙烷转化成氯乙烯(CH2==CHCl)的反应属于卤代烃的消去反应。
三、
对点训练
1.D [由已知反应可知,CH3CH2CH2Br与钠反应生成CH3CH2CH2CH2CH2CH3,故A错误;CH3CHBrCH2Br与钠反应可生成,故B错误; CH3CHBrCH2CH2CH2CH2Br与钠反应可生成,故C错误;由反应方程式推测可知+2Na+2NaBr,故D正确。]
2.C [由2-氯丙烷制取少量的1,2-丙二醇,可用逆推法判断:CH3CHOHCH2OH→CH3CHBrCH2Br→CH3CH==CH2→CH3CHClCH3,则2-氯丙烷应首先发生消去反应生成CH3CH==CH2,CH3CH==CH2发生加成反应生成CH3CHBrCH2Br,
CH3CHBrCH2Br发生取代反应可生成1,2-丙二醇。]
3.(1) 环己烷 (2)取代反应 加成反应
(3)+2NaOH+2NaBr+2H2O
解析 由A可知,为A发生取代反应的产物,所以A为环己烷(),又分子中含有双键,故可与Br2的CCl4溶液发生加成反应而生成B,反应方程式为+Br2,比较B与的结构可知,B应发生消去反应而得到,化学方程式为+2NaOH+2NaBr+2H2O。
课堂达标训练
1.B [随着碳原子数的增多,一氯代烃的沸点逐渐升高,A项正确;随着碳原子数的增多,一氯代烃的密度逐渐减小,B项错误;等碳原子数的一氯代烃,支链越多,分子间距离越大,分子间作用力越小,沸点越低,C项正确;等碳原子数的一卤代烃,卤素的原子序数越大,分子间作用力越大,沸点越高,D项正确。]
2.C [发生取代反应时,卤代烃中的卤素原子被取代被破坏的键是①,A错误,C正确;发生消去反应时,卤代烃中的卤素原子和相邻碳原子上的氢原子脱去生成HX,被破坏的键是①和③,B、D错误。]
3.C [NaHS中HS-带负电荷,取代溴代烃中的溴原子,故A正确;NaCN中CN-带负电荷,取代碘代烃中的碘原子,故B正确;CH3ONa中CH3O-带负电荷,取代氯代烃中的氯原子,故C错误;NH3中N带负电荷,取代氯代烃中的氯原子,故D正确。]
4.B [CH3CH2CH2Br可能发生取代反应:
CH3CH2CH2Br+NaOHCH3CH2CH2OH+NaBr,或消去反应:CH3CH2CH2Br+NaOH→CH3CH==CH2+H2O+NaBr,l-丙醇不能使溴的CCl4溶液褪色,丙烯可以使溴的CCl4溶液褪色。②中溶液褪色,是因为丙烯与溴发生了加成反应,故A错误;1-丙醇不能使溴的CCl4溶液褪色,溴的CCl4溶液褪色是因为生成的烯烃与溴发生了加成反应,证明1-溴丙烷发生了消去反应,故B正确;挥发的醇及生成的烯烃均能使酸性高锰酸钾溶液褪色,则根据现象不能说明①中发生消去反应,故C错误;①试管中加入少量AgNO3溶液,会生成Ag2O黑色沉淀通过现象无法证明是否发生消去反应,故D错误。]
5.(1)①③⑤
(2)+2NaOH2NaBr+2H2O+
(3)取代(或水解) +2NaOH2NaBr+
解析 环己烯与溴发生加成反应,生成1,2-二溴环己烷;1,2-二溴环己烷在氢氧化钠醇溶液中加热,发生消去反应,生成1,3-环己二烯();1,3-环己二烯再与溴发生共轭二烯烃的1,4-加成反应,得生成物;根据卤代烃在氢氧化钠水溶液中发生水解反应生成醇的性质,由可得到,再通过加氢得最终产物。
学习目标 1.认识卤代烃的组成和结构特点、性质、转化关系及其在生产、生活中的重要应用。2.能举例说明卤代烃在有机合成中的重要应用,体会“绿色化学”思想在有机合成中的重要意义,关注有机化合物的安全使用。
一、卤代烃的性质
1.卤代烃的概念和分类
(1)概念
烃分子中的氢原子被 取代后形成的化合物,可用通式RX表示。
(2)分类
2.卤代烃的物理性质
(1)状态:常温下除 、 、 等少数为气体外,其余多为液体或固体。
(2)沸点:互为同系物的一卤代直链烷烃,它们的沸点随碳原子数的增多而 。
(3)密度:除脂肪烃的 和 外,液态卤代烃密度一般比水 。
(4)溶解性:水中: ,有机溶剂中: ,某些卤代烃是很好的有机溶剂,如 、 和 等。
3.卤代烃的化学性质
(1)消去反应的实验探究
[实验装置]
[实验现象] 反应产生的气体经水洗后,使酸性KMnO4溶液 。
[实验结论] 生成的气体分子中含有碳碳不饱和键。
[实验解释] 1-溴丙烷与氢氧化钾醇溶液共热反应,化学方程式为
。
(2)取代反应(水解反应)的实验探究
[实验装置]
[实验现象] ①中溶液分层,②中有机层厚度减小,直至消失,④中有浅黄色沉淀生成。
[实验结论] 2-溴丙烷与KOH溶液共热产生了 。
[实验解释]
①2-溴丙烷与氢氧化钾溶液共热时断裂的是 ,水中的羟基与碳原子形成 ,断下的Br与水中的H结合成HBr。
②2-溴丙烷与KOH水溶液共热反应的化学方程式为
+KOH+KBr,反应类型为 。
(3)卤代烃的消去反应和水解反应比较
卤代烃在官能团碳卤键的作用下化学性质较活泼,在其他试剂作用下,碳卤键很容易断裂而发生水解反应和消去反应。
消去反应 水解反应
反应条件 NaOH醇溶液,加热 NaOH水溶液、加热
实质 失去HX分子,形成不饱和键 —X被—OH取代
键的 变化 C—X与C—H断裂形成或 与H—X C—X断裂形成C—OH
卤代烃的 结构特点 (1)没有邻位碳原子的卤代烃不能发生消去反应。 (2)有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。如、(CH3)3CCH2Br。 (3)有两个邻位碳原子,且碳原子上均有氢原子时,若不对称则消去反应可能生成两种产物。如:发生消去反应的产物为 CH2==CH—CH2—CH3或CH3—CH==CH—CH3。 (4)二元卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。如CH3—CH2CHCl2生成CH3—C≡CH 含有—X的卤代烃绝大多数都可以水解
化学反 应特点 有机物碳骨架不变,官能团由—X变为或 有机物碳骨架不变,官能团由—X变为—OH
主要产物 烯烃或炔烃 醇(或酚)
[特别提醒]
(1);
(2)。
4.卤代烃中卤素原子的检验
(1)实验流程
R—X
(2)实验要点
①通过水解反应或消去反应将卤素原子转化为卤素离子。
②加热是为了加快水解速率。
③加入稀HNO3酸化,一是为了中和过量的NaOH,防止NaOH与AgNO3反应干扰实验;二是检验生成的沉淀是否溶于稀HNO3。
1.下列化合物既能发生消去反应生成烯烃,又能发生水解反应的有 ( )
① ②(CH3)3CCH2Cl
③(CH3)2CHCH2Cl ④CHCl2—CHBr2
⑤
A.①③ B.②④
C.③⑤ D.②③
2.为了检验2-溴丁烷中含有溴元素,有以下操作,顺序合理的是 ( )
①加AgNO3溶液 ②加NaOH水溶液
③加热 ④加蒸馏水 ⑤加稀硝酸至溶液显酸性
A.②①③⑤ B.②④⑤③
C.②③⑤① D.②①⑤③
3.要检验卤代烃中是否含有溴元素,正确的实验方法是 ( )
A.加入氯水振荡,观察上层是否有红棕色
B.滴加稀硝酸酸化的硝酸银溶液,观察有无淡黄色沉淀生成
C.滴加NaOH溶液共热,然后加入稀硝酸酸化,最后滴加硝酸银溶液,观察有无淡黄色沉淀生成
D.滴加NaOH溶液共热,冷却后滴加硝酸银溶液,观察有无淡黄色沉淀生成
4.用下列实验装置分别验证溴乙烷(沸点38.4 ℃)在不同条件下反应的产物和反应类型。
实验 Ⅰ 向圆底烧瓶中加入15 mL NaOH水溶液;
实验 Ⅱ 向圆底烧瓶中加入15 mL 乙醇和2 g NaOH。
下列说法中错误的是 ( )
A.应采用水浴加热进行实验
B.实验 Ⅱ 可用溴水代替KMnO4溶液,同时省去装置②
C.可用1H核磁共振谱检验Ⅰ中分离提纯后的产物
D.分别向 Ⅰ、Ⅱ 反应后溶液中加入AgNO3溶液,都会产生淡黄色沉淀
二、卤代烃的合理使用
1.使用
(1)用于化工生产、 生产及日常生活中。如选取邻二氯苯为原料,经硝化、氟代、还原、缩合、水解等一系列反应,可合成治疗敏感菌引起的各类感染的“ ”。
(2)溴乙烷是合成药物、农药、染料、香料的重要基础原料,是向有机物分子引入 的重要试剂。
(3)卤代烃除了用于合成药物,还是制备 的原料。氯乙烯是 (PVC)的单体,PVC曾是世界上产量最大的 ,常用于建筑材料、工业制品、地板革、地板砖、人造革、管材、包装膜等。
2.危害
(1) 是人类合成的第一种有机农药。DDT相当 ,能在自然界滞留较长时间,可以在动物体内形成累积性残留,给人体健康和生态环境造成不利影响。
(2)氟氯代烃——人吸入这些气体后会引起神经中枢甚至内脏器官不同程度的中毒反应,挥发性卤代烃有可能造成大气的二次污染,是造成“ ”的罪魁祸首。
3.卤代烃破坏臭氧层原理
氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。
1.马里奥·莫利纳等科学家通过研究提示了大气中臭氧层被破坏的机理,如图所示。下列说法错误的是 ( )
A.CFCl3是四面体结构
B.过程Ⅲ中的O原子可能来自大气中O2或O3的解离
C.整个过程中,CFCl3是O3分解的催化剂
D.紫外线辐射提供破坏化学键的能量
2.卤代烃在生产、生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是 。工业上分离这些多氯代甲烷的方法是 。
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构式 (不考虑立体异构)。
(3)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如图所示:
乙烯1,2-二氯乙烷氯乙烯聚氯乙烯
反应①的化学方程式为 ,
反应类型为 ;反应②的反应类型为 。
三、卤代烃在有机合成中的重要作用
卤代烃的化学性质比较活泼,能发生许多反应,例如取代反应、消去反应等,从而转化成其他类型的化合物。因此,引入卤原子常常是改变分子性能的第一步反应,在有机合成中起着重要的桥梁作用。
1.卤代烃在合成中的桥梁作用
2.格氏试剂在有机合成中的应用
3.在有机合成中引入卤素原子的方法
(1)不饱和烃与卤素单质、卤化氢等的加成反应
如CH3—CH==CH2+Br2—→CH3CHBrCH2Br。
(2)取代反应
如乙烷与Cl2:CH3CH3+Cl2CH3CH2Cl+HCl,
苯与Br2:+Br2+HBr;
在有机合成中引入卤素原子或引入卤素原子作中间产物,用加成反应而不用取代反应,因为光照下卤代反应产物无法控制,得到的产品纯度低。
4.应用举例
(1)在烃分子中引入羟基
如由乙烯制乙二醇:
CH2==CH2CH2BrCH2BrCH2OHCH2OH。
(2)在特定碳原子上引入卤原子
如由1-溴丙烷制取1,2-二溴丙烷:
CH3—CH2—CH2BrCH3—CH==CH2CH3—CHBr—CH2Br。
(3)改变某些官能团的位置
例如由1-丁烯制取2-丁烯:
CH3—CH2—CH==CH2
CH3—CH==CH—CH3。
(4)增长碳链或构成碳环
例如卤代烃能与多种金属作用,生成金属有机化合物,其中格氏试剂是金属有机化合物中最重要的一类化合物,是有机合成中非常重要的试剂之一,它是卤代烃在乙醚的存在下与金属镁作用,生成的有机镁化合物,再与活泼的卤代烃反应,生成更长碳链的烃。
RX+MgRMgX,CH2==CHCH2Cl+RMgCl—→CH2==CHCH2R+MgCl2。
1.卤代烃能发生下列反应2CH3CH2Br+2Na—→CH3CH2CH2CH3+2NaBr。下列有机物可以合成环己烷的是 ( )
A.CH3CH2CH2Br
B.CH3CHBrCH2Br
C.CH3CHBrCH2CH2CH2CH2Br
D.CH2BrCH2CH2CH2CH2CH2Br
2.由2-氯丙烷制取少量1,2-丙二醇()时,需要经过下列哪几步反应 ( )
A.加成反应→消去反应→取代反应
B.消去反应→加成反应→消去反应
C.消去反应→加成反应→取代反应
D.取代反应→消去反应→加成反应
3.根据下面的反应路线及所给信息填空。
A(一氯环己烷)B
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ;③的反应类型是 。
(3)反应④的化学方程式是 。
1.下列关于卤代烃的叙述错误的是 ( )
A.随着碳原子数的增多,一氯代烃的沸点逐渐升高
B.随着碳原子数的增多,一氯代烃的密度逐渐增大
C.等碳原子数的一氯代烃,支链越多,沸点越低
D.等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高
2.在卤代烃R—CH2—CH2—X中化学键如图所示,则下列说法正确的是 ( )
A.当该卤代烃发生水解反应时,被破坏的键是①和③
B.当该卤代烃发生消去反应时,被破坏的键是①和④
C.当该卤代烃发生水解反应时,被破坏的键是①
D.当该卤代烃发生消去反应时,被破坏的键是①和②
3.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,例如:CH3Br+OH-(或NaOH)—→CH3OH+Br-(或NaBr)(反应条件已略去),下列反应的化学方程式中,不正确的是 ( )
A.CH3CH2Br+NaHS—→CH3CH2SH+NaBr
B.CH3I+NaCN—→CH3CN+NaI
C.CH3CH2Cl+CH3ONa—→CH3Cl+CH3CH2ONa
D.CH3CH2Cl+NH3—→ CH3CH2NH2+HCl
4.用如图装置研究1-溴丙烷是否发生消去反应,下列叙述正确的是 ( )
A.②中溶液褪色,是因为其中发生了取代反应
B.②中溶液褪色,可证明1-溴丙烷发生消去反应
C.将②中试剂换成酸性高锰酸钾溶液,可通过现象证明1-溴丙烷发生消去反应
D.向反应后①试管中加入少量AgNO3溶液,可通过现象证明1-溴丙烷发生消去反应
5.有如图所示合成路线:
ABC
(1)上述过程中属于加成反应的有 (填数字序号)。
(2)反应②的化学方程式为 。
(3)反应④为 反应,化学方程式为 。
卤代烃
一、
1.(1)卤素原子 (2)烷烃 烯烃、 芳香烃 多卤代烃
2.(1)一氯甲烷 氯乙烷 氯乙烯 (2)升高 (3)一氟代物 一氯代物 大 (4)不溶 能溶 二氯甲烷 氯仿(CHCl3) 四氯化碳 3.(1)褪色 CH3CH2CH2Br+KOH CH3CH==CH2↑+KBr+H2O
(2)Br- C—Br C—O 取代反应
对点训练
1.C [连接卤原子的碳原子相邻碳原子上含有H原子的卤代烃能发生消去反应,大多数卤代烃都能发生水解反应。①②能发生水解反应但不能发生消去反应,故错误;③⑤能发生水解反应且能发生消去反应生成烯烃,故正确;④能发生水解反应,但发生消去反应生成卤代烃,故错误。]
2.C [2-溴丁烷中的溴元素不是以离子状态存在的,不能与AgNO3溶液直接反应,因此,必须先使它变为溴离子。由题意可知,应先使2-溴丁烷在强碱的水溶液中水解得到溴离子,但反应后溶液显碱性,不能直接加入AgNO3溶液检验,否则Ag+与OH-反应生成AgOH,而AgOH不稳定,分解生成Ag2O沉淀,影响溴离子的检验,故需加入足量稀硝酸使溶液呈酸性,再加AgNO3溶液检验。]
3.C [忽略卤代烃为非电解质,无法电离出卤素离子而错选B;忽略用稀硝酸酸化,而错选D。因为卤代烃水解后的溶液呈碱性,而在碱性环境下不能用AgNO3直接检验卤素离子,故检验卤代烃中卤素种类的正确方法为先通过水解产生卤素离子,再加入稀硝酸酸化,最后加入硝酸银溶液。]
4.D [要验证溴乙烷在不同条件下发生的反应,由于溴乙烷沸点是38.4 ℃,为防止由于加热温度过高导致反应物的挥发,实验时可通过水浴加热方式进行,A正确;在实验 Ⅱ 中溴乙烷与NaOH乙醇溶液共热发生消去反应产生乙烯,通过试管②中的水可除去挥发的乙醇,产生的乙烯能够被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,能够与溴水发生加成反应使溴水褪色。由于乙醇不能与溴水发生反应,故也可用溴水代替KMnO4溶液,同时省去装置②,B正确;溴乙烷、NaOH的水溶液共热发生取代反应产生乙醇,结构简式是CH3CH2OH,分子中含有三种不同位置的H原子,个数比是3∶2∶1,可以用1H核磁共振谱检验 Ⅰ 中分离提纯后的产物,C正确; NaOH会与AgNO3溶液反应产生AgOH白色沉淀,因此检验时应该先加入硝酸酸化,然后再加入AgNO3溶液进行检验,D错误。]
二、
1.(1)药物 诺氟沙星 (2)乙基 (3)高聚物 聚氯乙烯 通用塑料 2.(1)DDT 稳定 (2)臭氧层破坏
对点训练
1.C [过程Ⅰ为CFCl3Cl+CFCl2,过程Ⅱ为Cl+O3O2+ClO,过程Ⅲ为ClO+OO2+Cl。CH4是正四面体结构,CFCl3就相当于用1个F将1个H原子替代,用3个Cl将3个H原子替代,虽然键长、键角有变化,但是还是四面体结构,A正确;由分析可知,过程Ⅲ中的O原子可能来自大气中O2或O3的解离,B正确;CFCl3作为反应物被消耗,CFCl3不是O3分解的催化剂,C错误;断键需要吸收能量,由图可知,紫外线辐射提供能量破坏了C—Cl,D正确。]
2.(1)四氯化碳(或CCl4) 分馏
(2)、、
(3)CH2==CH2+Cl2CH2ClCH2Cl 加成反应 消去反应
解析 (1)四氯化碳的结构是正四面体;甲烷的多氯取代物的组成和结构相似,随着相对分子质量的增大,物质的沸点逐渐升高,可以利用它们之间沸点的差异,采取分馏法进行分离。(2)将F、Cl、Br三种原子的位置互换,可以写出三种同分异构体、、。(3)乙烯(CH2==CH2)转化成1,2-二氯乙烷(CH2ClCH2Cl)的反应属于加成反应,则化学方程式CH2==CH2+Cl2CH2ClCH2Cl,1,2-二氯乙烷转化成氯乙烯(CH2==CHCl)的反应属于卤代烃的消去反应。
三、
对点训练
1.D [由已知反应可知,CH3CH2CH2Br与钠反应生成CH3CH2CH2CH2CH2CH3,故A错误;CH3CHBrCH2Br与钠反应可生成,故B错误; CH3CHBrCH2CH2CH2CH2Br与钠反应可生成,故C错误;由反应方程式推测可知+2Na+2NaBr,故D正确。]
2.C [由2-氯丙烷制取少量的1,2-丙二醇,可用逆推法判断:CH3CHOHCH2OH→CH3CHBrCH2Br→CH3CH==CH2→CH3CHClCH3,则2-氯丙烷应首先发生消去反应生成CH3CH==CH2,CH3CH==CH2发生加成反应生成CH3CHBrCH2Br,
CH3CHBrCH2Br发生取代反应可生成1,2-丙二醇。]
3.(1) 环己烷 (2)取代反应 加成反应
(3)+2NaOH+2NaBr+2H2O
解析 由A可知,为A发生取代反应的产物,所以A为环己烷(),又分子中含有双键,故可与Br2的CCl4溶液发生加成反应而生成B,反应方程式为+Br2,比较B与的结构可知,B应发生消去反应而得到,化学方程式为+2NaOH+2NaBr+2H2O。
课堂达标训练
1.B [随着碳原子数的增多,一氯代烃的沸点逐渐升高,A项正确;随着碳原子数的增多,一氯代烃的密度逐渐减小,B项错误;等碳原子数的一氯代烃,支链越多,分子间距离越大,分子间作用力越小,沸点越低,C项正确;等碳原子数的一卤代烃,卤素的原子序数越大,分子间作用力越大,沸点越高,D项正确。]
2.C [发生取代反应时,卤代烃中的卤素原子被取代被破坏的键是①,A错误,C正确;发生消去反应时,卤代烃中的卤素原子和相邻碳原子上的氢原子脱去生成HX,被破坏的键是①和③,B、D错误。]
3.C [NaHS中HS-带负电荷,取代溴代烃中的溴原子,故A正确;NaCN中CN-带负电荷,取代碘代烃中的碘原子,故B正确;CH3ONa中CH3O-带负电荷,取代氯代烃中的氯原子,故C错误;NH3中N带负电荷,取代氯代烃中的氯原子,故D正确。]
4.B [CH3CH2CH2Br可能发生取代反应:
CH3CH2CH2Br+NaOHCH3CH2CH2OH+NaBr,或消去反应:CH3CH2CH2Br+NaOH→CH3CH==CH2+H2O+NaBr,l-丙醇不能使溴的CCl4溶液褪色,丙烯可以使溴的CCl4溶液褪色。②中溶液褪色,是因为丙烯与溴发生了加成反应,故A错误;1-丙醇不能使溴的CCl4溶液褪色,溴的CCl4溶液褪色是因为生成的烯烃与溴发生了加成反应,证明1-溴丙烷发生了消去反应,故B正确;挥发的醇及生成的烯烃均能使酸性高锰酸钾溶液褪色,则根据现象不能说明①中发生消去反应,故C错误;①试管中加入少量AgNO3溶液,会生成Ag2O黑色沉淀通过现象无法证明是否发生消去反应,故D错误。]
5.(1)①③⑤
(2)+2NaOH2NaBr+2H2O+
(3)取代(或水解) +2NaOH2NaBr+
解析 环己烯与溴发生加成反应,生成1,2-二溴环己烷;1,2-二溴环己烷在氢氧化钠醇溶液中加热,发生消去反应,生成1,3-环己二烯();1,3-环己二烯再与溴发生共轭二烯烃的1,4-加成反应,得生成物;根据卤代烃在氢氧化钠水溶液中发生水解反应生成醇的性质,由可得到,再通过加氢得最终产物。
