天津市2024-2025学年高二上学期12月阶段性质量监测(二)化学试题(无答案)
文档属性
| 名称 | 天津市2024-2025学年高二上学期12月阶段性质量监测(二)化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 463.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 00:12:41 | ||
图片预览


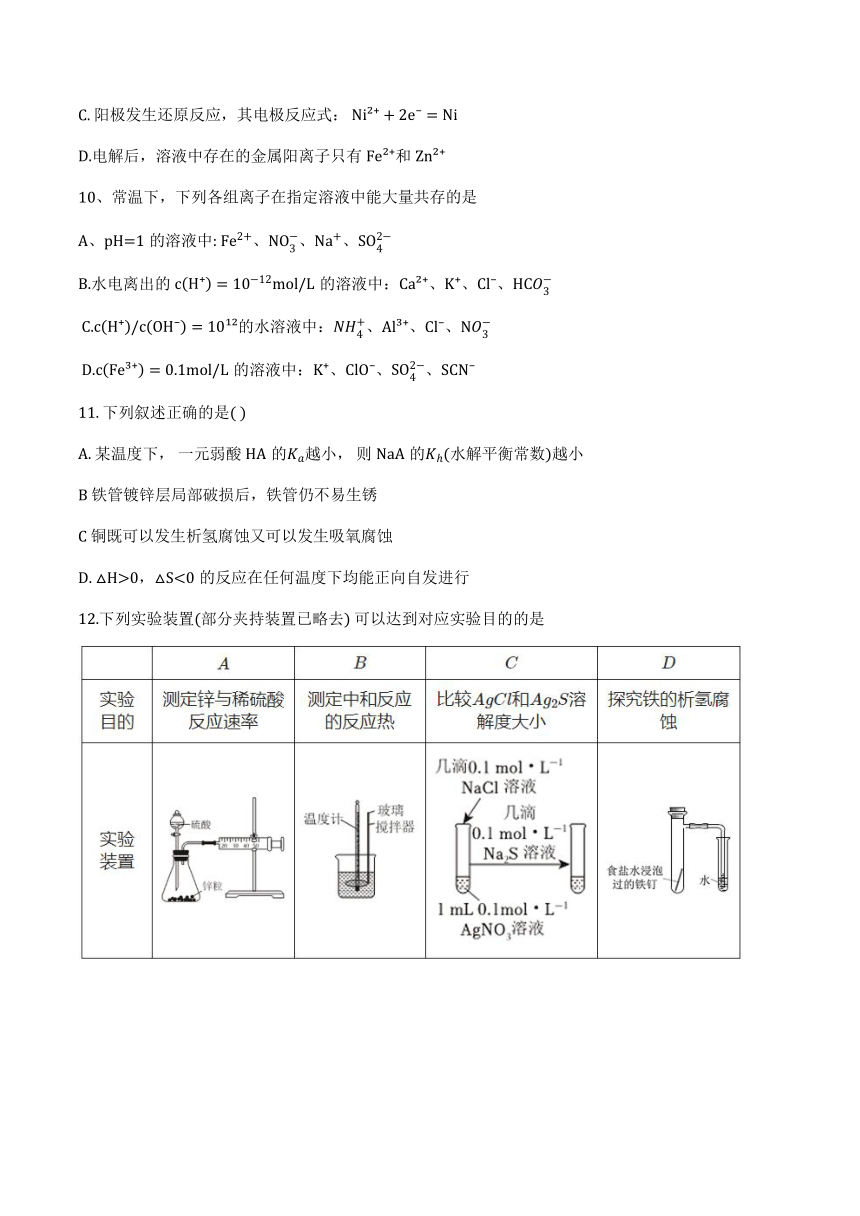
文档简介
2024~2025学年度第一学期阶段性质量监测(二)
高二年级 化学学科
第Ⅰ卷(选择题, 共 45分)
可能用到的相对原子质量:H1 C12 N14 O16 Cu64 Zn65
一、选择题(本题包括 15小题,每小题 3分,共45分。每小题只有一个选项符合题意)
1. 下列各基态原子或离子的电子排布式正确的是
B. O 1s 2s 2p
C. Cu 1s 2s 2p 3s 3p 3d 4s
2.下列叙述正确的是( )
A. 可能存在核外电子排布式为的基态原子
B. 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反
C. 1个原子轨道里最多容纳2个电子,且自旋方向相同
D. 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量
B.下列溶液一定呈中性的是
A. pH=7的溶液 的溶液
C. 非电解质溶于水得到的溶液 D. 由强酸、强碱等物质的量反应得到的溶液
4. 将下列各物质加入水中,对水的电离平衡几乎无影响的是
A. Ca B. Nal C. NaHSO D. KAl(SO )
5. 高铁电池是 种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述不正确的是( )
A 放电时负极反应为:3Zn-6e +6OH =-3Zn(OH)
B. 放电时正极反应为:
C. 放电时每转移3 mol电子, 正极有1mol K FeO 被氧化
D. 放电时正极附近溶液的碱性增强
6.如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
A. a处得到的是浓NaOH溶液
B. 适当降低阳极电解液的pH有利于 逸出
C. 粗盐水中含有的少量Ca 和Mg 可用NaOH除去
D.若电路中通过0.2mol电子,理论上可在b处得到标准状况下1.12L气体
7 下列关于沉淀溶解平衡的判断正确的是
A 某离子被沉淀完全是指该离子在溶液中的浓度为0
B.向饱和AgCl水溶液中加入NaCl固体, 值变大
C. 向 Mg(OH) 悬浊液中滴加FeCl 溶液, 生成红褐色沉淀
D.含有AgCl和AgI固体的悬浊液:
8.某温度下,将 pH和体积均相同的 HCl和CH COOH溶液分别加水稀释,其 pH随加水体积的变化如图所示。下列叙述不正确的是
A.溶液中水的电离程度:b点B.曲线Ⅱ表示的是 CH COOH稀释的过程
C.稀释前溶液的浓度:
D. 从 b点到 d点, 溶液中 c()c()逐渐增大
9.金属镍有广泛的用途。粗镍中含有少量 Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性
A. 电解后,电解槽底部的阳极泥中含有 Cu和Pt
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C. 阳极发生还原反应,其电极反应式:
D.电解后,溶液中存在的金属阳离子只有Fe 和Zn
10、常温下,下列各组离子在指定溶液中能大量共存的是
A、pH=1的溶液中:
B.水电离出的的溶液中:Ca 、K 、Cl 、HC
的水溶液中:、Al 、Cl 、N
的溶液中:K 、ClO 、、SCN
11. 下列叙述正确的是( )
A. 某温度下, 一元弱酸HA的越小, 则NaA的(水解平衡常数)越小
B 铁管镀锌层局部破损后,铁管仍不易生锈
C 铜既可以发生析氢腐蚀又可以发生吸氧腐蚀
D. △H>0,△S<0的反应在任何温度下均能正向自发进行
12.下列实验装置(部分夹持装置已略去) 可以达到对应实验目的的是
13. 常温下。下列说法正确的是
A. 一定浓度的CH COOH溶液加水稀释,所有离子的浓度均减小
B. pH=4的CH COOH溶液和pH=10的氨水等体积混合后pH=7
C. 等浓度的CH COONa和NH Cl溶液中阴离子浓度之和,前者小于后者
D. 等浓度、等体积的CH COOH溶液和氨水分别与NaHCO 固体反应,消耗 的量CH COOH多
14.向绝热恒容密闭容器中通入 和 一定条件下使反应
)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是
A.反应在 c点达到平衡状态
B.反应物浓度:a点小于 b点
C.反应物的总能量低于生成物的总能量
时, 的转化率: a~b段小于 b~c段
15.利用电化学原理可同时将 CO变废为宝,装置如图所示(电极均为惰性电极)。
下列说法不正确的是
A. a为负极,发生氧化反应,电极反应式为:
B 装置工作时,电子从c极流入b极,然后经溶液流入a极
C. d电极反应式为
D. 若b极消耗 则Y中左侧溶液质量减轻36g
2024~2025学年度第一学期阶段性质量监测(二)
高二年级 化学学科
第Ⅱ卷(非选择题,共55分)
可能用到的相对原子质量:H1C12 N14 O16 Cu64 Zn65
二、(本题包括 4小题,共55分)
16. (14分) 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是 。在X极附近观察到的现象是 。
②Y电极上的电极反应式是 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 溶液,则(说明:杂质发生的电极反应不必写出)
①X电极的名称是 ; 电极反应式是 。
②Y电极的材料是 ; 溶液中Cu 浓度 (填“变大”或“变小”或“不变”) 。
③假若电路中有0.04mol电子通过时,阴极增重 克
17. (14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气) 合成二甲醚。回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
△H=-90.8kJ·mol
1
△H=~41.3kJ·mol
总反应: 的△H= 。
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a. 高温高压 b. 加入催化剂 c. 减少 的浓度
d. 增加CO的浓度 e. 分离出二甲醚
(2)已知反应 某温度下的平衡常数为400。此温度下,在密闭容器中加入CH OH,反应到某时刻测得各组分的浓度如下:
物质 CH OH CH OCH H O
浓度/(mol·L ) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小: v正 v逆(填“>”、“<”或“=”)。
②若加入CH OH后, 经10 min反应达到平衡, 此时 ;该时间内反应速率 。
(3)向 溶液中加入1 mL 0.1mol/L 氨水, 有白色沉淀产生, 继续加入4滴 溶液,观察到白色沉淀变为红褐色。用离子方程式解释白色沉淀变为红褐色原因: 。
(4)向CuSO 溶液中滴加氨水产生蓝色沉淀,若所得溶液] 已知
则溶液中
18. (13分) 化学是一门以实验为基础的学科。回答下列问题:
I. 水的电离及溶液的PH
(1)泡沫灭火剂包括 溶液, 溶液及起泡剂,使用时发生反应的离子方程式为 。
(2)t℃时,某稀硫酸溶液中 已知:a+b=13。该温度下(t℃), 将 的稀 溶液与 的NaOH溶液混合后(溶液体积变化忽略不计),溶液的 pH= 。
II. 电离平衡常数
(1) 向盛有2mL1mol/L醋酸的试管中滴加 溶液,观察到试管中有气泡产生,由此推断的)(填“、”或“<”), 发生反应的离子方程式为 。
III. 盐类水解的应用
(2) 向一支试管中加入少量FeCl 晶体,然后加入5mL蒸馏水、振荡,观察到慢慢溶解, 但有少量浑浊, 此溶液的 pH 7(填“>”“<”或“=”), 配制I 溶液的正确方法是 。
(3) 向一个烧杯中加入40mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和FeCl 溶液,继续煮沸制得 3胶体。该反应的化学方程式为 , Fe(OH) 胶体呈 色。
五、(本题包括1小题,共14分)
19.(14分)现代生活离不开方便实用的化学电源。各种各样的化学电源都是依据原电池的原理制造的。回答下列问题:
(1) 锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为 LiCoO (钴酸锂),电解质溶液为 LiPF (六氟磷酸锂) 的碳酸酯溶液(无水)。该电池放电时的主要反应为
①放电时,负极反应式为 。Li 由 极向 极迁移(填“正”或“负”)。
②充电时,电池的 (填“正”或“负”) 极应与电源的正极相连,充电时该极的电极反应式为 。
(2) 甲醇燃料电池(简称 DMFC) 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC 的工作原理如图所示。
①通入a物质一侧的电极反应式为 。
②通入11.2L (折算为标准状况下) 甲醇蒸气,测得电路中转移1.8mol电子,则甲醇的利用率为 。
电池工作原理如右图所示,利用该电池能
有效地将转化成化工原料草酸铝
①电池的总反应式为 。
②电池的正极反应式: (草酸根)
正极反应过程中,O 是催化剂,催化过程可表示为:
ii……
写出反应 ii的离子方程式: 。
高二年级 化学学科
第Ⅰ卷(选择题, 共 45分)
可能用到的相对原子质量:H1 C12 N14 O16 Cu64 Zn65
一、选择题(本题包括 15小题,每小题 3分,共45分。每小题只有一个选项符合题意)
1. 下列各基态原子或离子的电子排布式正确的是
B. O 1s 2s 2p
C. Cu 1s 2s 2p 3s 3p 3d 4s
2.下列叙述正确的是( )
A. 可能存在核外电子排布式为的基态原子
B. 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反
C. 1个原子轨道里最多容纳2个电子,且自旋方向相同
D. 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量
B.下列溶液一定呈中性的是
A. pH=7的溶液 的溶液
C. 非电解质溶于水得到的溶液 D. 由强酸、强碱等物质的量反应得到的溶液
4. 将下列各物质加入水中,对水的电离平衡几乎无影响的是
A. Ca B. Nal C. NaHSO D. KAl(SO )
5. 高铁电池是 种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 下列叙述不正确的是( )
A 放电时负极反应为:3Zn-6e +6OH =-3Zn(OH)
B. 放电时正极反应为:
C. 放电时每转移3 mol电子, 正极有1mol K FeO 被氧化
D. 放电时正极附近溶液的碱性增强
6.如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
A. a处得到的是浓NaOH溶液
B. 适当降低阳极电解液的pH有利于 逸出
C. 粗盐水中含有的少量Ca 和Mg 可用NaOH除去
D.若电路中通过0.2mol电子,理论上可在b处得到标准状况下1.12L气体
7 下列关于沉淀溶解平衡的判断正确的是
A 某离子被沉淀完全是指该离子在溶液中的浓度为0
B.向饱和AgCl水溶液中加入NaCl固体, 值变大
C. 向 Mg(OH) 悬浊液中滴加FeCl 溶液, 生成红褐色沉淀
D.含有AgCl和AgI固体的悬浊液:
8.某温度下,将 pH和体积均相同的 HCl和CH COOH溶液分别加水稀释,其 pH随加水体积的变化如图所示。下列叙述不正确的是
A.溶液中水的电离程度:b点
C.稀释前溶液的浓度:
D. 从 b点到 d点, 溶液中 c()c()逐渐增大
9.金属镍有广泛的用途。粗镍中含有少量 Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性
A. 电解后,电解槽底部的阳极泥中含有 Cu和Pt
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C. 阳极发生还原反应,其电极反应式:
D.电解后,溶液中存在的金属阳离子只有Fe 和Zn
10、常温下,下列各组离子在指定溶液中能大量共存的是
A、pH=1的溶液中:
B.水电离出的的溶液中:Ca 、K 、Cl 、HC
的水溶液中:、Al 、Cl 、N
的溶液中:K 、ClO 、、SCN
11. 下列叙述正确的是( )
A. 某温度下, 一元弱酸HA的越小, 则NaA的(水解平衡常数)越小
B 铁管镀锌层局部破损后,铁管仍不易生锈
C 铜既可以发生析氢腐蚀又可以发生吸氧腐蚀
D. △H>0,△S<0的反应在任何温度下均能正向自发进行
12.下列实验装置(部分夹持装置已略去) 可以达到对应实验目的的是
13. 常温下。下列说法正确的是
A. 一定浓度的CH COOH溶液加水稀释,所有离子的浓度均减小
B. pH=4的CH COOH溶液和pH=10的氨水等体积混合后pH=7
C. 等浓度的CH COONa和NH Cl溶液中阴离子浓度之和,前者小于后者
D. 等浓度、等体积的CH COOH溶液和氨水分别与NaHCO 固体反应,消耗 的量CH COOH多
14.向绝热恒容密闭容器中通入 和 一定条件下使反应
)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是
A.反应在 c点达到平衡状态
B.反应物浓度:a点小于 b点
C.反应物的总能量低于生成物的总能量
时, 的转化率: a~b段小于 b~c段
15.利用电化学原理可同时将 CO变废为宝,装置如图所示(电极均为惰性电极)。
下列说法不正确的是
A. a为负极,发生氧化反应,电极反应式为:
B 装置工作时,电子从c极流入b极,然后经溶液流入a极
C. d电极反应式为
D. 若b极消耗 则Y中左侧溶液质量减轻36g
2024~2025学年度第一学期阶段性质量监测(二)
高二年级 化学学科
第Ⅱ卷(非选择题,共55分)
可能用到的相对原子质量:H1C12 N14 O16 Cu64 Zn65
二、(本题包括 4小题,共55分)
16. (14分) 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是 。在X极附近观察到的现象是 。
②Y电极上的电极反应式是 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 溶液,则(说明:杂质发生的电极反应不必写出)
①X电极的名称是 ; 电极反应式是 。
②Y电极的材料是 ; 溶液中Cu 浓度 (填“变大”或“变小”或“不变”) 。
③假若电路中有0.04mol电子通过时,阴极增重 克
17. (14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气) 合成二甲醚。回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
△H=-90.8kJ·mol
1
△H=~41.3kJ·mol
总反应: 的△H= 。
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a. 高温高压 b. 加入催化剂 c. 减少 的浓度
d. 增加CO的浓度 e. 分离出二甲醚
(2)已知反应 某温度下的平衡常数为400。此温度下,在密闭容器中加入CH OH,反应到某时刻测得各组分的浓度如下:
物质 CH OH CH OCH H O
浓度/(mol·L ) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小: v正 v逆(填“>”、“<”或“=”)。
②若加入CH OH后, 经10 min反应达到平衡, 此时 ;该时间内反应速率 。
(3)向 溶液中加入1 mL 0.1mol/L 氨水, 有白色沉淀产生, 继续加入4滴 溶液,观察到白色沉淀变为红褐色。用离子方程式解释白色沉淀变为红褐色原因: 。
(4)向CuSO 溶液中滴加氨水产生蓝色沉淀,若所得溶液] 已知
则溶液中
18. (13分) 化学是一门以实验为基础的学科。回答下列问题:
I. 水的电离及溶液的PH
(1)泡沫灭火剂包括 溶液, 溶液及起泡剂,使用时发生反应的离子方程式为 。
(2)t℃时,某稀硫酸溶液中 已知:a+b=13。该温度下(t℃), 将 的稀 溶液与 的NaOH溶液混合后(溶液体积变化忽略不计),溶液的 pH= 。
II. 电离平衡常数
(1) 向盛有2mL1mol/L醋酸的试管中滴加 溶液,观察到试管中有气泡产生,由此推断的)(填“、”或“<”), 发生反应的离子方程式为 。
III. 盐类水解的应用
(2) 向一支试管中加入少量FeCl 晶体,然后加入5mL蒸馏水、振荡,观察到慢慢溶解, 但有少量浑浊, 此溶液的 pH 7(填“>”“<”或“=”), 配制I 溶液的正确方法是 。
(3) 向一个烧杯中加入40mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和FeCl 溶液,继续煮沸制得 3胶体。该反应的化学方程式为 , Fe(OH) 胶体呈 色。
五、(本题包括1小题,共14分)
19.(14分)现代生活离不开方便实用的化学电源。各种各样的化学电源都是依据原电池的原理制造的。回答下列问题:
(1) 锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为 LiCoO (钴酸锂),电解质溶液为 LiPF (六氟磷酸锂) 的碳酸酯溶液(无水)。该电池放电时的主要反应为
①放电时,负极反应式为 。Li 由 极向 极迁移(填“正”或“负”)。
②充电时,电池的 (填“正”或“负”) 极应与电源的正极相连,充电时该极的电极反应式为 。
(2) 甲醇燃料电池(简称 DMFC) 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC 的工作原理如图所示。
①通入a物质一侧的电极反应式为 。
②通入11.2L (折算为标准状况下) 甲醇蒸气,测得电路中转移1.8mol电子,则甲醇的利用率为 。
电池工作原理如右图所示,利用该电池能
有效地将转化成化工原料草酸铝
①电池的总反应式为 。
②电池的正极反应式: (草酸根)
正极反应过程中,O 是催化剂,催化过程可表示为:
ii……
写出反应 ii的离子方程式: 。
同课章节目录
