陕西省西安市长安区滦镇鸭池口初级中学人教版九年级化学上册课件:2.3 制取氧气(共10张PPT)
文档属性
| 名称 | 陕西省西安市长安区滦镇鸭池口初级中学人教版九年级化学上册课件:2.3 制取氧气(共10张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 287.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-11 21:20:06 | ||
图片预览




文档简介
课件10张PPT。课题3:制取氧气长安区鸭池口中学
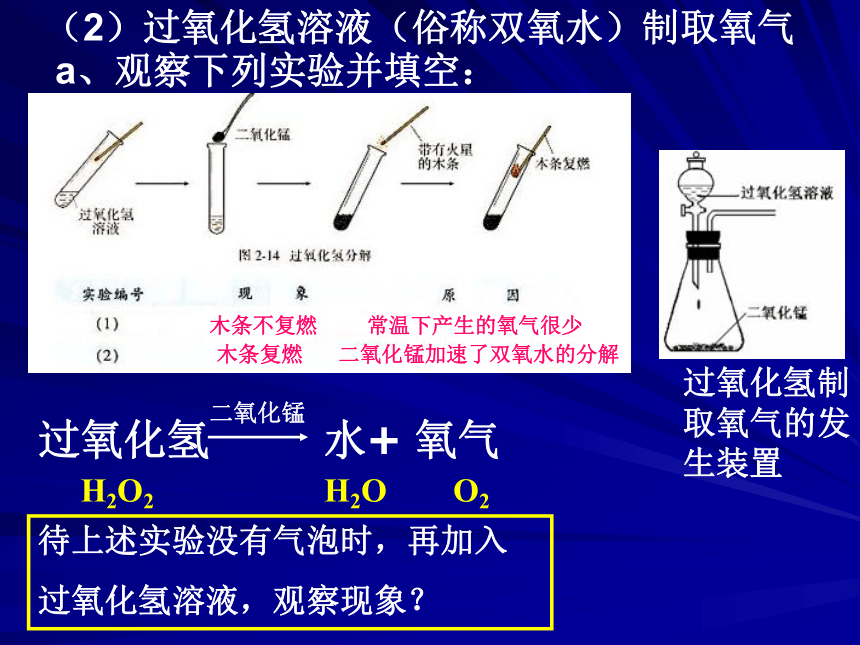
刘俊思考1:我们知道氧气有许多用途,那么我们如何制取氧气呢?一、实验室制取氧气1、实验原理及装置:过氧化氢溶液 H2O2 (无色)高锰酸钾 KMnO4 (暗紫色)氯酸钾KClO3 (白色)二氧化锰 MnO2 (黑色)常用药品及其颜色 a、观察下列实验并填空:木条不复燃常温下产生的氧气很少木条复燃二氧化锰加速了双氧水的分解待上述实验没有气泡时,再加入
过氧化氢溶液,观察现象?H2O2H2OO2(2)过氧化氢溶液(俗称双氧水)制取氧气过氧化氢制取氧气的发生装置催化剂:像这种能改变其他物质的化学反应速率而本身的质量和化学性质在反应前后都不变的物质。催化剂在反应中起的作用叫催化作用。思考:是否可用其他的物质代替二氧化锰作为过氧化氢分解的催化剂,阅读课本P38 b、催化剂及其催化作用:思考:1.有了催化剂是否可以使生成物质量增加呢? 2.没有催化剂反应能否进行呢?3.在反应进行过程中催化剂参与反应吗?4.MnO2 是催化剂,这种说法对吗?加快或者减慢浓盐酸+二氧化锰 氯气+二氯化锰+水 过氧化氢 水+氧气二氧化锰高锰酸钾 锰酸钾+二氧化锰+氧气加热加热(2)加热氯酸钾制取氧气KClO3KClO2思考:二氧化锰在该反应中作 剂,起
作用。催化催化+△MnO2发生装置收集装置(3)加热高锰酸钾制取氧气KMnO4K2MnO4MnO2O2棉花的作用:防止高锰酸钾粉末进入导管。二、分解反应:(比较下列三个反应中反应物和生成物的种类有什么类似?)分解反应:由一种物质生成两种或两种以上其它物质的反应,叫分解反应。分解反应可表示为:AB=A+BA+B=AB化合反应可表示为:三、比较下列三个实验装置图:产生氧气的速率由快到慢的顺序为 :试回答:A B C装置A与B、C相比较,其优点有: ①可以随时添加药品,不断产生氧气。 ②不需要加热,节约能源。 ③可以控制氧气的产生速率。 1、实验药品及颜色:2、实验原理及装置: 3、催化剂及其催化作用:4、分解反应:催化剂的特点:一改变,二不变。 即改变反应的速率,而本身的质量和化学性质没有改变。分解反应:由一种物质生成两种或两种以上其它物质的反应,叫分解反应。
刘俊思考1:我们知道氧气有许多用途,那么我们如何制取氧气呢?一、实验室制取氧气1、实验原理及装置:过氧化氢溶液 H2O2 (无色)高锰酸钾 KMnO4 (暗紫色)氯酸钾KClO3 (白色)二氧化锰 MnO2 (黑色)常用药品及其颜色 a、观察下列实验并填空:木条不复燃常温下产生的氧气很少木条复燃二氧化锰加速了双氧水的分解待上述实验没有气泡时,再加入
过氧化氢溶液,观察现象?H2O2H2OO2(2)过氧化氢溶液(俗称双氧水)制取氧气过氧化氢制取氧气的发生装置催化剂:像这种能改变其他物质的化学反应速率而本身的质量和化学性质在反应前后都不变的物质。催化剂在反应中起的作用叫催化作用。思考:是否可用其他的物质代替二氧化锰作为过氧化氢分解的催化剂,阅读课本P38 b、催化剂及其催化作用:思考:1.有了催化剂是否可以使生成物质量增加呢? 2.没有催化剂反应能否进行呢?3.在反应进行过程中催化剂参与反应吗?4.MnO2 是催化剂,这种说法对吗?加快或者减慢浓盐酸+二氧化锰 氯气+二氯化锰+水 过氧化氢 水+氧气二氧化锰高锰酸钾 锰酸钾+二氧化锰+氧气加热加热(2)加热氯酸钾制取氧气KClO3KClO2思考:二氧化锰在该反应中作 剂,起
作用。催化催化+△MnO2发生装置收集装置(3)加热高锰酸钾制取氧气KMnO4K2MnO4MnO2O2棉花的作用:防止高锰酸钾粉末进入导管。二、分解反应:(比较下列三个反应中反应物和生成物的种类有什么类似?)分解反应:由一种物质生成两种或两种以上其它物质的反应,叫分解反应。分解反应可表示为:AB=A+BA+B=AB化合反应可表示为:三、比较下列三个实验装置图:产生氧气的速率由快到慢的顺序为 :试回答:A B C装置A与B、C相比较,其优点有: ①可以随时添加药品,不断产生氧气。 ②不需要加热,节约能源。 ③可以控制氧气的产生速率。 1、实验药品及颜色:2、实验原理及装置: 3、催化剂及其催化作用:4、分解反应:催化剂的特点:一改变,二不变。 即改变反应的速率,而本身的质量和化学性质没有改变。分解反应:由一种物质生成两种或两种以上其它物质的反应,叫分解反应。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
