1.2.4 电解池的工作原理 学案 (含解析) 2024-2025学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.2.4 电解池的工作原理 学案 (含解析) 2024-2025学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | DOCX | ||
| 文件大小 | 525.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-29 00:00:00 | ||
图片预览



文档简介
第四课时 电解池的工作原理
学习目标 1.了解电解池的结构,理解电解池的工作原理,知道原电池与电解池的区别。2.理解电解的规律,学会判断电解的产物,学会书写电解的电极反应式和电解总反应式。
一、电解池工作原理
(一)知识梳理
1.电解熔融态氯化钠的原理分析
(1)电解熔融态氯化钠原理图
(2)电解过程
①通电前
熔融NaCl中存在的微粒有________、________,这些微粒做无规则(或自由)运动。
②通电后
离子移动方向:Na+移向________极,Cl-移向________极。
电极上发生的反应:
阴极反应:______________,发生________反应;
阳极反应:______________,发生________反应。
(3)分析结论
熔融的NaCl在________作用下发生了________________,分解生成了________和____________________________________________________________________。
电解反应:_________________________________________________________。
2.电解和电解池
(1)电解
在直流电的作用下,在两电极上分别发生__________和________的过程。
(2)电解池
将________转化为________的装置。
(3)电解池的电极名称
阴极:与电源____________相连的电极,发生________反应;
阳极:与电源____________相连的电极,发生________反应。
(4)电解池的构成条件
①具有直流电源;
②两个电极(阴极、阳极);
③电解质溶液或熔融电解质;
④形成闭合回路。
(二)互动探究
电解氯化铜溶液
(如下图)在U形管中注入CuCl2溶液,插入两根石墨棒作电极,把湿润的碘化钾 淀粉试纸放在与直流电源正极相连的电极附近,接通电源。
【问题讨论】
(1)观察到的实验现象有哪些?
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
(2)能获得哪些实验结论?
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
(3)分析实验原理并写出在两极上发生的电极反应。
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
【探究归纳】
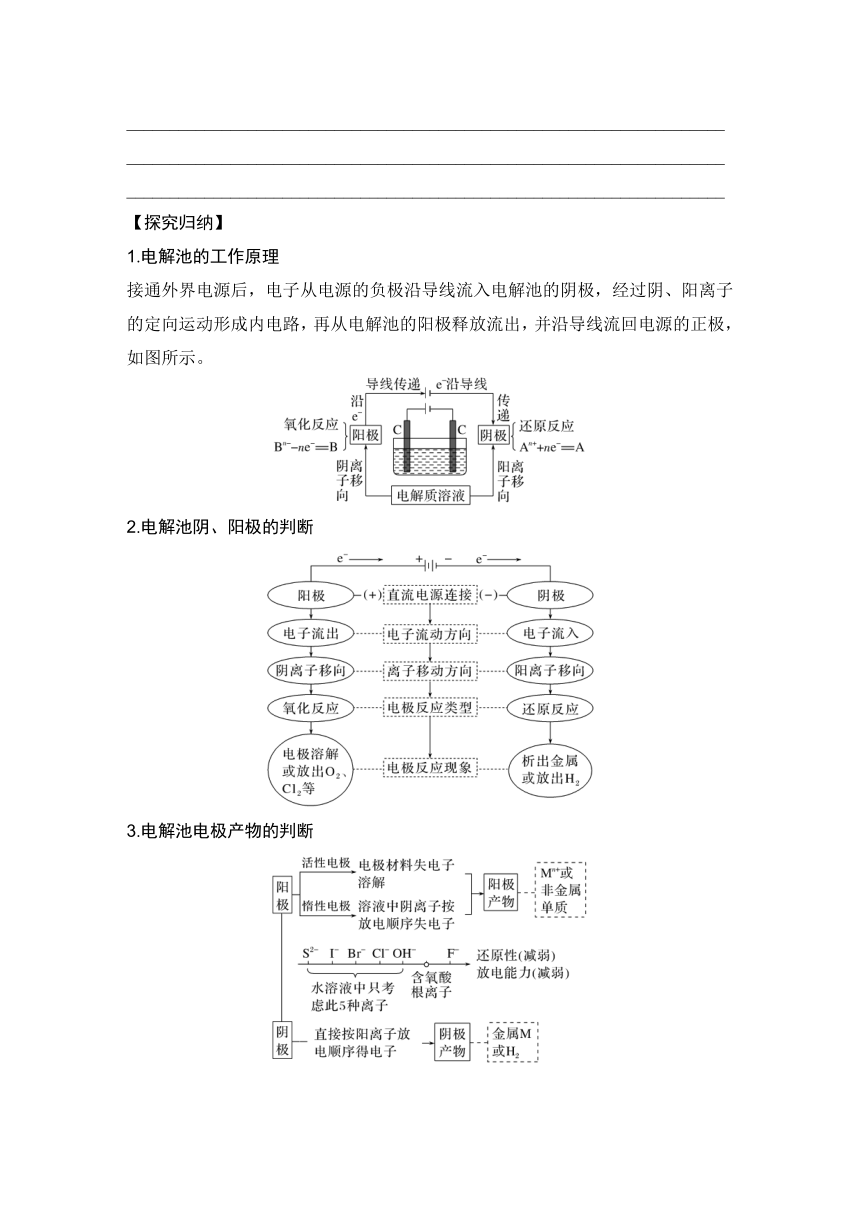
1.电解池的工作原理
接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极释放流出,并沿导线流回电源的正极,如图所示。
2.电解池阴、阳极的判断
3.电解池电极产物的判断
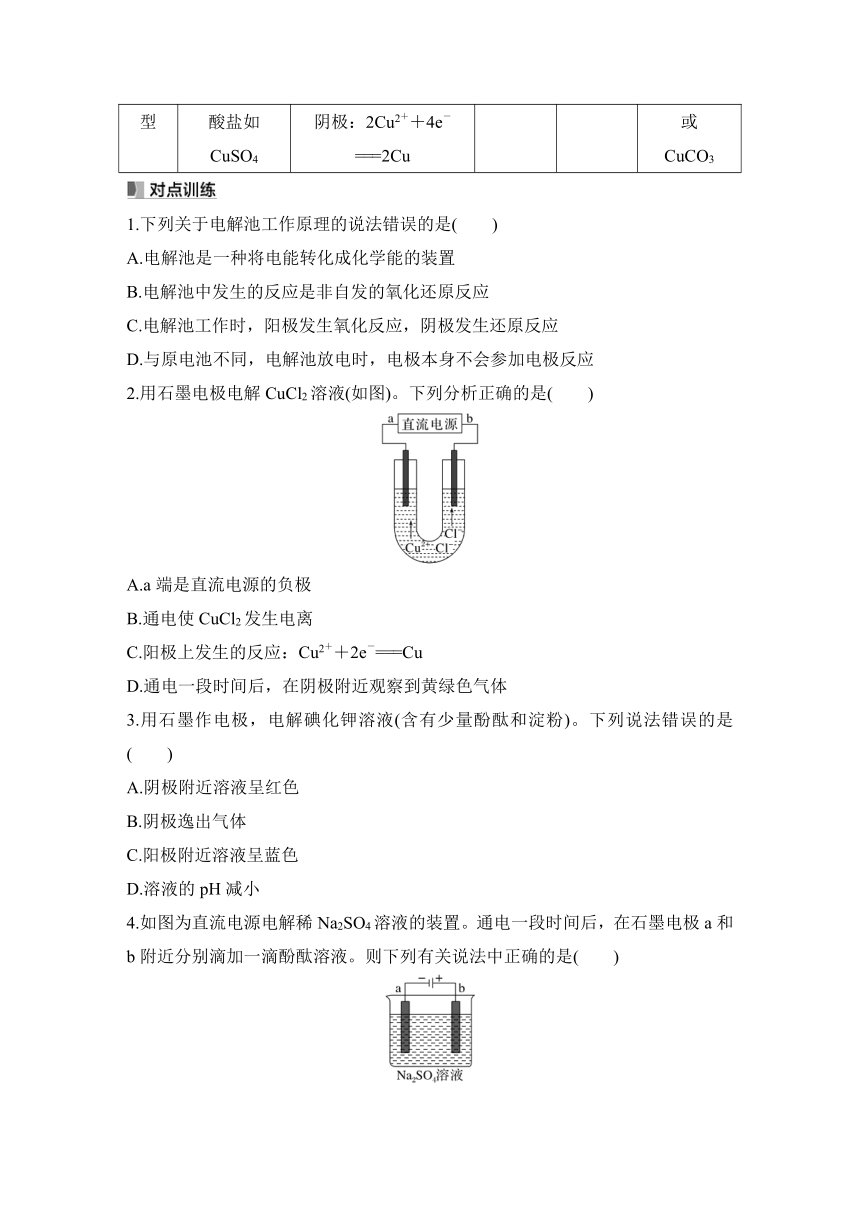
4.酸、碱、盐溶液电解规律(惰性电极)
电解质 及类别 电极反应式 电解 物质 pH 变化 溶液复 原方法
电解水型 含氧酸如 H2SO4 阴极:①酸溶液2H++2e-===H2↑,②盐、碱溶液2H2O+2e-===H2↑+2OH- 阳极:①酸、盐溶液2H2O-4e-===O2↑+4H+,②碱溶液4OH--4e-===O2↑+2H2O H2O 减小 加入 H2O
强碱如 NaOH 增大
活泼金属 的含氧酸 盐如 Na2SO4 不变
电解电解质型 无氧酸 如HCl 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ HCl 增大 通入 HCl 气体
不活泼金 属的无氧 酸盐如 CuCl2 阳极:2Cl--2e-===Cl2↑ 阴极:Cu2++2e-===Cu CuCl2 - 加入 CuCl2 固体
放H2生碱型 活泼金 属的无 氧酸盐 如NaCl 阳极:2Cl--2e-===Cl2↑ 阴极:2H2O+2e-===H2↑+2OH- NaCl、 H2O 增大 通入 HCl 气体
放O2生酸型 不活泼金 属的含氧 酸盐如 CuSO4 阳极:2H2O-4e-===O2↑+4H+ 阴极:2Cu2++4e-===2Cu CuSO4、 H2O 减小 加入 CuO 或 CuCO3
1.下列关于电解池工作原理的说法错误的是( )
A.电解池是一种将电能转化成化学能的装置
B.电解池中发生的反应是非自发的氧化还原反应
C.电解池工作时,阳极发生氧化反应,阴极发生还原反应
D.与原电池不同,电解池放电时,电极本身不会参加电极反应
2.用石墨电极电解CuCl2溶液(如图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-===Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
3.用石墨作电极,电解碘化钾溶液(含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH减小
4.如图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
【题后归纳】
1.电解质溶液的恢复问题
(1)首先确定电极产物,应遵循“缺什么加什么,缺多少加多少”的原则。
(2)一般加入阴极产物或阳极产物。如用惰性电极电解CuSO4溶液,要恢复电解质溶液,可向电解后溶液中加入CuO,也可以加入CuCO3。但不能加入Cu(OH)2,因Cu(OH)2能与生成的H2SO4反应使水的量增加。
(3)加入物质的物质的量需根据电路中的电子守恒进行计算。
2.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
二、电解池中电极反应式的书写
1.电极反应式的书写步骤
2.电极反应式书写的关键
(1)书写电解池中电极反应式时,强电解质以实际放电的离子表示,弱电解质写成化学式。
(2)电极反应式的书写首先根据题干要求及信息写出反应物和生成物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。
(3)酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
(4)要确保两极得失电子数目相等,且总反应注明条件“电解”。
(1)若铁作阳极,铁失电子生成Fe2+而不是Fe3+。
(2)Fe3+在阴极上放电时生成Fe2+而不是单质铁。
(3)书写电极反应式要结合具体要求分析产物。如用铝作阳极制取氧化铝,则阳极产物是Al2O3而不是Al3+。
1.下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
A.电解饱和食盐水 阴极:Na++e-===Na
B.电解CuSO4溶液 阴极:Cu2++2e-===Cu
C.电解熔融NaCl 阴极:Na++e-===Na
D.电解NaOH溶液 阳极:4OH--4e-===2H2O+O2↑
2.如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为__________,b电极为_____________________________________。
(2)c电极为________,电极反应式为_____________________________________
_____________________________________________________________________,
发生了________反应。
d电极为________,电极反应式为________________________________________
_____________________________________________________________________,
发生了________反应。
(3)电解过程中,氢离子向________(填“阴”或“阳”,下同)极移动,氯离子向________极移动。电解反应方程式为:_____________________________________________________________________
_____________________________________________________________________。
3.按要求书写电极反应式和电解反应。
(1)用惰性电极电解AgNO3溶液
阳极反应式:___________________________________________________________;
阴极反应式:_____________________________________________________________________;
电解反应离子方程式:__________________________________________________
_____________________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式:___________________________________________________________;
阴极反应式:_____________________________________________________;
电解反应离子方程式:________________________________________________
_____________________________________________________________________。
(3)用Fe作电极电解NaCl溶液
阳极反应式:_________________________________________________________;
阴极反应式:________________________________________________________;
电解反应化学方程式:__________________________________________________
_____________________________________________________________________。
(4)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:__________________________________________________________;
阴极反应式:_________________________________________________________;
电解反应离子方程式:__________________________________________________
_____________________________________________________________________。
1.如下图所示装置中,属于电解池的是( )
2.(2024·龙岩连城一中高二月考)用铂作为电极电解某种溶液,通电一段时间,溶液的酸性增强,并且在阳极得到0.1 mol气体,阴极得到0.2 mol气体(两种气体均在相同条件下测定)。由此可知溶液可能是( )
A.稀盐酸 B.稀硫酸
C.CuSO4溶液 D.KNO3溶液
3.用惰性电极电解物质的量浓度相同、体积比为3∶1的硫酸铜和氯化钠的混合溶液,不可能发生的反应有( )
A.2Cu2++2H2O2Cu+4H++O2↑
B.Cu2++2Cl-Cu+Cl2↑
C.2Cl-+2H2O2OH-+H2↑+Cl2↑
D.2H2O2H2↑+O2↑
4.下列有关用惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
A.电解过程中阳极的质量不断增加
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
5.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-5种离子中两两恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
第四课时 电解池的工作原理
(一)1.(2)①Na+ Cl- ②阴 阳 2Na++2e-===2Na 还原 2Cl--2e-===Cl2↑ 氧化 (3)直流电 氧化还原反应 Na Cl2 2NaCl2Na+Cl2↑
2.(1)氧化反应 还原反应 (2)电能 化学能 (3)负极 还原 正极 氧化
(一)
问题讨论
(1)阴极石墨棒上逐渐覆盖了一层红色的铜,在阳极石墨棒上有刺激性气味气体产生,且使湿润的碘化钾 淀粉试纸变成蓝色。
(2)电解CuCl2溶液,生成了铜和氯气。
(3)通电时,在电场的作用下,溶液中的离子做定向移动,Cu2+、H+向阴极移动,Cl-、OH-向阳极移动。在阴极,Cu2+优于H+在电极上发生反应,在阳极,Cl-优于OH-在电极上发生反应。
对点训练
1.D [如果阳极是活泼电极,电极本身失去电子,发生氧化反应。]
2.A [A项,铜离子移向阴极,则a为负极,正确;B项,CuCl2发生电离是在水分子的作用下完成的,并非通电才能发生,错误;C项,反应Cu2++2e-===Cu应在阴极上发生,阳极上发生的反应式为2Cl--2e-===Cl2↑,错误;D项,通电一段时间后阳极附近观察到黄绿色气体,错误。]
3.D [用石墨作电极,电解碘化钾溶液类似于电解氯化钠溶液。阳极反应式为2I--2e-===I2,阳极附近溶液变蓝色;阴极反应式为2H2O+2e-===H2↑+2OH-,阴极有氢气逸出,附近溶液氢氧根浓度逐渐增大呈碱性,溶液变红色。]
4.A [a为阴极,电解时a电极上得电子发生还原反应生成氢气同时生成氢氧根离子,电极反应式为2H2O+2e-===H2↑+2OH-,所以有氢气生成,A正确;阴极生成氢气、阳极生成氧气,所以生成的气体都是无色无味的,B错误;阴极上生成氢气、阳极生成氧气,所以实质上是电解水,硫酸钠的物质的量不变,溶液体积减小,则硫酸钠物质的量浓度增大,溶液仍然呈中性,C错误;a电极附近生成氢氧根离子导致溶液呈碱性,b电极附近生成氢离子导致溶液呈酸性,所以a电极附近溶液变红色,b电极附近溶液呈无色,D错误。]
二、
对点训练
1.A [饱和食盐溶液中离子有Na+、H+及Cl-、OH-四种,得电子能力H+>Na+,阴极反应为2H2O+2e-===H2↑+2OH-,故A错误;电解CuSO4溶液,阴极上是铜离子得电子发生还原反应,即Cu2++2e-===Cu,故B正确;电解熔融NaCl,阴极上是钠离子得电子发生还原反应,即Na++e-===Na,故C正确;电解NaOH溶液,阳极上是氢氧根离子失电子发生氧化反应:4OH--4e-===2H2O+O2↑,故D正确。]
2.(1)正极 负极 (2)阳极 2Cl--2e-===Cl2↑ 氧化 阴极
2H++2e-===H2↑ 还原 (3)阴 阳 2HClH2↑+Cl2↑
3.(1)2H2O-4e-===O2↑+4H+ Ag++e-===Ag
4Ag++2H2O4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑ 2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+[或Fe-2e-+2OH-===Fe(OH)2↓] 2H2O+2e-===H2↑+2OH- Fe+2H2OFe(OH)2↓+H2↑
(4)2Al-6e-+3H2O===Al2O3+6H+ 2H++2e-===H2↑
2Al+3H2OAl2O3+3H2↑
课堂达标训练
1.C [根据电解池的构成条件进行判断:装置A、B、D中无直流电源,装置D中不能形成闭合回路,A、B、D不属于电解池。]
2.B [电解稀盐酸溶液,两极上分别为Cl-和H+放电,两极气体体积之比是1∶1,A不符合题意;电解稀硫酸,两极上分别为OH-和H+放电,消耗水,H+浓度增大,溶液的pH变小,B符合题意;电解CuSO4溶液,阴极析出铜,如时间较少,没有气体放出,C不符合题意;电解硝酸钾溶液,两极上分别为OH-和H+放电,消耗水,溶液呈中性,pH不变,D不符合题意。]
3.C [设混合溶液的体积为4 L,混合前物质的量浓度均为1 mol·L-1,溶液中硫酸铜和氯化钠的物质的量分别为3 mol 和1 mol,根据转移电子守恒,第一阶段:阳极上氯离子放电,阴极上铜离子放电,电解的方程式是Cu2++2Cl-Cu+Cl2↑,氯离子完全反应时,剩余铜离子2.5 mol;第二阶段:阳极上氢氧根离子放电,阴极上铜离子放电,电解方程式是2Cu2++2H2O2Cu+4H++O2↑;第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电,电解的方程式是2H2O2H2↑+O2↑。]
4.C [用惰性电极电解AgNO3溶液,总的电解反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3,阴极上析出Ag,阳极上放出O2,A、D错误;由于生成HNO3,溶液的pH降低,B错误;要使溶液恢复到电解前的状况要加入的物质应是Ag2O固体,C正确。]
5.(1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4、NaCl CuO(或CuCO3)、HCl
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质是HCl、CuCl2。(2)实质上是电解水,H+、OH-分别在两极上放电,因此,其电解质是Na2SO4、H2SO4。(3)电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl气体。
学习目标 1.了解电解池的结构,理解电解池的工作原理,知道原电池与电解池的区别。2.理解电解的规律,学会判断电解的产物,学会书写电解的电极反应式和电解总反应式。
一、电解池工作原理
(一)知识梳理
1.电解熔融态氯化钠的原理分析
(1)电解熔融态氯化钠原理图
(2)电解过程
①通电前
熔融NaCl中存在的微粒有________、________,这些微粒做无规则(或自由)运动。
②通电后
离子移动方向:Na+移向________极,Cl-移向________极。
电极上发生的反应:
阴极反应:______________,发生________反应;
阳极反应:______________,发生________反应。
(3)分析结论
熔融的NaCl在________作用下发生了________________,分解生成了________和____________________________________________________________________。
电解反应:_________________________________________________________。
2.电解和电解池
(1)电解
在直流电的作用下,在两电极上分别发生__________和________的过程。
(2)电解池
将________转化为________的装置。
(3)电解池的电极名称
阴极:与电源____________相连的电极,发生________反应;
阳极:与电源____________相连的电极,发生________反应。
(4)电解池的构成条件
①具有直流电源;
②两个电极(阴极、阳极);
③电解质溶液或熔融电解质;
④形成闭合回路。
(二)互动探究
电解氯化铜溶液
(如下图)在U形管中注入CuCl2溶液,插入两根石墨棒作电极,把湿润的碘化钾 淀粉试纸放在与直流电源正极相连的电极附近,接通电源。
【问题讨论】
(1)观察到的实验现象有哪些?
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
(2)能获得哪些实验结论?
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
(3)分析实验原理并写出在两极上发生的电极反应。
_____________________________________________________________________
_____________________________________________________________________
_____________________________________________________________________
【探究归纳】
1.电解池的工作原理
接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极释放流出,并沿导线流回电源的正极,如图所示。
2.电解池阴、阳极的判断
3.电解池电极产物的判断
4.酸、碱、盐溶液电解规律(惰性电极)
电解质 及类别 电极反应式 电解 物质 pH 变化 溶液复 原方法
电解水型 含氧酸如 H2SO4 阴极:①酸溶液2H++2e-===H2↑,②盐、碱溶液2H2O+2e-===H2↑+2OH- 阳极:①酸、盐溶液2H2O-4e-===O2↑+4H+,②碱溶液4OH--4e-===O2↑+2H2O H2O 减小 加入 H2O
强碱如 NaOH 增大
活泼金属 的含氧酸 盐如 Na2SO4 不变
电解电解质型 无氧酸 如HCl 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ HCl 增大 通入 HCl 气体
不活泼金 属的无氧 酸盐如 CuCl2 阳极:2Cl--2e-===Cl2↑ 阴极:Cu2++2e-===Cu CuCl2 - 加入 CuCl2 固体
放H2生碱型 活泼金 属的无 氧酸盐 如NaCl 阳极:2Cl--2e-===Cl2↑ 阴极:2H2O+2e-===H2↑+2OH- NaCl、 H2O 增大 通入 HCl 气体
放O2生酸型 不活泼金 属的含氧 酸盐如 CuSO4 阳极:2H2O-4e-===O2↑+4H+ 阴极:2Cu2++4e-===2Cu CuSO4、 H2O 减小 加入 CuO 或 CuCO3
1.下列关于电解池工作原理的说法错误的是( )
A.电解池是一种将电能转化成化学能的装置
B.电解池中发生的反应是非自发的氧化还原反应
C.电解池工作时,阳极发生氧化反应,阴极发生还原反应
D.与原电池不同,电解池放电时,电极本身不会参加电极反应
2.用石墨电极电解CuCl2溶液(如图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-===Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
3.用石墨作电极,电解碘化钾溶液(含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH减小
4.如图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
【题后归纳】
1.电解质溶液的恢复问题
(1)首先确定电极产物,应遵循“缺什么加什么,缺多少加多少”的原则。
(2)一般加入阴极产物或阳极产物。如用惰性电极电解CuSO4溶液,要恢复电解质溶液,可向电解后溶液中加入CuO,也可以加入CuCO3。但不能加入Cu(OH)2,因Cu(OH)2能与生成的H2SO4反应使水的量增加。
(3)加入物质的物质的量需根据电路中的电子守恒进行计算。
2.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
二、电解池中电极反应式的书写
1.电极反应式的书写步骤
2.电极反应式书写的关键
(1)书写电解池中电极反应式时,强电解质以实际放电的离子表示,弱电解质写成化学式。
(2)电极反应式的书写首先根据题干要求及信息写出反应物和生成物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。
(3)酸性溶液中不能出现OH-,碱性溶液中不能出现H+。
(4)要确保两极得失电子数目相等,且总反应注明条件“电解”。
(1)若铁作阳极,铁失电子生成Fe2+而不是Fe3+。
(2)Fe3+在阴极上放电时生成Fe2+而不是单质铁。
(3)书写电极反应式要结合具体要求分析产物。如用铝作阳极制取氧化铝,则阳极产物是Al2O3而不是Al3+。
1.下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
A.电解饱和食盐水 阴极:Na++e-===Na
B.电解CuSO4溶液 阴极:Cu2++2e-===Cu
C.电解熔融NaCl 阴极:Na++e-===Na
D.电解NaOH溶液 阳极:4OH--4e-===2H2O+O2↑
2.如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为__________,b电极为_____________________________________。
(2)c电极为________,电极反应式为_____________________________________
_____________________________________________________________________,
发生了________反应。
d电极为________,电极反应式为________________________________________
_____________________________________________________________________,
发生了________反应。
(3)电解过程中,氢离子向________(填“阴”或“阳”,下同)极移动,氯离子向________极移动。电解反应方程式为:_____________________________________________________________________
_____________________________________________________________________。
3.按要求书写电极反应式和电解反应。
(1)用惰性电极电解AgNO3溶液
阳极反应式:___________________________________________________________;
阴极反应式:_____________________________________________________________________;
电解反应离子方程式:__________________________________________________
_____________________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式:___________________________________________________________;
阴极反应式:_____________________________________________________;
电解反应离子方程式:________________________________________________
_____________________________________________________________________。
(3)用Fe作电极电解NaCl溶液
阳极反应式:_________________________________________________________;
阴极反应式:________________________________________________________;
电解反应化学方程式:__________________________________________________
_____________________________________________________________________。
(4)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式:__________________________________________________________;
阴极反应式:_________________________________________________________;
电解反应离子方程式:__________________________________________________
_____________________________________________________________________。
1.如下图所示装置中,属于电解池的是( )
2.(2024·龙岩连城一中高二月考)用铂作为电极电解某种溶液,通电一段时间,溶液的酸性增强,并且在阳极得到0.1 mol气体,阴极得到0.2 mol气体(两种气体均在相同条件下测定)。由此可知溶液可能是( )
A.稀盐酸 B.稀硫酸
C.CuSO4溶液 D.KNO3溶液
3.用惰性电极电解物质的量浓度相同、体积比为3∶1的硫酸铜和氯化钠的混合溶液,不可能发生的反应有( )
A.2Cu2++2H2O2Cu+4H++O2↑
B.Cu2++2Cl-Cu+Cl2↑
C.2Cl-+2H2O2OH-+H2↑+Cl2↑
D.2H2O2H2↑+O2↑
4.下列有关用惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
A.电解过程中阳极的质量不断增加
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
5.为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-5种离子中两两恰当的组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是________。若要恢复到电解前的状态,应加入的物质是_____________________________________________________________________。
第四课时 电解池的工作原理
(一)1.(2)①Na+ Cl- ②阴 阳 2Na++2e-===2Na 还原 2Cl--2e-===Cl2↑ 氧化 (3)直流电 氧化还原反应 Na Cl2 2NaCl2Na+Cl2↑
2.(1)氧化反应 还原反应 (2)电能 化学能 (3)负极 还原 正极 氧化
(一)
问题讨论
(1)阴极石墨棒上逐渐覆盖了一层红色的铜,在阳极石墨棒上有刺激性气味气体产生,且使湿润的碘化钾 淀粉试纸变成蓝色。
(2)电解CuCl2溶液,生成了铜和氯气。
(3)通电时,在电场的作用下,溶液中的离子做定向移动,Cu2+、H+向阴极移动,Cl-、OH-向阳极移动。在阴极,Cu2+优于H+在电极上发生反应,在阳极,Cl-优于OH-在电极上发生反应。
对点训练
1.D [如果阳极是活泼电极,电极本身失去电子,发生氧化反应。]
2.A [A项,铜离子移向阴极,则a为负极,正确;B项,CuCl2发生电离是在水分子的作用下完成的,并非通电才能发生,错误;C项,反应Cu2++2e-===Cu应在阴极上发生,阳极上发生的反应式为2Cl--2e-===Cl2↑,错误;D项,通电一段时间后阳极附近观察到黄绿色气体,错误。]
3.D [用石墨作电极,电解碘化钾溶液类似于电解氯化钠溶液。阳极反应式为2I--2e-===I2,阳极附近溶液变蓝色;阴极反应式为2H2O+2e-===H2↑+2OH-,阴极有氢气逸出,附近溶液氢氧根浓度逐渐增大呈碱性,溶液变红色。]
4.A [a为阴极,电解时a电极上得电子发生还原反应生成氢气同时生成氢氧根离子,电极反应式为2H2O+2e-===H2↑+2OH-,所以有氢气生成,A正确;阴极生成氢气、阳极生成氧气,所以生成的气体都是无色无味的,B错误;阴极上生成氢气、阳极生成氧气,所以实质上是电解水,硫酸钠的物质的量不变,溶液体积减小,则硫酸钠物质的量浓度增大,溶液仍然呈中性,C错误;a电极附近生成氢氧根离子导致溶液呈碱性,b电极附近生成氢离子导致溶液呈酸性,所以a电极附近溶液变红色,b电极附近溶液呈无色,D错误。]
二、
对点训练
1.A [饱和食盐溶液中离子有Na+、H+及Cl-、OH-四种,得电子能力H+>Na+,阴极反应为2H2O+2e-===H2↑+2OH-,故A错误;电解CuSO4溶液,阴极上是铜离子得电子发生还原反应,即Cu2++2e-===Cu,故B正确;电解熔融NaCl,阴极上是钠离子得电子发生还原反应,即Na++e-===Na,故C正确;电解NaOH溶液,阳极上是氢氧根离子失电子发生氧化反应:4OH--4e-===2H2O+O2↑,故D正确。]
2.(1)正极 负极 (2)阳极 2Cl--2e-===Cl2↑ 氧化 阴极
2H++2e-===H2↑ 还原 (3)阴 阳 2HClH2↑+Cl2↑
3.(1)2H2O-4e-===O2↑+4H+ Ag++e-===Ag
4Ag++2H2O4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑ 2H2O+2e-+Mg2+===H2↑+Mg(OH)2↓
Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+[或Fe-2e-+2OH-===Fe(OH)2↓] 2H2O+2e-===H2↑+2OH- Fe+2H2OFe(OH)2↓+H2↑
(4)2Al-6e-+3H2O===Al2O3+6H+ 2H++2e-===H2↑
2Al+3H2OAl2O3+3H2↑
课堂达标训练
1.C [根据电解池的构成条件进行判断:装置A、B、D中无直流电源,装置D中不能形成闭合回路,A、B、D不属于电解池。]
2.B [电解稀盐酸溶液,两极上分别为Cl-和H+放电,两极气体体积之比是1∶1,A不符合题意;电解稀硫酸,两极上分别为OH-和H+放电,消耗水,H+浓度增大,溶液的pH变小,B符合题意;电解CuSO4溶液,阴极析出铜,如时间较少,没有气体放出,C不符合题意;电解硝酸钾溶液,两极上分别为OH-和H+放电,消耗水,溶液呈中性,pH不变,D不符合题意。]
3.C [设混合溶液的体积为4 L,混合前物质的量浓度均为1 mol·L-1,溶液中硫酸铜和氯化钠的物质的量分别为3 mol 和1 mol,根据转移电子守恒,第一阶段:阳极上氯离子放电,阴极上铜离子放电,电解的方程式是Cu2++2Cl-Cu+Cl2↑,氯离子完全反应时,剩余铜离子2.5 mol;第二阶段:阳极上氢氧根离子放电,阴极上铜离子放电,电解方程式是2Cu2++2H2O2Cu+4H++O2↑;第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电,电解的方程式是2H2O2H2↑+O2↑。]
4.C [用惰性电极电解AgNO3溶液,总的电解反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3,阴极上析出Ag,阳极上放出O2,A、D错误;由于生成HNO3,溶液的pH降低,B错误;要使溶液恢复到电解前的状况要加入的物质应是Ag2O固体,C正确。]
5.(1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4、NaCl CuO(或CuCO3)、HCl
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质是HCl、CuCl2。(2)实质上是电解水,H+、OH-分别在两极上放电,因此,其电解质是Na2SO4、H2SO4。(3)电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl气体。
