人教版选修四《化学反应原理》第二章化学反应速率和化学平衡第三节化学平衡课件(共16张PPT)
文档属性
| 名称 | 人教版选修四《化学反应原理》第二章化学反应速率和化学平衡第三节化学平衡课件(共16张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 257.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-04-12 00:00:00 | ||
图片预览





文档简介
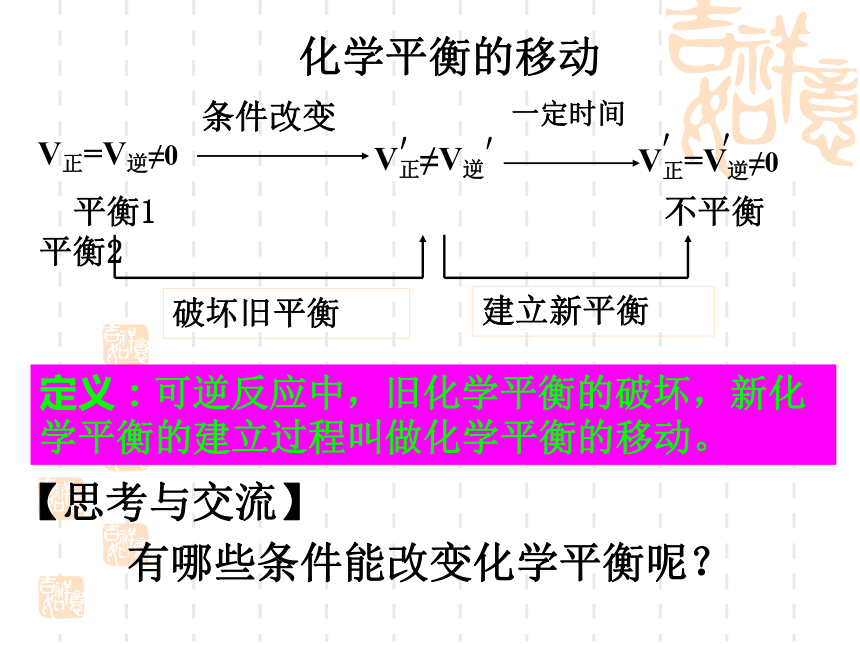
课件16张PPT。定义:可逆反应中,旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变 平衡1 不平衡 平衡2建立新平衡破坏旧平衡V正=V逆≠0′′一定时间化学平衡的移动′′【思考与交流】有哪些条件能改变化学平衡呢?2-3 化学平衡的移动一、浓度对化学平衡的影响:实验探究(实验2-6)
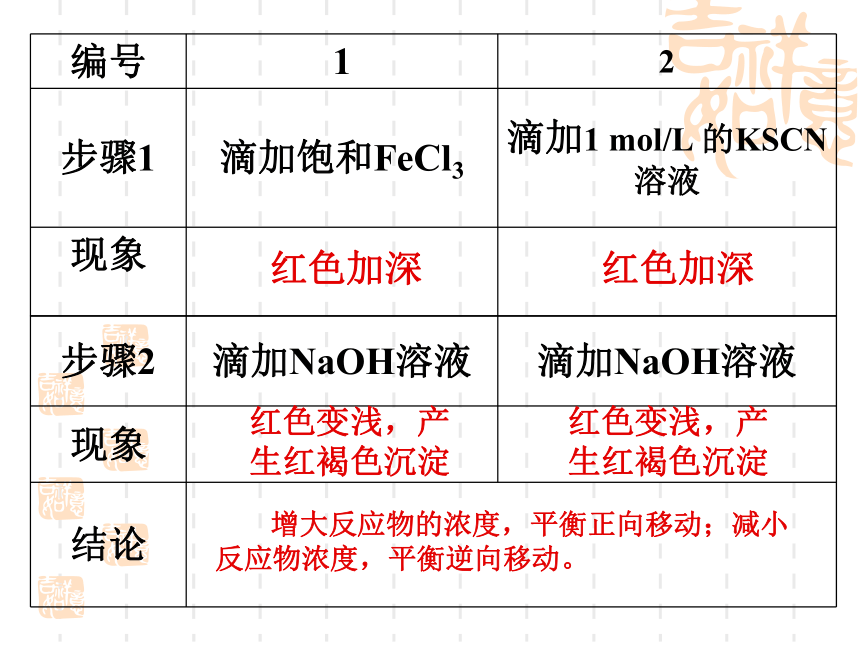
Fe3+ + 3SCN — Fe(SCN)3(红色)(无色)(黄色)实验步骤:
1、向盛有5ml ml 0.005 mol/L FeCl3溶液的试管中加入5ml 0.01mol/L KSCN溶液。
2、将上述溶液分成三等份分别置于三支试管中,向其中一支试管加入饱和的FeCl3溶液4滴,充分振荡,观察颜色变化;向第二支试管滴加4滴1mol/LKSCN溶液,观察颜色变化。
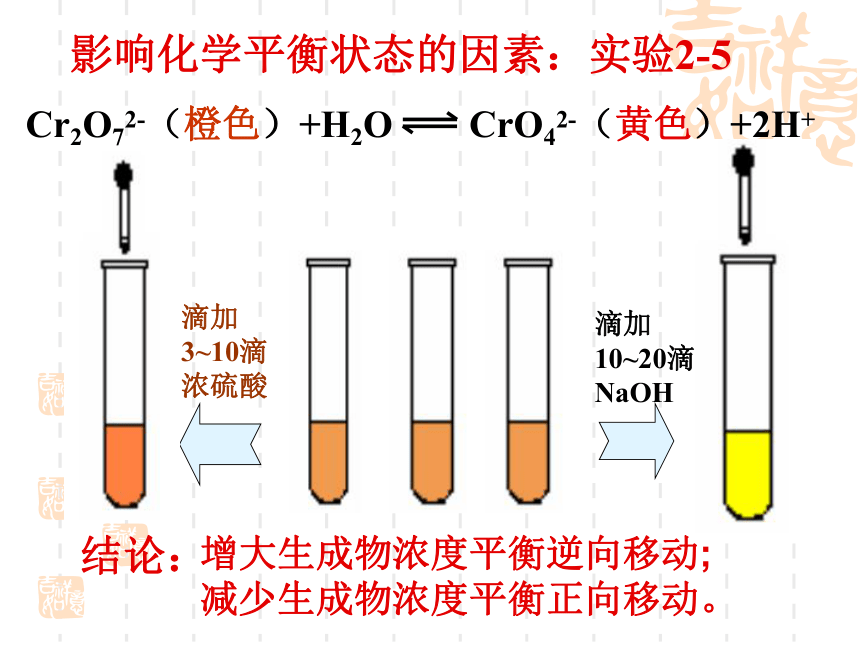
3、向上述第一、第二支试管中各滴加0.01mol/L NaOH溶液3-5滴,观察现象红色加深红色加深红色变浅,产生红褐色沉淀红色变浅,产生红褐色沉淀 增大反应物的浓度,平衡正向移动;减小反应物浓度,平衡逆向移动。 影响化学平衡状态的因素:实验2-5 滴加3~10滴浓硫酸滴加10~20滴NaOHCr2O72-(橙色)+H2O CrO42-(黄色)+2H+增大生成物浓度平衡逆向移动;
减少生成物浓度平衡正向移动。结论:小结:在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向着正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向着逆反应方向移动。二、温度对化学平衡的影响(红棕色)(无色)[讨论]A:混和气体受热颜色变深,说明① ; ② 。
B:混和气体遇冷颜色变浅,说明① ; ② 。
NO2浓度增大 平衡逆向(吸热方向)移动NO2浓度减小 平衡正向(放热方向)移动2NO2 (g) N2O4 (g) △H=-56.9kJ/mol[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。三、压强对平衡的影响[结论]在其它条件不变的情况下:
A:增大压强,会使化学平衡向着气体体积缩小的方向移动;
B:减小压强,会使化学平衡向着气体体积增大的方向移动。用速率时间图分析催化剂与化学平衡的关系Vtt1t2四、平衡移动原理(勒夏特列原理) 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变方向移动。指明平衡移动的方向——能“减弱”外界条件的改变的方向。(定性)
揭示平衡移动的结果——只是“减小”外界条件的变化量,而不是完全抵消外界条件的变化量。(定量) [总结]改变反应条件时平衡移动的方向增大反应物浓度
减少生成物浓度向正反应方向移动减小反应物浓度
增大生成物浓度向逆反应方向移动增 大 压 强向气体体积缩小的方向移动减 小 压 强向气体体积增大的方向移动升 高 温 度向吸热反应方向移动向放热反应方向移动降 低 温 度勒夏特列原理思考题1 对于反应:2A(g)+B(g) 2C(g) ΔH>0,下列反应条件有利于生成C的是( )
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
C思考题2 在化学反应2A+B 2C达到平衡时,若升高温,C的含量增加,则以反应的正反应是( )
A、放热反应
B、是吸热反应
C、没有显著的热量变化
D、原化学平衡没有发生移动B思考题3 下列事实不能用勒夏特列原理解释的是( )
A.红棕色的NO2加压后颜色先变深后变浅
B.在双氧水中加入MnO2迅速产生O2
C.黄绿色的氯水光照后颜色变浅
D.打开冰镇啤酒的瓶盖后,溢出大量泡沫
B
Fe3+ + 3SCN — Fe(SCN)3(红色)(无色)(黄色)实验步骤:
1、向盛有5ml ml 0.005 mol/L FeCl3溶液的试管中加入5ml 0.01mol/L KSCN溶液。
2、将上述溶液分成三等份分别置于三支试管中,向其中一支试管加入饱和的FeCl3溶液4滴,充分振荡,观察颜色变化;向第二支试管滴加4滴1mol/LKSCN溶液,观察颜色变化。
3、向上述第一、第二支试管中各滴加0.01mol/L NaOH溶液3-5滴,观察现象红色加深红色加深红色变浅,产生红褐色沉淀红色变浅,产生红褐色沉淀 增大反应物的浓度,平衡正向移动;减小反应物浓度,平衡逆向移动。 影响化学平衡状态的因素:实验2-5 滴加3~10滴浓硫酸滴加10~20滴NaOHCr2O72-(橙色)+H2O CrO42-(黄色)+2H+增大生成物浓度平衡逆向移动;
减少生成物浓度平衡正向移动。结论:小结:在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向着正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向着逆反应方向移动。二、温度对化学平衡的影响(红棕色)(无色)[讨论]A:混和气体受热颜色变深,说明① ; ② 。
B:混和气体遇冷颜色变浅,说明① ; ② 。
NO2浓度增大 平衡逆向(吸热方向)移动NO2浓度减小 平衡正向(放热方向)移动2NO2 (g) N2O4 (g) △H=-56.9kJ/mol[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。三、压强对平衡的影响[结论]在其它条件不变的情况下:
A:增大压强,会使化学平衡向着气体体积缩小的方向移动;
B:减小压强,会使化学平衡向着气体体积增大的方向移动。用速率时间图分析催化剂与化学平衡的关系Vtt1t2四、平衡移动原理(勒夏特列原理) 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变方向移动。指明平衡移动的方向——能“减弱”外界条件的改变的方向。(定性)
揭示平衡移动的结果——只是“减小”外界条件的变化量,而不是完全抵消外界条件的变化量。(定量) [总结]改变反应条件时平衡移动的方向增大反应物浓度
减少生成物浓度向正反应方向移动减小反应物浓度
增大生成物浓度向逆反应方向移动增 大 压 强向气体体积缩小的方向移动减 小 压 强向气体体积增大的方向移动升 高 温 度向吸热反应方向移动向放热反应方向移动降 低 温 度勒夏特列原理思考题1 对于反应:2A(g)+B(g) 2C(g) ΔH>0,下列反应条件有利于生成C的是( )
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
C思考题2 在化学反应2A+B 2C达到平衡时,若升高温,C的含量增加,则以反应的正反应是( )
A、放热反应
B、是吸热反应
C、没有显著的热量变化
D、原化学平衡没有发生移动B思考题3 下列事实不能用勒夏特列原理解释的是( )
A.红棕色的NO2加压后颜色先变深后变浅
B.在双氧水中加入MnO2迅速产生O2
C.黄绿色的氯水光照后颜色变浅
D.打开冰镇啤酒的瓶盖后,溢出大量泡沫
B
