【核心素养】8.2 常见的酸和碱 课件--科粤版(2024)九年级化学下册
文档属性
| 名称 | 【核心素养】8.2 常见的酸和碱 课件--科粤版(2024)九年级化学下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-31 00:00:00 | ||
图片预览








文档简介
(共44张PPT)
第八单元 常见的酸、碱、盐
常见的酸和碱 第2课时
(科粤版)九年级
下
01
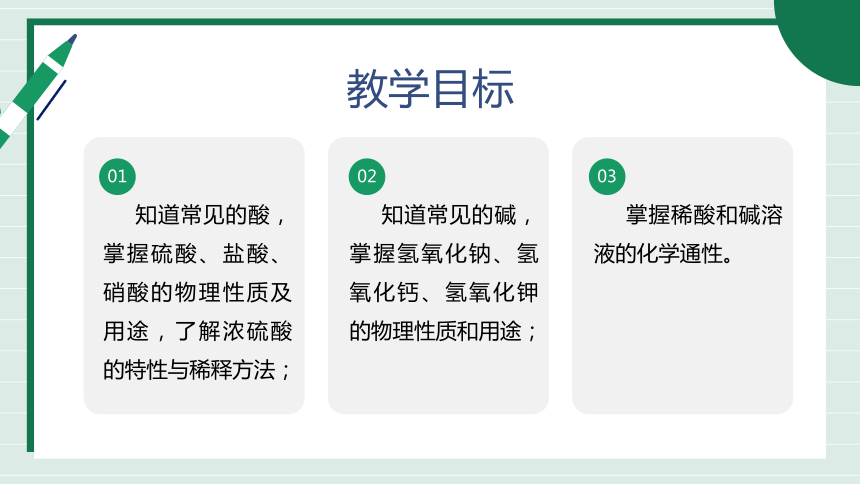
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
知道常见的酸,掌握硫酸、盐酸、硝酸的物理性质及用途,了解浓硫酸的特性与稀释方法;
01
02
知道常见的碱,掌握氢氧化钠、氢氧化钙、氢氧化钾的物理性质和用途;
03
掌握稀酸和碱溶液的化学通性。
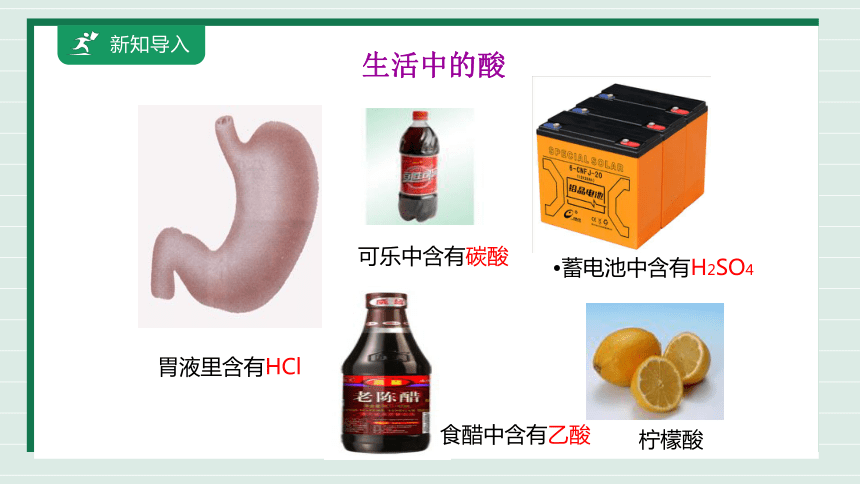
新知导入
生活中的酸
胃液里含有HCl
食醋中含有乙酸
可乐中含有碳酸
柠檬酸
蓄电池中含有H2SO4
新知导入
生活中的碱
厨房清洁剂里含有NaOH
玻璃清洁剂中含有氨水
在树木上涂刷含有硫黄粉等的石灰浆,可保护树木,防止冻伤,并防止害虫生卵
探究新知
常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?
注意:闻气体的方法
探究新知
探究新知
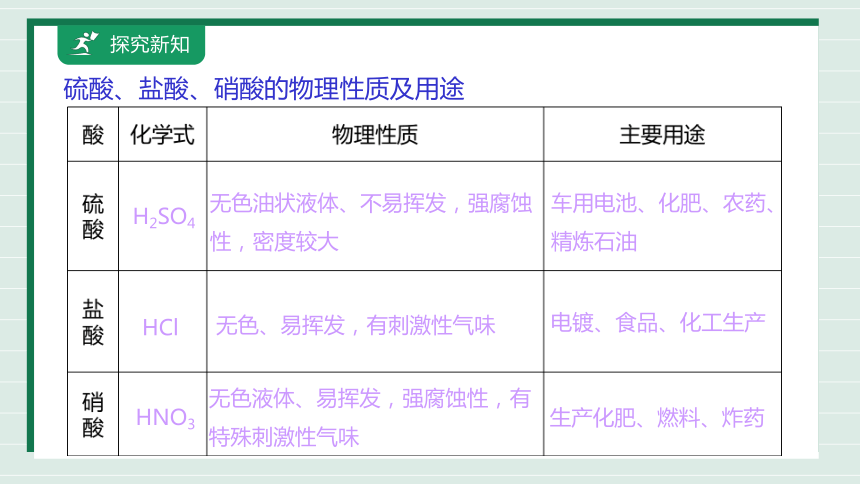
硫酸、盐酸、硝酸的物理性质及用途
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
探究新知
观察活动一:浓硫酸的脱水性
蔗糖迅速变黑、膨胀、有刺激性气味的气体放出
接触到浓硫酸的纸张先变黄后变黑
肉皮腐烂,颜色变为鲜红色
浓硫酸有强腐蚀性
探究新知
浓硫酸是危险品,保管和使用都要格外小心。
——可做干燥剂
浓硫酸有强吸水性
浓硫酸对衣物、皮肤等有强腐蚀性,如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
实验表明:浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有强脱水性。
探究新知
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)并不断搅拌。
不可将水倒进浓硫酸里
探究新知
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
探究新知
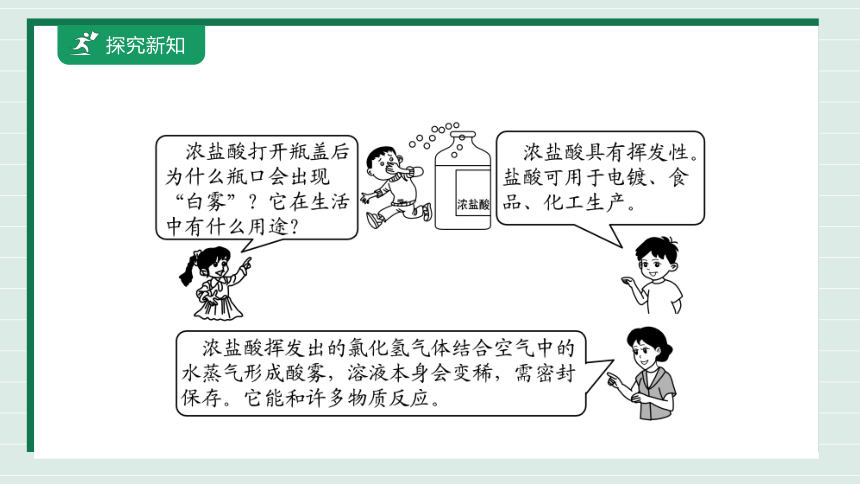
[情景展示] 浓盐酸打开瓶盖后瓶口会出现“白雾”,并闻到有刺激性气味。
浓盐酸的挥发性
探究新知
稀酸的化学性质
任务二
有气泡产生,反应速率:镁>铝>锌>铁
较活泼
金属
+
酸
↓
盐
+
氢气
①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑
由金属离子和酸根离子组成的化合物统称为盐
注 意
实验活动一:酸与较活泼金属反应
探究新知
金属氧化物
+
酸
↓
盐
+
氢气
Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
实验活动二:酸与金属氧化物反应
探究新知
盐
+
酸
↓
新盐
+
新酸
AgNO3+HCl == AgCl ↓ + HNO3
有白色沉淀生成
实验活动三:酸与盐反应
硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。
探究新知
已知鸡蛋壳的主要成分是碳酸钙,知识回忆 ↙
+
=
CaCO3+2HCl=CaCl2+H2O+CO2↑
课堂小结
课堂小结
探究新知
任务三
常见的碱
氢氧化钙、氢氧化钠、氢氧化钾是常见的碱
氢氧化钠
氢氧化钙
氢氧化钾
探究新知
①氢氧化钠是白色的固体。
②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。
③氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。
④氢氧化钠极易溶于水,溶解时会放出大量的热。
1. 氢氧化钠(NaOH)
探究新知
1.氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。
2.如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
探究新知
2. 氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
(1)氢氧化钙也有腐蚀性,使用时应注意安全。
(2)常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)等。
探究新知
注
氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途:
熟石灰或消石灰
烧碱、火碱或苛性钠
苛性钾
Ca(OH)2
NaOH
KOH
建筑材料、漂白剂、处理污水、改良酸性土壤
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
电池工业
探究新知
探究新知
石灰吟 于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
探究新知
NaOH溶液和石灰水都能吸收二氧化碳气体,固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而变质。
氢氧化钠有强烈的腐蚀性,使用时要十分小心,特别注意防止它对眼睛的伤害。如果不慎沾到氢氧化钠,应立即用水冲洗。
注 意
探究新知
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
探究新知
任务四
碱溶液的化学性质
实验活动一:碱与非金属氧化物反应
试管液面上升,第一支试管液面比第二支低
非金属氧化物+
碱
↓
盐
+
水
①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O
探究新知
实验活动二 验证氢氧化钠与二氧化碳的反应
探究新知
[归纳提升]滴入氢氧化钠溶液后,吸收装置内的二氧化碳,内部压强减小,所以气球膨胀。NaOH和CO2反应生成Na2CO3和H2O,由于反应中没有出现常见的颜色、状态、气体、沉淀等现象,因此很难判断出发生了反应。CO2到底是与H2O反应还是与NaOH反应,需通过对比实验来验证,因此可设计如下对比实验验证。
第八章 常见的酸、 碱、 盐
探究新知
实验活动二:碱与盐反应
①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀
盐
+
碱
↓
新盐
+
新碱
①Ca(OH)2+CuSO4 ==Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==2Fe(OH)3↓ +3CaCl2
探究新知
氢氧化钠、氢氧化钙、氢氧化钾在水溶液中都能产生氢氧根离子(OH-),这使碱溶液具有相似的化学性质。
课堂小结
例题分析
【例1】下列关于浓盐酸的叙述正确的是( )
A.浓盐酸是一种无色无味的液体
B.浓盐酸在空气中会冒白烟
C.浓盐酸敞口放置一段时间后,溶质质量和溶质质量分数都会减小
D.盐酸就是液态氯化氢
C
导引:浓盐酸是一种无色有刺激性气味的液体(工业盐酸因含有铁离子而显黄色);浓盐酸具有挥发性,在空气中会形成白雾(盐酸小液滴悬浮在空气中形成的),还会使溶质、溶液质量减小,溶质质量分数也会减小;盐酸是氯化氢气体的水溶液,属于混合物,液态氯化氢是纯净物,二者不能等同。
例题分析
拓展:(1)酸溶液与酸性溶液
(2)碱溶液与碱性溶液
课堂小练
1.下列物质放入到稀硫酸中,无气体生成的是( )
A.铝 B 碳酸钠 C 铁锈 D石灰石
2.下列物质可由金属与发生置换反应得到的是( )
3.在实验室制备氢气可以用( )
A 炭粒与水反应 B铁屑与盐酸反应
C 锌粒与硝酸反应 D铁屑与浓硫酸反应
4.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的( )
A 能与金属反应 B 能与金属氧化物反应 C 能使指示剂变色 D能溶于水
A.CuCl2 B.Fe2(SO4)3 C.ZnCl2 D.AgCl
C
C
B
B
课堂小练
Fe2O3+6HCl=2FeCl3+3H2O
Fe +2HCl= H2 + FeCl2
答:稀硫酸受热水分蒸发变成浓硫酸,浓硫酸有强烈的腐蚀性,能夺取纸张里的水分,生成黑色的炭.
5.向放有铁锈的钉子的试管中加入过量盐酸,充分反应后,铁锈消失,
并有气泡产生,写出有关反应方式:__________________________、
_____________________________ .
6.先用稀硫酸在普通的纸(主要由纤维组成)上写好字,然后在酒精灯火焰上(隔开一定距离)慢慢烘干.这时纸上写字的地方因炭化变成焦黑,原来写的字迹就清楚地显出来.试说明其中的道理.
课堂总结
常见的酸
物理性质
用途
浓盐酸:有挥发性,应密封保存
浓硫酸
特性:①吸水性(做气体干燥剂);②脱水性;③强氧化性
稀释:将浓硫酸沿器壁慢慢倒入水中,并不断搅拌
盐酸:重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
硫酸:重要化工原料。用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油和金属防锈等;浓硫酸有吸水性,在实验室中常用它做干燥剂
1.酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色。
2.酸+金属 盐+氢气注:金属的活动性必须排在氢前面
如:Zn+H2SO4=ZnSO4+H2↑
3.酸+金属氧化物 盐+水如:Fe2O3+6HCl=2FeCl3+3H2O
4.酸 + 盐 → 新盐 + 新酸如:AgNO3+HCl=AgCl ↓ +HNO3
稀酸的化学性质
课堂总结
常见的碱
物理性质
化学性质
NaOH:俗名:苛性钠、火碱、烧碱;极易溶于水,在空气中极易潮解,有强腐蚀性
Ca(OH)2:俗名:熟石灰、消石灰;微溶于水、有腐蚀性,溶解度随温度升高而减小
与指示剂作用:石蕊+碱 蓝色,酚酞+碱
碱+非金属氧化物 盐+水
例:2NaOH+CO2 2Na2CO3+H2O
红色
碱+盐 新碱+新盐
如:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
板书设计
酸的化学通性
化学通性
与活泼金 属反应
通式:酸 +活泼金属→盐 +H2↑(置换反应)
举例
铁和稀硫酸(填化学方程式,后同)__________________________
现象:______________________________
锌和稀硫酸:________________________________________
现象:______________________________________________
与某些金属 氧化物反应
通式:酸 +金属氧化物→盐 +H2O(复分解反应)
氧化铁和稀硫酸:____________________________________
现象:_________________________________
氧化铜和稀硫酸:_________________________________
现象:_________________________________
举例
反应剧烈,产生大量气泡
Fe+H2SO4=== FeSO4+H2↑
产生少量气泡,溶液变为浅绿色
固体溶解,溶液变为黄色
Zn+H2SO4=== ZnSO4+H2↑
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
CuO+H2SO4=== CuSO4+H2O
固体溶解,溶液变为蓝色
板书设计
碱的化学通性
化学通性
与指示剂反应:能使紫色石蕊溶液_______ ,能使无色酚酞溶液________
与某些非金属 氧化物反应
通式:碱 +非金属氧化物→盐 +H2O
举例
氢氧化钠和二氧化碳
(吸收二氧化碳,填化学方程式,后同) _________________________________
氢氧化钙和二氧化碳(检验二氧化碳)
_________________________________
现象:___________________
与酸反应
通式:酸 +碱→盐 +H2O(中和反应)(复分解反应)
氢氧化铁和稀盐酸_______________________________
现象:_________________________________
氢氧化铜和稀硫酸_______________________________
现象:_________________________________
举例
变蓝
蓝色固体溶解,溶液由无色变为蓝色
红褐色固体溶解,溶液由无色变为黄色
有白色沉淀产生
变红
2NaOH+CO2=== Na2CO3+H2O
Ca(OH)2+CO2=== CaCO3↓+H2O
Fe(OH)3+3HCl=== FeCl3+3H2O
Cu(OH)2+H2SO4=== CuSO4+2H2O
43
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第八单元 常见的酸、碱、盐
常见的酸和碱 第2课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
知道常见的酸,掌握硫酸、盐酸、硝酸的物理性质及用途,了解浓硫酸的特性与稀释方法;
01
02
知道常见的碱,掌握氢氧化钠、氢氧化钙、氢氧化钾的物理性质和用途;
03
掌握稀酸和碱溶液的化学通性。
新知导入
生活中的酸
胃液里含有HCl
食醋中含有乙酸
可乐中含有碳酸
柠檬酸
蓄电池中含有H2SO4
新知导入
生活中的碱
厨房清洁剂里含有NaOH
玻璃清洁剂中含有氨水
在树木上涂刷含有硫黄粉等的石灰浆,可保护树木,防止冻伤,并防止害虫生卵
探究新知
常见的酸
盐酸、硫酸、硝酸都是常见的重要的酸
观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?
注意:闻气体的方法
探究新知
探究新知
硫酸、盐酸、硝酸的物理性质及用途
H2SO4
HCl
HNO3
无色、易挥发,有刺激性气味
电镀、食品、化工生产
无色油状液体、不易挥发,强腐蚀性,密度较大
车用电池、化肥、农药、精炼石油
无色液体、易挥发,强腐蚀性,有特殊刺激性气味
生产化肥、燃料、炸药
探究新知
观察活动一:浓硫酸的脱水性
蔗糖迅速变黑、膨胀、有刺激性气味的气体放出
接触到浓硫酸的纸张先变黄后变黑
肉皮腐烂,颜色变为鲜红色
浓硫酸有强腐蚀性
探究新知
浓硫酸是危险品,保管和使用都要格外小心。
——可做干燥剂
浓硫酸有强吸水性
浓硫酸对衣物、皮肤等有强腐蚀性,如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。
实验表明:浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有强脱水性。
探究新知
浓硫酸稀释方法:
把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流(或沿着烧杯壁缓缓倾倒)并不断搅拌。
不可将水倒进浓硫酸里
探究新知
水的密度较浓硫酸小,当水滴入浓硫酸溶解时会产生大量热使水立即沸腾,带着硫酸液滴向四周飞溅,十分危险!
而将密度大的浓硫酸缓慢地注入水中,及时搅拌,使产生的热得以迅速扩散,操作安全!
探究新知
[情景展示] 浓盐酸打开瓶盖后瓶口会出现“白雾”,并闻到有刺激性气味。
浓盐酸的挥发性
探究新知
稀酸的化学性质
任务二
有气泡产生,反应速率:镁>铝>锌>铁
较活泼
金属
+
酸
↓
盐
+
氢气
①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑
由金属离子和酸根离子组成的化合物统称为盐
注 意
实验活动一:酸与较活泼金属反应
探究新知
金属氧化物
+
酸
↓
盐
+
氢气
Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O
铁锈溶解,溶液变黄
实验活动二:酸与金属氧化物反应
探究新知
盐
+
酸
↓
新盐
+
新酸
AgNO3+HCl == AgCl ↓ + HNO3
有白色沉淀生成
实验活动三:酸与盐反应
硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。
探究新知
已知鸡蛋壳的主要成分是碳酸钙,知识回忆 ↙
+
=
CaCO3+2HCl=CaCl2+H2O+CO2↑
课堂小结
课堂小结
探究新知
任务三
常见的碱
氢氧化钙、氢氧化钠、氢氧化钾是常见的碱
氢氧化钠
氢氧化钙
氢氧化钾
探究新知
①氢氧化钠是白色的固体。
②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。
③氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。
④氢氧化钠极易溶于水,溶解时会放出大量的热。
1. 氢氧化钠(NaOH)
探究新知
1.氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。
2.如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
探究新知
2. 氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
(1)氢氧化钙也有腐蚀性,使用时应注意安全。
(2)常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)等。
探究新知
注
氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途:
熟石灰或消石灰
烧碱、火碱或苛性钠
苛性钾
Ca(OH)2
NaOH
KOH
建筑材料、漂白剂、处理污水、改良酸性土壤
制肥皂、洗涤剂、造纸、纺织工业、炼制石油
电池工业
探究新知
探究新知
石灰吟 于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨全不怕,
要留清白在人间。
探究新知
NaOH溶液和石灰水都能吸收二氧化碳气体,固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而变质。
氢氧化钠有强烈的腐蚀性,使用时要十分小心,特别注意防止它对眼睛的伤害。如果不慎沾到氢氧化钠,应立即用水冲洗。
注 意
探究新知
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
探究新知
任务四
碱溶液的化学性质
实验活动一:碱与非金属氧化物反应
试管液面上升,第一支试管液面比第二支低
非金属氧化物+
碱
↓
盐
+
水
①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O
探究新知
实验活动二 验证氢氧化钠与二氧化碳的反应
探究新知
[归纳提升]滴入氢氧化钠溶液后,吸收装置内的二氧化碳,内部压强减小,所以气球膨胀。NaOH和CO2反应生成Na2CO3和H2O,由于反应中没有出现常见的颜色、状态、气体、沉淀等现象,因此很难判断出发生了反应。CO2到底是与H2O反应还是与NaOH反应,需通过对比实验来验证,因此可设计如下对比实验验证。
第八章 常见的酸、 碱、 盐
探究新知
实验活动二:碱与盐反应
①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀
盐
+
碱
↓
新盐
+
新碱
①Ca(OH)2+CuSO4 ==Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==2Fe(OH)3↓ +3CaCl2
探究新知
氢氧化钠、氢氧化钙、氢氧化钾在水溶液中都能产生氢氧根离子(OH-),这使碱溶液具有相似的化学性质。
课堂小结
例题分析
【例1】下列关于浓盐酸的叙述正确的是( )
A.浓盐酸是一种无色无味的液体
B.浓盐酸在空气中会冒白烟
C.浓盐酸敞口放置一段时间后,溶质质量和溶质质量分数都会减小
D.盐酸就是液态氯化氢
C
导引:浓盐酸是一种无色有刺激性气味的液体(工业盐酸因含有铁离子而显黄色);浓盐酸具有挥发性,在空气中会形成白雾(盐酸小液滴悬浮在空气中形成的),还会使溶质、溶液质量减小,溶质质量分数也会减小;盐酸是氯化氢气体的水溶液,属于混合物,液态氯化氢是纯净物,二者不能等同。
例题分析
拓展:(1)酸溶液与酸性溶液
(2)碱溶液与碱性溶液
课堂小练
1.下列物质放入到稀硫酸中,无气体生成的是( )
A.铝 B 碳酸钠 C 铁锈 D石灰石
2.下列物质可由金属与发生置换反应得到的是( )
3.在实验室制备氢气可以用( )
A 炭粒与水反应 B铁屑与盐酸反应
C 锌粒与硝酸反应 D铁屑与浓硫酸反应
4.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的( )
A 能与金属反应 B 能与金属氧化物反应 C 能使指示剂变色 D能溶于水
A.CuCl2 B.Fe2(SO4)3 C.ZnCl2 D.AgCl
C
C
B
B
课堂小练
Fe2O3+6HCl=2FeCl3+3H2O
Fe +2HCl= H2 + FeCl2
答:稀硫酸受热水分蒸发变成浓硫酸,浓硫酸有强烈的腐蚀性,能夺取纸张里的水分,生成黑色的炭.
5.向放有铁锈的钉子的试管中加入过量盐酸,充分反应后,铁锈消失,
并有气泡产生,写出有关反应方式:__________________________、
_____________________________ .
6.先用稀硫酸在普通的纸(主要由纤维组成)上写好字,然后在酒精灯火焰上(隔开一定距离)慢慢烘干.这时纸上写字的地方因炭化变成焦黑,原来写的字迹就清楚地显出来.试说明其中的道理.
课堂总结
常见的酸
物理性质
用途
浓盐酸:有挥发性,应密封保存
浓硫酸
特性:①吸水性(做气体干燥剂);②脱水性;③强氧化性
稀释:将浓硫酸沿器壁慢慢倒入水中,并不断搅拌
盐酸:重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中含有盐酸,可帮助消化
硫酸:重要化工原料。用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油和金属防锈等;浓硫酸有吸水性,在实验室中常用它做干燥剂
1.酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色。
2.酸+金属 盐+氢气注:金属的活动性必须排在氢前面
如:Zn+H2SO4=ZnSO4+H2↑
3.酸+金属氧化物 盐+水如:Fe2O3+6HCl=2FeCl3+3H2O
4.酸 + 盐 → 新盐 + 新酸如:AgNO3+HCl=AgCl ↓ +HNO3
稀酸的化学性质
课堂总结
常见的碱
物理性质
化学性质
NaOH:俗名:苛性钠、火碱、烧碱;极易溶于水,在空气中极易潮解,有强腐蚀性
Ca(OH)2:俗名:熟石灰、消石灰;微溶于水、有腐蚀性,溶解度随温度升高而减小
与指示剂作用:石蕊+碱 蓝色,酚酞+碱
碱+非金属氧化物 盐+水
例:2NaOH+CO2 2Na2CO3+H2O
红色
碱+盐 新碱+新盐
如:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
板书设计
酸的化学通性
化学通性
与活泼金 属反应
通式:酸 +活泼金属→盐 +H2↑(置换反应)
举例
铁和稀硫酸(填化学方程式,后同)__________________________
现象:______________________________
锌和稀硫酸:________________________________________
现象:______________________________________________
与某些金属 氧化物反应
通式:酸 +金属氧化物→盐 +H2O(复分解反应)
氧化铁和稀硫酸:____________________________________
现象:_________________________________
氧化铜和稀硫酸:_________________________________
现象:_________________________________
举例
反应剧烈,产生大量气泡
Fe+H2SO4=== FeSO4+H2↑
产生少量气泡,溶液变为浅绿色
固体溶解,溶液变为黄色
Zn+H2SO4=== ZnSO4+H2↑
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
CuO+H2SO4=== CuSO4+H2O
固体溶解,溶液变为蓝色
板书设计
碱的化学通性
化学通性
与指示剂反应:能使紫色石蕊溶液_______ ,能使无色酚酞溶液________
与某些非金属 氧化物反应
通式:碱 +非金属氧化物→盐 +H2O
举例
氢氧化钠和二氧化碳
(吸收二氧化碳,填化学方程式,后同) _________________________________
氢氧化钙和二氧化碳(检验二氧化碳)
_________________________________
现象:___________________
与酸反应
通式:酸 +碱→盐 +H2O(中和反应)(复分解反应)
氢氧化铁和稀盐酸_______________________________
现象:_________________________________
氢氧化铜和稀硫酸_______________________________
现象:_________________________________
举例
变蓝
蓝色固体溶解,溶液由无色变为蓝色
红褐色固体溶解,溶液由无色变为黄色
有白色沉淀产生
变红
2NaOH+CO2=== Na2CO3+H2O
Ca(OH)2+CO2=== CaCO3↓+H2O
Fe(OH)3+3HCl=== FeCl3+3H2O
Cu(OH)2+H2SO4=== CuSO4+2H2O
43
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
