2025届高三化学二轮专题练习 - 热重曲线分析及其计算(含解析)
文档属性
| 名称 | 2025届高三化学二轮专题练习 - 热重曲线分析及其计算(含解析) |  | |
| 格式 | DOCX | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
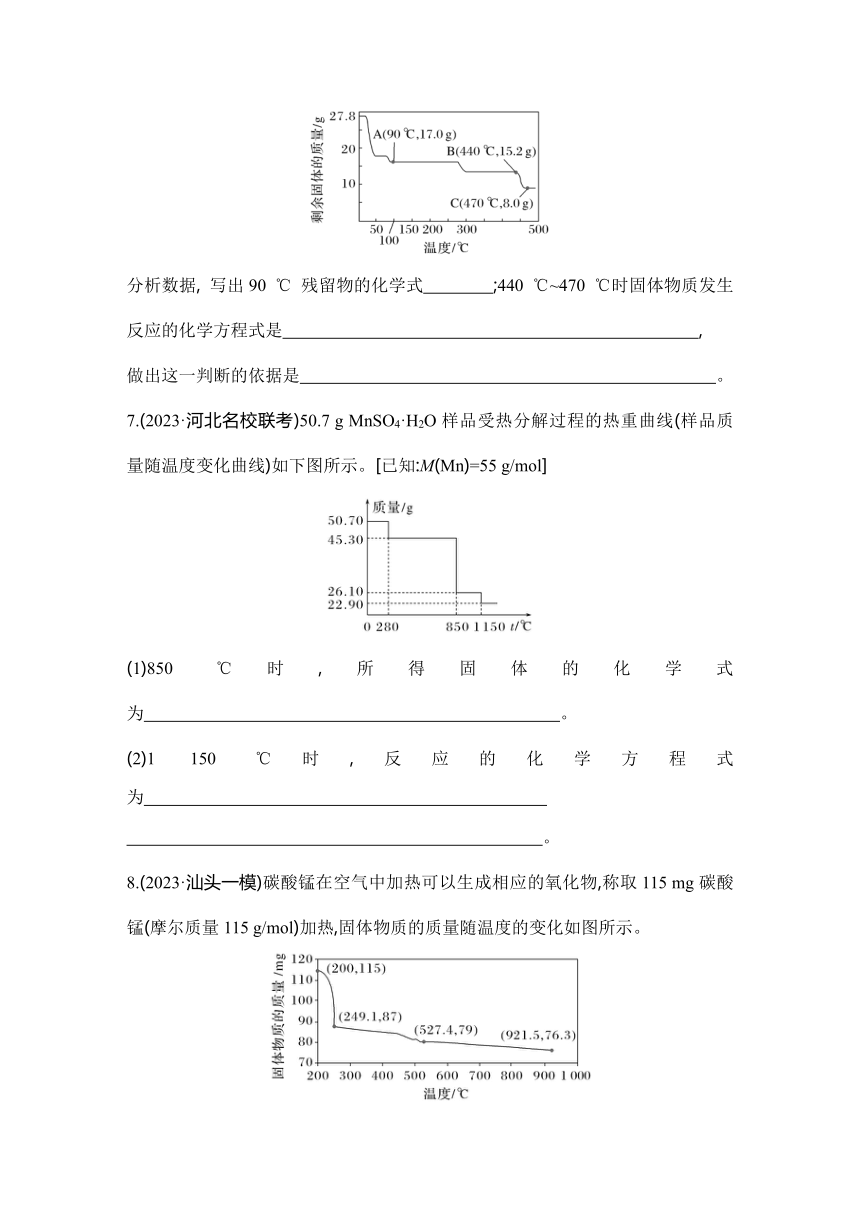
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-01 19:31:38 | ||
图片预览



文档简介
热重曲线分析及其计算
1.(2023·浙江精诚联盟三模)测得碱式碳酸铜[aCu(OH)2·bCuCO3]的热重分析结果如图所示,已知失重至65.7%时固体呈砖红色,则计算可知= (保留3位有效数字)。
2.(2024·广州高三段训)过硼酸钠晶体(NaBO3·4H2O)也可用作无毒漂白剂,加热至70 ℃以上会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的曲线如图所示,则T2~T3所对应的化学方程式为 。
3.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。则300 ℃时,剩余固体中n(Mn)∶n(O)为 ;图中C点对应固体的成分为 (填化学式)。
4.Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290 ℃时已完全脱水。计算确定A、B、C点物质的化学式为 、 、 。
5.为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确称取36.50 g样品加热,样品的固体残留率(×100%)随温度的变化如下图所示。
(1)300 ℃时残留固体的成分为 ,900 ℃时残留固体的成分为 。
(2)500 ℃时固体的成分及质量 。
6.取27.8 g FeSO4·7H2O隔绝空气加热至不同温度, 剩余固体的质量变化如图所示。
分析数据, 写出90 ℃ 残留物的化学式 ;440 ℃~470 ℃时固体物质发生反应的化学方程式是 ,
做出这一判断的依据是 。
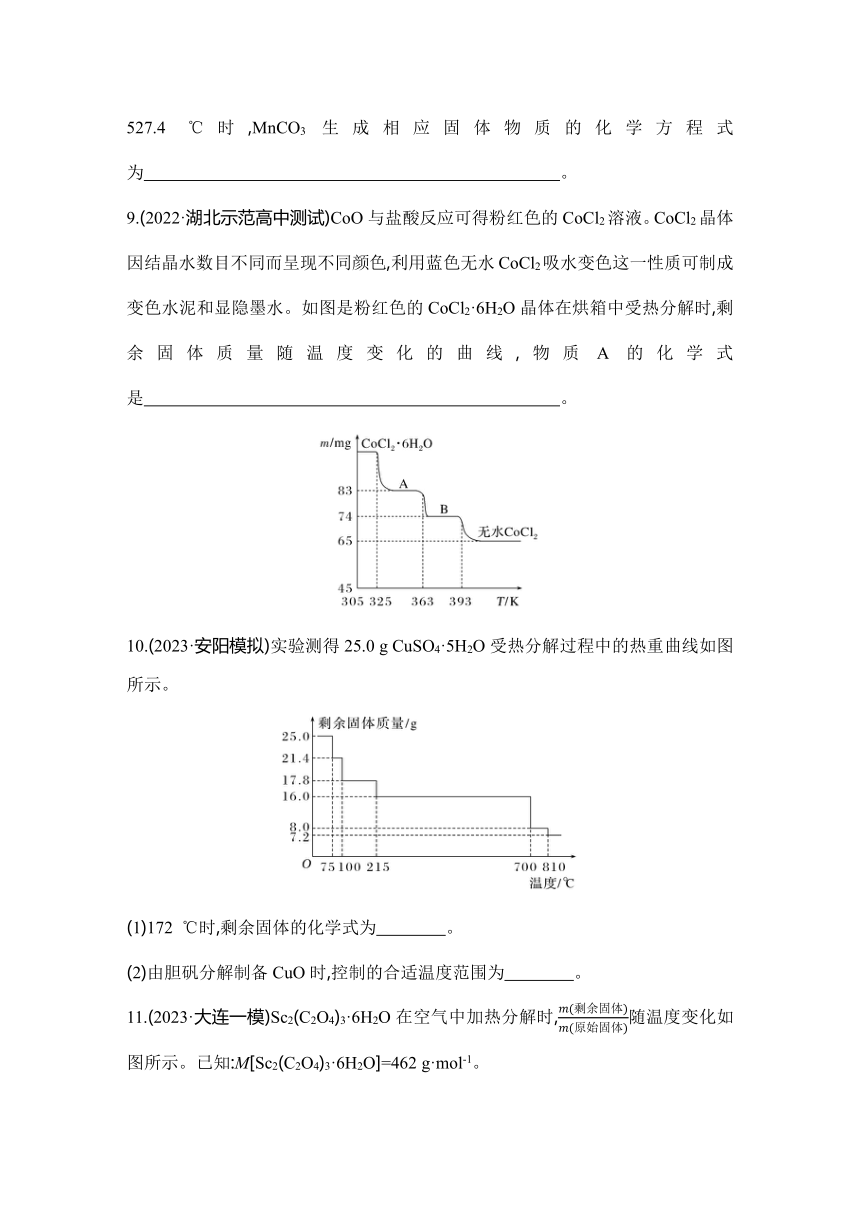
7.(2023·河北名校联考)50.7 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。[已知:M(Mn)=55 g/mol]
(1)850 ℃时,所得固体的化学式为 。
(2)1 150 ℃时,反应的化学方程式为
。
8.(2023·汕头一模)碳酸锰在空气中加热可以生成相应的氧化物,称取115 mg碳酸锰(摩尔质量115 g/mol)加热,固体物质的质量随温度的变化如图所示。
527.4 ℃时,MnCO3生成相应固体物质的化学方程式为 。
9.(2022·湖北示范高中测试)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是 。
10.(2023·安阳模拟)实验测得25.0 g CuSO4·5H2O受热分解过程中的热重曲线如图所示。
(1)172 ℃时,剩余固体的化学式为 。
(2)由胆矾分解制备CuO时,控制的合适温度范围为 。
11.(2023·大连一模)Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462 g·mol-1。
250 ℃时固体的主要成分是 (填化学式);550~850 ℃时反应的化学方程式为
。
12.(2023·南京二模)将空气以一定流速通过加热的CuS试样,测得固体质量和流出气体中SO2含量随温度的变化如图所示。在200~300 ℃范围内,CuS经历如下转化:CuS→Cu2S→CuO·CuSO4,固体质量减少的主要原因是 。
热重曲线分析及其计算
1.1.24
解析 失重至65.7%时为氧化亚铜,由原子守恒可计算,×100%=65.7%,解得=1.24。
2.NaBO3·3H2ONaBO3·H2O+2H2O
解析 30.8 g NaBO3·4H2O的物质的量为n==0.2 mol,T2时刻,失去的结晶水质量为30.8-27.2=3.6 g,物质的量为0.2 mol,所得晶体为NaBO3·3H2O,T2~T3失去的结晶水为27.2-20=7.2 g,物质的量为0.4 mol,剩余的晶体为NaBO3·H2O,所以T2~T3所对应的化学方程式为
NaBO3·3H2ONaBO3·H2O+2H2O。
3.1∶2 Mn3O4与MnO
解析 MnCO3的摩尔质量为115 g/mol,设MnCO3的物质的量为1 mol,则A点300 ℃时失重的质量为1 mol×115 g/mol×(1-75.65%)=28 g。已知CO的摩尔质量是28 g/mol,根据质量守恒定律,分解化学方程式为MnCO3MnO2+CO↑。所以A点300 ℃时固体成分的化学式为MnO2。则n(Mn)∶n(O)为1∶2。B点770 ℃时失重的质量为1 mol×115 g/mol×(1-66.38%)=38.7 g。由于300 ℃时固体的成分为MnO2,再加热造成失重的原因只能是氧元素以O2的形式逸散失去,随着氧元素的失去,锰的化合价也发生了变化。因此失去氧元素的物质的量为n(O)= mol,可表示为Mn,整理得化学式为Mn3O4。D点900 ℃时失重的质量为1 mol×115 g/mol×(1-61.74%)=44 g。失去的n(O)==1 mol,可表示为MnO(2-1)。
4.Co2O3 Co3O4 CoO
解析 Co(OH)2在加热分解过程中,Co原子的数目不变。设有1 mol Co(OH)2,质量为93 g。则固体中Co的物质的量为1 mol,质量为59 g。设290 ℃后固体的化学式为CoOx,A点固体的相对分子质量为93×89.25%≈83,此时x=1.5,即该固体为Co2O3;B点固体的相对分子质量为93×86.38%≈80.3,此时x≈,即该固体为Co3O4;C点固体的相对分子质量为93×80.65%≈75,此时x=1,即该固体为CoO。
5.(1)CaC2O4 CaO
(2)固体的成分为12.8 g CaC2O4和15.0 g CaCO3
解析 (1)n(CaC2O4·H2O)==0.25 mol,含有m(H2O)=0.25 mol×18 g/mol=4.50 g,在300 ℃时,×100%=87.67%,m(剩余)=36.50 g×87.67%≈32 g,减少的质量为36.50 g-32 g=4.50 g,故此时失去全部的结晶水,残留固体为CaC2O4,在900 ℃时,×100%=38.36%,m(剩余)=36.50 g×38.36%≈14 g,其中Ca的质量没有损失,含m(Ca)=0.25 mol×40 g/mol=10 g,另外还含有m(O)=14 g-10 g=4 g,n(O)=0.25 mol,则n(Ca) : n(O)=1∶1,化学式为CaO;(2)在600 ℃时,×100%=68.49%,m(剩余)=36.50 g×68.49%≈25 g,从300 ℃至600 ℃时,失去的总质量为32 g-25 g=7 g,失去物质的摩尔质量为=28 g/mol,则应为CO,所以CaC2O4失去CO后,产物为CaCO3,在500 ℃时,应为CaC2O4和CaCO3的混合物,样品中CaC2O4·H2O物质的量为=0.25 mol,设CaC2O4和CaCO3的物质的量分别为x mol和y mol,根据500 ℃时固体总质量可得128x+100y=36.5×76.16%,根据钙元素守恒可得x+y=0.25,解得x=0.1,y=0.15,m(CaC2O4)=0.1 mol×128 g/mol=12.8 g,m(CaCO3)=0.15 mol×100 g/mol=15 g,500 ℃时固体的成分为12.8 g CaC2O4和15.0 g CaCO3。
6.FeSO4·H2O 2FeSO4Fe2O3+SO2↑+SO3↑
27.8 g FeSO4·7H2O的物质的量为0.1 mol,加热分解到C点后质量不再变化,C为铁的氧化物,剩余固体是8 g,铁元素的质量为5.6 g,则氧元素的质量为2.4 g,可得出氧化物中铁和氧原子个数比为2∶3,故为Fe2O3;根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则生成SO2,由质量守恒定律得出化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
解析 27.8 g FeSO4·7H2O的物质的量为0.1 mol,结晶水完全失去时剩下固体的质量为27.8 g-0.7 mol×18 g·mol-1=15.2 g,由图可知B(440 ℃)完全失去结晶水,成分为FeSO4,对比B(440 ℃)和A(90 ℃)点,两者质量差为17.0 g-15.2 g=1.8 g,即A比B多一个结晶水,A点成分为FeSO4·H2O;自始至终,铁元素质量守恒,FeSO4·7H2O为0.1 mol,加热分解到C(470 ℃)点后质量不再变化,C点成分为铁的氧化物,剩余固体是8 g,铁元素的质量为5.6 g,则氧元素的质量为2.4 g,可得出氧化物中铁和氧原子个数比为2∶3,故为Fe2O3;根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则生成SO2,由质量守恒定律得出化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
7.(1)MnO2 (2)3MnO2Mn3O4+O2↑
解析 (1)50.70 g MnSO4·H2O样品n(锰)=n(MnSO4·H2O)=0.3 mol,其中n(H2O)=0.3 mol,m(H2O)=5.4 g,280 ℃时,所得固体质量为45.30 g,减少的质量为5.4 g,则说明该段失去结晶水,此时固体为MnSO4,继续受热分解生成锰的氧化物和硫的氧化物0.3 mol,850 ℃时,固体质量由45.30 g减少到为26.10 g,减少的质量为19.2 g,则硫氧化物的相对质量为64,故为二氧化硫,则此时的固体为MnO2;(2)1 150 ℃时固体为二氧化锰分解所得,锰元素质量守恒,则m(锰)=n(锰)×55=16.50 g,则氧化物中m(O)=22.90 g-16.50 g=6.4 g,n(O)=0.4 mol,故n(Mn)∶n(O)=0.3∶0.4=3∶4,则该氧化物为Mn3O4,故反应为3MnO2Mn3O4+O2↑。
8.4MnCO3+O22Mn2O3+4CO2
解析 n(MnCO3)==0.001 mol,则n(Mn)=0.001 mol,m(Mn)=0.001 mol×55 g/mol=0.055 g;527.4 ℃时,m(O)=(0.079-0.055)g=0.024 g,n(O)==0.0015 mol,可知:n(Mn)∶n(O)=0.001 mol∶0.001 5 mol=2∶3,则此时产物为Mn2O3,反应方程式为4MnCO3+O22Mn2O3+4CO2。
9.CoCl2·2H2O
解析 由图可知n(CoCl2)=65×10-3÷130=5×10-4 mol,物质A中含有的结晶水的物质的量为n(H2O)=(83-65)×10-3÷18=1×10-3 mol,故n(CoCl2)∶n(H2O)=1∶2,故物质A的化学式为CoCl2·2H2O。
10.(1)CuSO4·H2O (2)700~810 ℃
解析 (1)25.0 g CuSO4·5H2O的物质的量为0.1 mol,若结晶水全部失去,剩余固体为0.1 mol CuSO4,质量为16.0 g。由图知172 ℃时,剩余固体质量为17.8 g>16.0 g,则该温度下剩余固体为CuSO4的结晶水合物,n(H2O)==0.1 mol,原固体中CuSO4为0.1 mol,则CuSO4与H2O个数比为1∶1,则剩余固体的化学式为CuSO4·H2O;(2)由Cu元素守恒知,25.0 g CuSO4·5H2O能制得8.0 gCuO,由图知控制的合适温度范围为700~810 ℃。
11.Sc2(C2O4)3·H2O 2Sc2(C2O4)3+3O22Sc2O3+12CO2
解析 设有1 mol草酸钪晶体(462 g)在空气中受热,250 ℃时,剩余固体质量为462 g×80.5%=371.91 g,失水重量为462 g-371.91 g=90.09 g≈90 g,即250 ℃时,1 mol晶体失去5 mol水,则此时晶体的主要成分是Sc2(C2O4)3·H2O;550 ℃时,剩余固体质量为462 g×76.6%=353.89 g,相比于250 ℃时的剩余固体质量,250~550 ℃,失水重量为371.91 g-353.89 g=18.02 g≈18 g,则250~550 ℃,1 mol Sc2(C2O4)3·H2O失去1 mol水变为1 mol Sc2(C2O4)3;850 ℃时,剩余固体质量为462 g×29.8%=137.68 g≈138 g,由于M(Sc2O3)=138 g/mol,故可知550~850 ℃,1 mol Sc2(C2O4)3分解产生1 mol Sc2O3,反应的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
12.CuS生成Cu2S时失重的质量大于部分Cu2S生成CuO·CuSO4时增重的质量
解析 CuS经历如下转化:CuS→Cu2S→CuO·CuSO4,结合转化过程中化学式的相对分子质量,固体质量减少的主要原因是CuS生成Cu2S时失重的质量大于部分Cu2S生成CuO·CuSO4时增重的质量。
1.(2023·浙江精诚联盟三模)测得碱式碳酸铜[aCu(OH)2·bCuCO3]的热重分析结果如图所示,已知失重至65.7%时固体呈砖红色,则计算可知= (保留3位有效数字)。
2.(2024·广州高三段训)过硼酸钠晶体(NaBO3·4H2O)也可用作无毒漂白剂,加热至70 ℃以上会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的曲线如图所示,则T2~T3所对应的化学方程式为 。
3.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率随温度的变化,如图所示。则300 ℃时,剩余固体中n(Mn)∶n(O)为 ;图中C点对应固体的成分为 (填化学式)。
4.Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290 ℃时已完全脱水。计算确定A、B、C点物质的化学式为 、 、 。
5.为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确称取36.50 g样品加热,样品的固体残留率(×100%)随温度的变化如下图所示。
(1)300 ℃时残留固体的成分为 ,900 ℃时残留固体的成分为 。
(2)500 ℃时固体的成分及质量 。
6.取27.8 g FeSO4·7H2O隔绝空气加热至不同温度, 剩余固体的质量变化如图所示。
分析数据, 写出90 ℃ 残留物的化学式 ;440 ℃~470 ℃时固体物质发生反应的化学方程式是 ,
做出这一判断的依据是 。
7.(2023·河北名校联考)50.7 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。[已知:M(Mn)=55 g/mol]
(1)850 ℃时,所得固体的化学式为 。
(2)1 150 ℃时,反应的化学方程式为
。
8.(2023·汕头一模)碳酸锰在空气中加热可以生成相应的氧化物,称取115 mg碳酸锰(摩尔质量115 g/mol)加热,固体物质的质量随温度的变化如图所示。
527.4 ℃时,MnCO3生成相应固体物质的化学方程式为 。
9.(2022·湖北示范高中测试)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是 。
10.(2023·安阳模拟)实验测得25.0 g CuSO4·5H2O受热分解过程中的热重曲线如图所示。
(1)172 ℃时,剩余固体的化学式为 。
(2)由胆矾分解制备CuO时,控制的合适温度范围为 。
11.(2023·大连一模)Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462 g·mol-1。
250 ℃时固体的主要成分是 (填化学式);550~850 ℃时反应的化学方程式为
。
12.(2023·南京二模)将空气以一定流速通过加热的CuS试样,测得固体质量和流出气体中SO2含量随温度的变化如图所示。在200~300 ℃范围内,CuS经历如下转化:CuS→Cu2S→CuO·CuSO4,固体质量减少的主要原因是 。
热重曲线分析及其计算
1.1.24
解析 失重至65.7%时为氧化亚铜,由原子守恒可计算,×100%=65.7%,解得=1.24。
2.NaBO3·3H2ONaBO3·H2O+2H2O
解析 30.8 g NaBO3·4H2O的物质的量为n==0.2 mol,T2时刻,失去的结晶水质量为30.8-27.2=3.6 g,物质的量为0.2 mol,所得晶体为NaBO3·3H2O,T2~T3失去的结晶水为27.2-20=7.2 g,物质的量为0.4 mol,剩余的晶体为NaBO3·H2O,所以T2~T3所对应的化学方程式为
NaBO3·3H2ONaBO3·H2O+2H2O。
3.1∶2 Mn3O4与MnO
解析 MnCO3的摩尔质量为115 g/mol,设MnCO3的物质的量为1 mol,则A点300 ℃时失重的质量为1 mol×115 g/mol×(1-75.65%)=28 g。已知CO的摩尔质量是28 g/mol,根据质量守恒定律,分解化学方程式为MnCO3MnO2+CO↑。所以A点300 ℃时固体成分的化学式为MnO2。则n(Mn)∶n(O)为1∶2。B点770 ℃时失重的质量为1 mol×115 g/mol×(1-66.38%)=38.7 g。由于300 ℃时固体的成分为MnO2,再加热造成失重的原因只能是氧元素以O2的形式逸散失去,随着氧元素的失去,锰的化合价也发生了变化。因此失去氧元素的物质的量为n(O)= mol,可表示为Mn,整理得化学式为Mn3O4。D点900 ℃时失重的质量为1 mol×115 g/mol×(1-61.74%)=44 g。失去的n(O)==1 mol,可表示为MnO(2-1)。
4.Co2O3 Co3O4 CoO
解析 Co(OH)2在加热分解过程中,Co原子的数目不变。设有1 mol Co(OH)2,质量为93 g。则固体中Co的物质的量为1 mol,质量为59 g。设290 ℃后固体的化学式为CoOx,A点固体的相对分子质量为93×89.25%≈83,此时x=1.5,即该固体为Co2O3;B点固体的相对分子质量为93×86.38%≈80.3,此时x≈,即该固体为Co3O4;C点固体的相对分子质量为93×80.65%≈75,此时x=1,即该固体为CoO。
5.(1)CaC2O4 CaO
(2)固体的成分为12.8 g CaC2O4和15.0 g CaCO3
解析 (1)n(CaC2O4·H2O)==0.25 mol,含有m(H2O)=0.25 mol×18 g/mol=4.50 g,在300 ℃时,×100%=87.67%,m(剩余)=36.50 g×87.67%≈32 g,减少的质量为36.50 g-32 g=4.50 g,故此时失去全部的结晶水,残留固体为CaC2O4,在900 ℃时,×100%=38.36%,m(剩余)=36.50 g×38.36%≈14 g,其中Ca的质量没有损失,含m(Ca)=0.25 mol×40 g/mol=10 g,另外还含有m(O)=14 g-10 g=4 g,n(O)=0.25 mol,则n(Ca) : n(O)=1∶1,化学式为CaO;(2)在600 ℃时,×100%=68.49%,m(剩余)=36.50 g×68.49%≈25 g,从300 ℃至600 ℃时,失去的总质量为32 g-25 g=7 g,失去物质的摩尔质量为=28 g/mol,则应为CO,所以CaC2O4失去CO后,产物为CaCO3,在500 ℃时,应为CaC2O4和CaCO3的混合物,样品中CaC2O4·H2O物质的量为=0.25 mol,设CaC2O4和CaCO3的物质的量分别为x mol和y mol,根据500 ℃时固体总质量可得128x+100y=36.5×76.16%,根据钙元素守恒可得x+y=0.25,解得x=0.1,y=0.15,m(CaC2O4)=0.1 mol×128 g/mol=12.8 g,m(CaCO3)=0.15 mol×100 g/mol=15 g,500 ℃时固体的成分为12.8 g CaC2O4和15.0 g CaCO3。
6.FeSO4·H2O 2FeSO4Fe2O3+SO2↑+SO3↑
27.8 g FeSO4·7H2O的物质的量为0.1 mol,加热分解到C点后质量不再变化,C为铁的氧化物,剩余固体是8 g,铁元素的质量为5.6 g,则氧元素的质量为2.4 g,可得出氧化物中铁和氧原子个数比为2∶3,故为Fe2O3;根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则生成SO2,由质量守恒定律得出化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
解析 27.8 g FeSO4·7H2O的物质的量为0.1 mol,结晶水完全失去时剩下固体的质量为27.8 g-0.7 mol×18 g·mol-1=15.2 g,由图可知B(440 ℃)完全失去结晶水,成分为FeSO4,对比B(440 ℃)和A(90 ℃)点,两者质量差为17.0 g-15.2 g=1.8 g,即A比B多一个结晶水,A点成分为FeSO4·H2O;自始至终,铁元素质量守恒,FeSO4·7H2O为0.1 mol,加热分解到C(470 ℃)点后质量不再变化,C点成分为铁的氧化物,剩余固体是8 g,铁元素的质量为5.6 g,则氧元素的质量为2.4 g,可得出氧化物中铁和氧原子个数比为2∶3,故为Fe2O3;根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则生成SO2,由质量守恒定律得出化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
7.(1)MnO2 (2)3MnO2Mn3O4+O2↑
解析 (1)50.70 g MnSO4·H2O样品n(锰)=n(MnSO4·H2O)=0.3 mol,其中n(H2O)=0.3 mol,m(H2O)=5.4 g,280 ℃时,所得固体质量为45.30 g,减少的质量为5.4 g,则说明该段失去结晶水,此时固体为MnSO4,继续受热分解生成锰的氧化物和硫的氧化物0.3 mol,850 ℃时,固体质量由45.30 g减少到为26.10 g,减少的质量为19.2 g,则硫氧化物的相对质量为64,故为二氧化硫,则此时的固体为MnO2;(2)1 150 ℃时固体为二氧化锰分解所得,锰元素质量守恒,则m(锰)=n(锰)×55=16.50 g,则氧化物中m(O)=22.90 g-16.50 g=6.4 g,n(O)=0.4 mol,故n(Mn)∶n(O)=0.3∶0.4=3∶4,则该氧化物为Mn3O4,故反应为3MnO2Mn3O4+O2↑。
8.4MnCO3+O22Mn2O3+4CO2
解析 n(MnCO3)==0.001 mol,则n(Mn)=0.001 mol,m(Mn)=0.001 mol×55 g/mol=0.055 g;527.4 ℃时,m(O)=(0.079-0.055)g=0.024 g,n(O)==0.0015 mol,可知:n(Mn)∶n(O)=0.001 mol∶0.001 5 mol=2∶3,则此时产物为Mn2O3,反应方程式为4MnCO3+O22Mn2O3+4CO2。
9.CoCl2·2H2O
解析 由图可知n(CoCl2)=65×10-3÷130=5×10-4 mol,物质A中含有的结晶水的物质的量为n(H2O)=(83-65)×10-3÷18=1×10-3 mol,故n(CoCl2)∶n(H2O)=1∶2,故物质A的化学式为CoCl2·2H2O。
10.(1)CuSO4·H2O (2)700~810 ℃
解析 (1)25.0 g CuSO4·5H2O的物质的量为0.1 mol,若结晶水全部失去,剩余固体为0.1 mol CuSO4,质量为16.0 g。由图知172 ℃时,剩余固体质量为17.8 g>16.0 g,则该温度下剩余固体为CuSO4的结晶水合物,n(H2O)==0.1 mol,原固体中CuSO4为0.1 mol,则CuSO4与H2O个数比为1∶1,则剩余固体的化学式为CuSO4·H2O;(2)由Cu元素守恒知,25.0 g CuSO4·5H2O能制得8.0 gCuO,由图知控制的合适温度范围为700~810 ℃。
11.Sc2(C2O4)3·H2O 2Sc2(C2O4)3+3O22Sc2O3+12CO2
解析 设有1 mol草酸钪晶体(462 g)在空气中受热,250 ℃时,剩余固体质量为462 g×80.5%=371.91 g,失水重量为462 g-371.91 g=90.09 g≈90 g,即250 ℃时,1 mol晶体失去5 mol水,则此时晶体的主要成分是Sc2(C2O4)3·H2O;550 ℃时,剩余固体质量为462 g×76.6%=353.89 g,相比于250 ℃时的剩余固体质量,250~550 ℃,失水重量为371.91 g-353.89 g=18.02 g≈18 g,则250~550 ℃,1 mol Sc2(C2O4)3·H2O失去1 mol水变为1 mol Sc2(C2O4)3;850 ℃时,剩余固体质量为462 g×29.8%=137.68 g≈138 g,由于M(Sc2O3)=138 g/mol,故可知550~850 ℃,1 mol Sc2(C2O4)3分解产生1 mol Sc2O3,反应的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
12.CuS生成Cu2S时失重的质量大于部分Cu2S生成CuO·CuSO4时增重的质量
解析 CuS经历如下转化:CuS→Cu2S→CuO·CuSO4,结合转化过程中化学式的相对分子质量,固体质量减少的主要原因是CuS生成Cu2S时失重的质量大于部分Cu2S生成CuO·CuSO4时增重的质量。
同课章节目录
