2024-2025学年高中学业水平总复习 课时2 物质的量 课件 ((共27张PPT))
文档属性
| 名称 | 2024-2025学年高中学业水平总复习 课时2 物质的量 课件 ((共27张PPT)) |  | |
| 格式 | pptx | ||
| 文件大小 | 986.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-02 15:53:16 | ||
图片预览







文档简介
(共27张PPT)
合格考总复习
课时2 物质的量
知识梳理
知识点 1
物质的量
1. 物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n。
2. 物质的量的单位为摩尔,简称摩,符号为mol。
3. 国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023 。1 mol任何粒子的粒子数叫作阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
4. 物质的量(n)、阿伏加德罗常数(NA)和粒子数(N)之间的换算关系:n= 。
知识点 2
摩尔质量
1. 单位物质的量的物质所具有的质量叫作摩尔质量。摩尔质量的符号为M,常用的单位为g/mol(或g·mol-1)。
2. 1 mol任何粒子或物质的质量以克为单位时,在数值上等于该物质的相对分子(原子)质量。
3. 物质的量(n)、摩尔质量(M)和质量(m)之间的换算关系:M= 。
知识点 3
气体摩尔体积
1. 单位物质的量的气体所占的体积叫作气体
摩尔体积。符号为Vm,常用单位有L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
2. 在标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol。
3. 物质的量(n)、气体体积(V)和气体摩尔体积(Vm)之间的换算关系:Vm=。
4. 气体摩尔体积Vm=22.4 L/mol的使用范围:标准状况(0 ℃、101 kPa)下的任何气体(包括混合气体),不是常温常压下,也不是通常状况下。在标准状况下,水、汽油、硫酸、乙醇、苯、四氯化碳、SO3等都不是气体,不能使用22.4 L/mol进行计算。
知识点 4
物质的量浓度
1. 物质的量浓度表示单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度,符号为cB。物质的量浓度常用的单位为mol/L(或mol·L-1)。
2. 物质的量浓度(cB)、溶质的物质的量(nB)和溶液的体积(V)的关系:cB= 。
3. 计算物质的量浓度时,代入的体积是溶液的体积,而不是溶剂的体积。
知识点 5
与物质的量有关的计算公式
符号 物质的量(n) 微粒数(N) 质量(m) 气体的体积(V) 单位 mol 个 g L 符号 阿伏加德罗常数(NA) 摩尔质量(M) 气体摩尔体积(Vm) 物质的量浓度(c) 溶液的体积(V溶液)
单位 mol-1 g/mol L/mol mol/L L
溶液 先根据N、m、V中任意一个物理量求出n,进而求出其余的物理量 说明 ①观察上面的3个分式,NA比N多A,Vm比V多m,分子是m,分母是M; ②标准状况下,Vm=22.4 L/mol 知识点 6
一定物质的量浓度溶液的配制
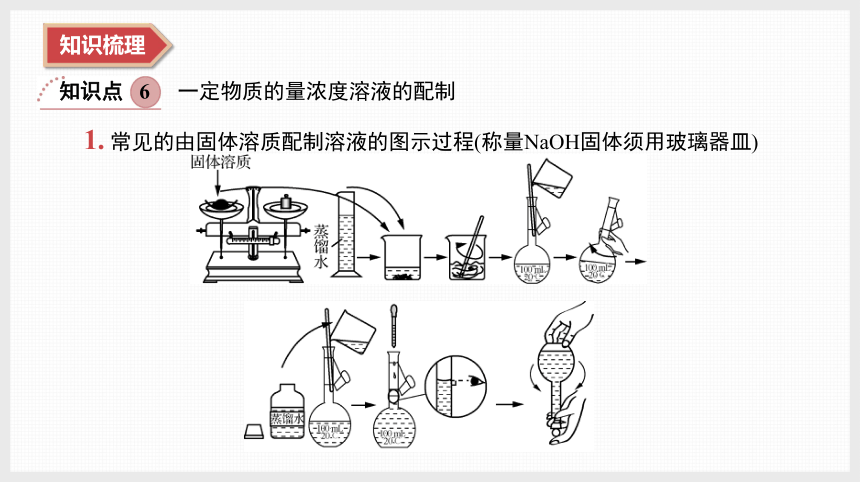
1. 常见的由固体溶质配制溶液的图示过程(称量NaOH固体须用玻璃器皿)
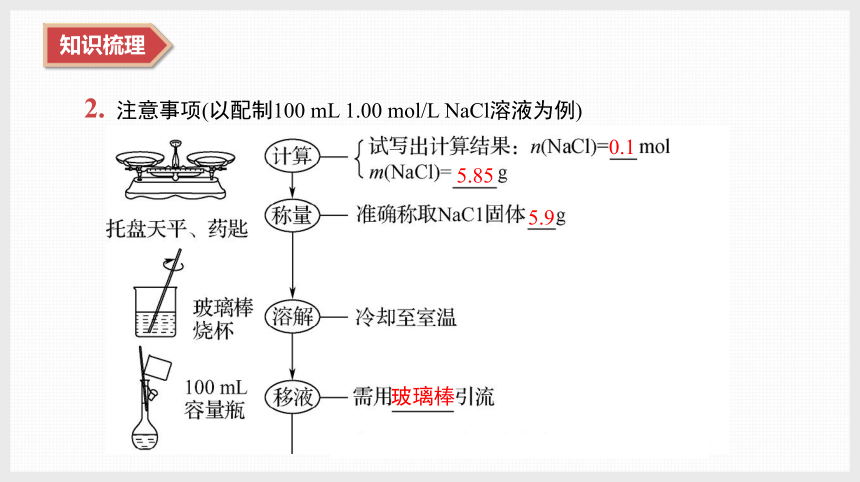
2. 注意事项(以配制100 mL 1.00 mol/L NaCl溶液为例)
0.1
5.85
5.9
玻璃棒
2~3
100 mL 容量瓶
1~2
典型例题
类型1 摩尔质量
(2023·江苏学测)N2的摩尔质量 28 g/mol,下列说法正确的是( )
A. 1 mol氮原子的质量为28 g
B. 1 mol氮气的质量为28 g
C. 1 个氮分子质量为28 g
D. 1 g氮气的物质的量为28 mol
【解析】N2的摩尔质量为28 g/mol,1 mol N2的质量为28 g,B正确。
1
B
(2022·江苏学测)氧气是氧元素形成的一种单质,其摩尔质量为( )
A. 16 B. 32
C. 16 g/mol D. 32 g/mol
2
D
(2021·江苏学测)H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )
A. 10 B. 18
C. 10 g/mol D. 18 g/mol
【解析】H2O的相对分子质量为18,则其摩尔质量为18 g/mol ,D正确。
3
D
(2024·无锡合格考模拟)甲烷是常见的清洁能源。CH4的摩尔质量为( )
A. 16 g/mol B. 16
C. 10 D. 10 g/mol
【解析】CH4的相对分子质量为16,则其摩尔质量为16 g/mol ,A正确。
1
A
【解析】标准状况下,气体摩尔体积约为22.4 L/mol,则1 mol O2的体积约为1 mol×22.4 L/mol=22.4 L,C正确。
4
类型2 气体摩尔体积
(2020·江苏学测)标准状况下,1 mol O2的体积约为( )
A. 5.6 L B. 11.2 L
C. 22.4 L D. 33.6 L
C
(2024·淮安合格考模拟二)标准状况下气体摩尔体积约为22.4 L/mol,对其含义表述正确的是( )
A. 1 mol N2的体积约为22.4 L
B. 标准状况下,1 mol Fe的体积约为22.4 L
C. 标准状况下,1 mol任何气体的体积约为22.4 L
D. 影响气体体积的主要因素是分子本身的大小
【解析】未明确是在标准状况下,不能根据22.4 L/mol计算1 mol N2的体积,A错误;标准状况下,铁为固体,不能根据22.4 L/mol计算1 mol铁的体积,B错误;标准状况下,1 mol任何气体的体积都约为22.4 L,C正确;由于气体的分子间距离远大于分子本身大小,则相同条件下影响气体体积的主要因素是气体的分子数目以及分子间的平均距离,D错误。
2
C
(2024·盐城合格考模拟)标准状况下,0.25 mol空气的体积约为( )
A. 5.6 L B. 11.2 L
C. 22.4 L D. 33.6 L
【解析】标准状况下,0.25 mol空气的体积约为0.25 mol×22.4 L/mol=5.6 L,A正确。
3
A
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 1 mol H2含有的质子数为NA
B. 22 g CO2含有的原子数为NA
C. 1 mol NH3约含有 10NA个电子
D. 标准状况下,22.4 L O2含有的分子数为2NA
【解析】H2分子中含有2个质子,则1 mol H2含有的质子数为2NA,A错误;22 g CO2的物质的量为 0.5 mol,则含有的原子数为1.5NA,B错误;NH3分子含有10个电子,则1 mol NH3含有10NA个电子,C正确;标准状况下,水不是气体,不能用标准状况下气体摩尔体积计算其物质的量,D错误。
4
C
类型3 物质的量浓度
(2020·江苏学测)海水中蕴藏着丰富的化学资源,每千克海水中氯化物的含量如图所示。则海水中物质的量浓度最大的金属离子是( )
A. K+ B. Ca2+
C. Mg2+ D. Na+
【解析】根据图示可知,m(NaCl)最大,而四种物质中M(NaCl)最小,则n(NaCl)最大,溶液体积相同,则c(Na+)最大,D正确。
5
D
(2022·连云港学测合格考)实验室中配制250 mL 0.20 mol/L NaOH溶液时,必须使用到的玻璃仪器是( )
【解析】配制250 mL 0.20 mol/L NaOH溶液时,必须使用到的玻璃仪器有烧杯、玻璃棒、规格为250 mL 的容量瓶、胶头滴管,C正确。
6
C
(2024·扬州合格考模拟)配制100 mL 0.010 0 mol/L NaCl溶液不需要选用的仪器是( )
7
B
(2024·淮安合格考模拟二)由1.06 g Na2CO3固体配制100 mL 0.1 mol/L Na2CO3溶液,下列仪器无需使用的是( )
【解析】用Na2CO3固体配制一定物质的量浓度的Na2CO3溶液时,需要使用的玻璃仪器是规格为100 mL容量瓶、烧杯、玻璃棒、胶头滴管,选B。
5
B
(2021·苏州中学合格考模拟)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是 ( )
A. 干燥的
B. 瓶塞不漏水的
C. 用欲配制的溶液润洗过的
D. 以上三项均须要求的
【解析】容量瓶在使用前要检查是否漏水,使用前无须干燥,不能用溶液润洗,B正确。
6
B
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 0.5 mol/L H2SO4 溶液中, 的数目为0.5NA
B. 1 L 1.0 mol/L盐酸中含有Cl-数目为NA
C. 1 L 1.0 mol/L NaHSO4溶液中含有Na+数目为NA
D. 1 L 0.5 mol/L K2SO4溶液中含有K+数目为NA
【解析】没有给出溶液的体积,无法计算H2SO4的物质的量,也无法计算SO的数目,A错误。
7
A
(2023·江苏部分重点中学学测合格考)设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 2 mol H2O的摩尔质量为36 g/mol
B. 标准状况下,0.5 mol SO3的体积为11.2 L
C. 46 g Na与氧气充分反应,转移的电子数为2NA
D. 将4.0 g NaOH固体溶于1 L水中,所得NaOH溶液的物质的量浓度为0.1 mol/L
【解析】H2O的摩尔质量为18 g/mol,A错误;标准状况下SO3不是气体,不能使用气体摩尔体积计算其物质的量,B错误;钠与氧气反应生成Na2O2,反应中1 mol Na失去1 mol电子,46 g Na 物质的量为2 mol,与氧气充分反应,转移的电子数为2NA,C正确;将4.0 g NaOH固体溶于1 L水中,溶液体积不是1 L,则所得NaOH溶液的物质的量浓度不是0.1 mol/L,D错误。
8
C
谢谢观赏
合格考总复习
课时2 物质的量
知识梳理
知识点 1
物质的量
1. 物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n。
2. 物质的量的单位为摩尔,简称摩,符号为mol。
3. 国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023 。1 mol任何粒子的粒子数叫作阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
4. 物质的量(n)、阿伏加德罗常数(NA)和粒子数(N)之间的换算关系:n= 。
知识点 2
摩尔质量
1. 单位物质的量的物质所具有的质量叫作摩尔质量。摩尔质量的符号为M,常用的单位为g/mol(或g·mol-1)。
2. 1 mol任何粒子或物质的质量以克为单位时,在数值上等于该物质的相对分子(原子)质量。
3. 物质的量(n)、摩尔质量(M)和质量(m)之间的换算关系:M= 。
知识点 3
气体摩尔体积
1. 单位物质的量的气体所占的体积叫作气体
摩尔体积。符号为Vm,常用单位有L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
2. 在标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol。
3. 物质的量(n)、气体体积(V)和气体摩尔体积(Vm)之间的换算关系:Vm=。
4. 气体摩尔体积Vm=22.4 L/mol的使用范围:标准状况(0 ℃、101 kPa)下的任何气体(包括混合气体),不是常温常压下,也不是通常状况下。在标准状况下,水、汽油、硫酸、乙醇、苯、四氯化碳、SO3等都不是气体,不能使用22.4 L/mol进行计算。
知识点 4
物质的量浓度
1. 物质的量浓度表示单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度,符号为cB。物质的量浓度常用的单位为mol/L(或mol·L-1)。
2. 物质的量浓度(cB)、溶质的物质的量(nB)和溶液的体积(V)的关系:cB= 。
3. 计算物质的量浓度时,代入的体积是溶液的体积,而不是溶剂的体积。
知识点 5
与物质的量有关的计算公式
符号 物质的量(n) 微粒数(N) 质量(m) 气体的体积(V) 单位 mol 个 g L 符号 阿伏加德罗常数(NA) 摩尔质量(M) 气体摩尔体积(Vm) 物质的量浓度(c) 溶液的体积(V溶液)
单位 mol-1 g/mol L/mol mol/L L
溶液 先根据N、m、V中任意一个物理量求出n,进而求出其余的物理量 说明 ①观察上面的3个分式,NA比N多A,Vm比V多m,分子是m,分母是M; ②标准状况下,Vm=22.4 L/mol 知识点 6
一定物质的量浓度溶液的配制
1. 常见的由固体溶质配制溶液的图示过程(称量NaOH固体须用玻璃器皿)
2. 注意事项(以配制100 mL 1.00 mol/L NaCl溶液为例)
0.1
5.85
5.9
玻璃棒
2~3
100 mL 容量瓶
1~2
典型例题
类型1 摩尔质量
(2023·江苏学测)N2的摩尔质量 28 g/mol,下列说法正确的是( )
A. 1 mol氮原子的质量为28 g
B. 1 mol氮气的质量为28 g
C. 1 个氮分子质量为28 g
D. 1 g氮气的物质的量为28 mol
【解析】N2的摩尔质量为28 g/mol,1 mol N2的质量为28 g,B正确。
1
B
(2022·江苏学测)氧气是氧元素形成的一种单质,其摩尔质量为( )
A. 16 B. 32
C. 16 g/mol D. 32 g/mol
2
D
(2021·江苏学测)H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )
A. 10 B. 18
C. 10 g/mol D. 18 g/mol
【解析】H2O的相对分子质量为18,则其摩尔质量为18 g/mol ,D正确。
3
D
(2024·无锡合格考模拟)甲烷是常见的清洁能源。CH4的摩尔质量为( )
A. 16 g/mol B. 16
C. 10 D. 10 g/mol
【解析】CH4的相对分子质量为16,则其摩尔质量为16 g/mol ,A正确。
1
A
【解析】标准状况下,气体摩尔体积约为22.4 L/mol,则1 mol O2的体积约为1 mol×22.4 L/mol=22.4 L,C正确。
4
类型2 气体摩尔体积
(2020·江苏学测)标准状况下,1 mol O2的体积约为( )
A. 5.6 L B. 11.2 L
C. 22.4 L D. 33.6 L
C
(2024·淮安合格考模拟二)标准状况下气体摩尔体积约为22.4 L/mol,对其含义表述正确的是( )
A. 1 mol N2的体积约为22.4 L
B. 标准状况下,1 mol Fe的体积约为22.4 L
C. 标准状况下,1 mol任何气体的体积约为22.4 L
D. 影响气体体积的主要因素是分子本身的大小
【解析】未明确是在标准状况下,不能根据22.4 L/mol计算1 mol N2的体积,A错误;标准状况下,铁为固体,不能根据22.4 L/mol计算1 mol铁的体积,B错误;标准状况下,1 mol任何气体的体积都约为22.4 L,C正确;由于气体的分子间距离远大于分子本身大小,则相同条件下影响气体体积的主要因素是气体的分子数目以及分子间的平均距离,D错误。
2
C
(2024·盐城合格考模拟)标准状况下,0.25 mol空气的体积约为( )
A. 5.6 L B. 11.2 L
C. 22.4 L D. 33.6 L
【解析】标准状况下,0.25 mol空气的体积约为0.25 mol×22.4 L/mol=5.6 L,A正确。
3
A
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 1 mol H2含有的质子数为NA
B. 22 g CO2含有的原子数为NA
C. 1 mol NH3约含有 10NA个电子
D. 标准状况下,22.4 L O2含有的分子数为2NA
【解析】H2分子中含有2个质子,则1 mol H2含有的质子数为2NA,A错误;22 g CO2的物质的量为 0.5 mol,则含有的原子数为1.5NA,B错误;NH3分子含有10个电子,则1 mol NH3含有10NA个电子,C正确;标准状况下,水不是气体,不能用标准状况下气体摩尔体积计算其物质的量,D错误。
4
C
类型3 物质的量浓度
(2020·江苏学测)海水中蕴藏着丰富的化学资源,每千克海水中氯化物的含量如图所示。则海水中物质的量浓度最大的金属离子是( )
A. K+ B. Ca2+
C. Mg2+ D. Na+
【解析】根据图示可知,m(NaCl)最大,而四种物质中M(NaCl)最小,则n(NaCl)最大,溶液体积相同,则c(Na+)最大,D正确。
5
D
(2022·连云港学测合格考)实验室中配制250 mL 0.20 mol/L NaOH溶液时,必须使用到的玻璃仪器是( )
【解析】配制250 mL 0.20 mol/L NaOH溶液时,必须使用到的玻璃仪器有烧杯、玻璃棒、规格为250 mL 的容量瓶、胶头滴管,C正确。
6
C
(2024·扬州合格考模拟)配制100 mL 0.010 0 mol/L NaCl溶液不需要选用的仪器是( )
7
B
(2024·淮安合格考模拟二)由1.06 g Na2CO3固体配制100 mL 0.1 mol/L Na2CO3溶液,下列仪器无需使用的是( )
【解析】用Na2CO3固体配制一定物质的量浓度的Na2CO3溶液时,需要使用的玻璃仪器是规格为100 mL容量瓶、烧杯、玻璃棒、胶头滴管,选B。
5
B
(2021·苏州中学合格考模拟)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是 ( )
A. 干燥的
B. 瓶塞不漏水的
C. 用欲配制的溶液润洗过的
D. 以上三项均须要求的
【解析】容量瓶在使用前要检查是否漏水,使用前无须干燥,不能用溶液润洗,B正确。
6
B
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 0.5 mol/L H2SO4 溶液中, 的数目为0.5NA
B. 1 L 1.0 mol/L盐酸中含有Cl-数目为NA
C. 1 L 1.0 mol/L NaHSO4溶液中含有Na+数目为NA
D. 1 L 0.5 mol/L K2SO4溶液中含有K+数目为NA
【解析】没有给出溶液的体积,无法计算H2SO4的物质的量,也无法计算SO的数目,A错误。
7
A
(2023·江苏部分重点中学学测合格考)设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 2 mol H2O的摩尔质量为36 g/mol
B. 标准状况下,0.5 mol SO3的体积为11.2 L
C. 46 g Na与氧气充分反应,转移的电子数为2NA
D. 将4.0 g NaOH固体溶于1 L水中,所得NaOH溶液的物质的量浓度为0.1 mol/L
【解析】H2O的摩尔质量为18 g/mol,A错误;标准状况下SO3不是气体,不能使用气体摩尔体积计算其物质的量,B错误;钠与氧气反应生成Na2O2,反应中1 mol Na失去1 mol电子,46 g Na 物质的量为2 mol,与氧气充分反应,转移的电子数为2NA,C正确;将4.0 g NaOH固体溶于1 L水中,溶液体积不是1 L,则所得NaOH溶液的物质的量浓度不是0.1 mol/L,D错误。
8
C
谢谢观赏
同课章节目录
