2024-2025学年高中学业水平总复习 课时3 离子反应 课件 (共33张PPT)
文档属性
| 名称 | 2024-2025学年高中学业水平总复习 课时3 离子反应 课件 (共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-02 15:55:11 | ||
图片预览









文档简介
(共33张PPT)
合格考总复习
课时3 离子反应
知识梳理
知识点 1
电解质与非电解质
类别 电解质 非电解质
相同点 均为________
不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质 区别 在水溶液里或熔融状态下_________________ 在水溶液里和熔融状态下______________________
化合物
自身能发生电离
自身均不能发生电离
物质 的类型 酸:HCl、H2SO4、HNO3、H2CO3等; 碱:NaOH、KOH、NH3·H2O等; 盐:KCl、Na2SO4、CaCO3等; 活泼金属氧化物:Na2O、CaO等 大多数非金属氧化物:CO2、SO2、SO3等;气态氢化物:NH3、CH4等;
大多数有机物:酒精、蔗糖等
要点 提醒 ①电解质和非电解质都是化合物。混合物和单质既不是电解质,也不是非电解质; ②能导电的物质不一定是电解质,如金属、硫酸溶液、盐酸等; ③溶于水能导电的化合物不一定是电解质,如CO2、SO2、NH3等是非电解质; ④酸、碱、盐和金属氧化物(如Na2O、CaO等)都是电解质 知识点 2
电离方程式
常见酸、碱、盐的电离方程式:
①HNO3===______________________;
②H2SO4===_____________________;
③NaOH===_____________________;
④Ca(OH)2===___________________;
⑤FeSO4===_____________________;
⑥Fe2(SO4)3===__________________;
Na++OH-
Ca2++2OH-
⑦Na2CO3===___________________;
⑧NaHCO3===__________________;
⑨Ca(NO3)2===__________________。
知识点 3
离子反应
1. 离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
2. 离子方程式
(1) 定义:用实际参加反应的离子符号来表示反应的式子。
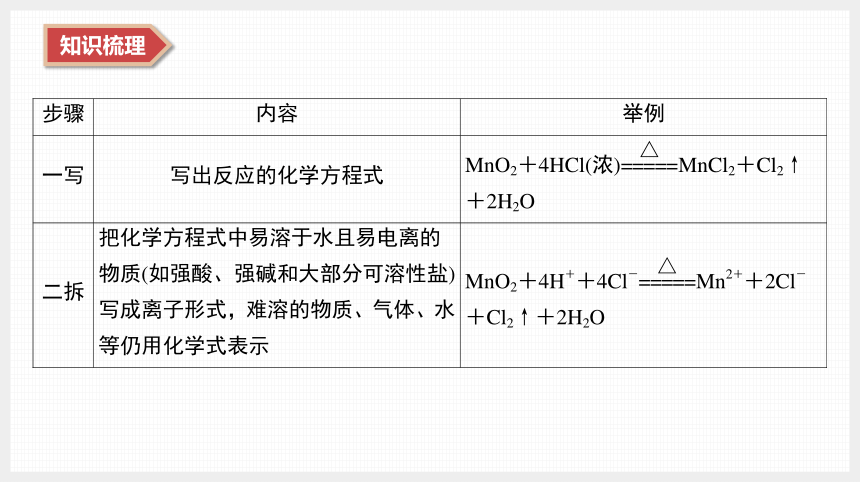
(2) 离子方程式的书写步骤:
步骤 内容 举例
三删 删去等式两边不参加反应的离子,并将系数化为最简比 删去等式两边不参加反应的Cl-:
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
四查 检查所写的离子方程式两边各元素的原子个数和离子所带的电荷总数是否相等;“↑”“↓”等符号是否遗漏 该离子方程式两边Mn、Cl、O、H 4种元素原子个数相等,等式两边电荷总数都是2个单位正电荷
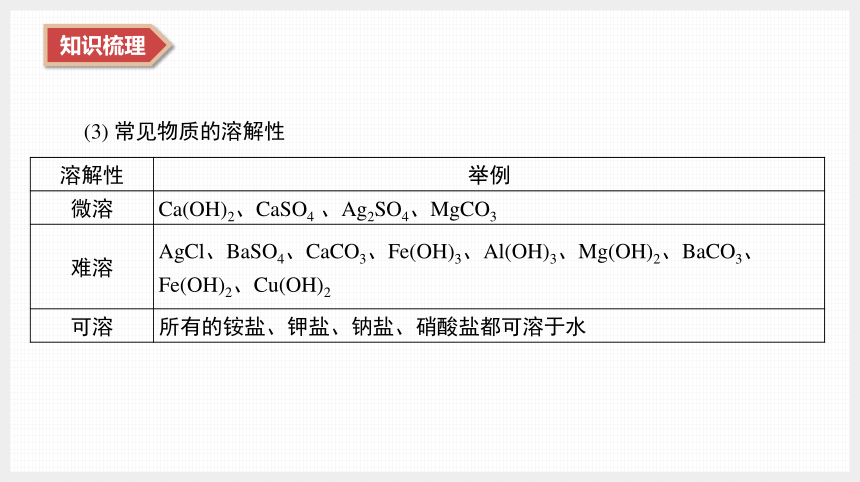
(3) 常见物质的溶解性
溶解性 举例
微溶 Ca(OH)2、CaSO4 、Ag2SO4、MgCO3
难溶 AgCl、BaSO4、CaCO3、Fe(OH)3、Al(OH)3、Mg(OH)2、BaCO3、
Fe(OH)2、Cu(OH)2
可溶 所有的铵盐、钾盐、钠盐、硝酸盐都可溶于水
(4) 离子方程式中常见不能拆分的物质
类别 常见物质 举例
单质 Na、Al 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
氧化物 Na2O、CuO、 Fe2O3、MnO2 Na2O+H2O===2Na++2OH-
过氧化物 H2O2、Na2O2 H2O2+2Fe2++2H+===2H2O+2Fe3+
难溶物 CaCO3、Cu(OH)2、Fe(OH)3 CaCO3+2H+===Ca2++CO2↑+H2O
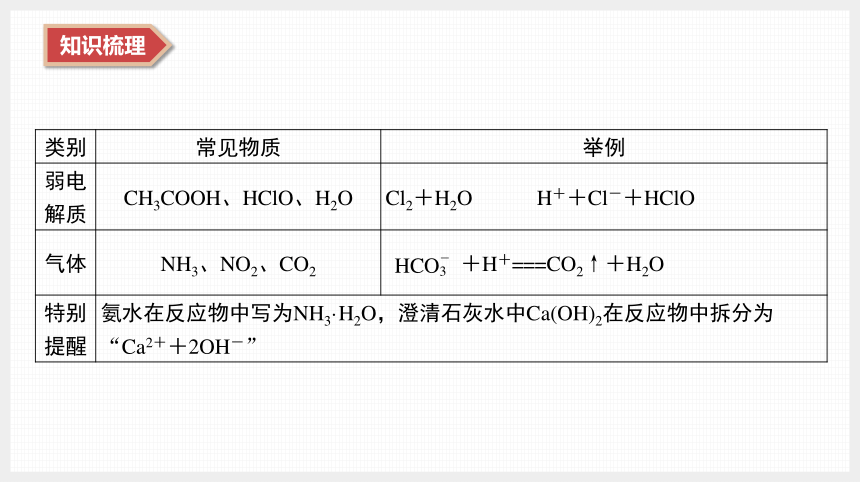
类别 常见物质 举例
弱电 解质 CH3COOH、HClO、H2O Cl2+H2O?? H++Cl-+HClO
气体 NH3、NO2、CO2 +H+===CO2↑+H2O
特别 提醒 氨水在反应物中写为NH3·H2O,澄清石灰水中Ca(OH)2在反应物中拆分为“Ca2++2OH-” (5) 离子方程式正误判断的七个角度
①看是否符合客观事实
如铁与稀盐酸反应:
2Fe+6H+===2Fe3++3H2↑(?)
Fe+2H+===Fe2++H2↑(?)
②看是否符合拆分原则
如石灰石加入稀盐酸中:
√
×
√
×
③看是否遵守质量守恒定律
如Na2O2与H2O反应:
2Na2O2+2H2O===2Na++2OH-+O2↑(?)
2Na2O2+2H2O===4Na++4OH-+O2↑(?)
④看是否遵守电荷守恒
如氯化铁溶液腐蚀铜板:
Cu+Fe3+===Fe2++Cu2+ (?)
Cu+2Fe3+===2Fe2++Cu2+(?)
√
×
√
×
√
×
√
×
⑦看是否漏掉“↑”或“↓”
如锌与稀硫酸反应:
Zn+2H+===Zn2++H2(?)
Zn+2H+===Zn2++H2↑(?)
√
×
[及时巩固]
写出下列反应的离子方程式。
①铁与稀硫酸反应:_____________________________________;
②NaOH与盐酸反应:____________________________________;
③澄清石灰水和盐酸反应:_______________________________;
④硫酸钠溶液与氢氧化钡溶液反应:________________________;
Fe+2H+===Fe2++H2↑
H++ OH-===H2O
H++ OH-===H2O
⑤用NaHCO3治疗胃酸过多:_______________________________;
⑥实验室制取氯气:_______________________________________;
⑦金属钠与水反应:_______________________________________;
⑧电解饱和NaCl溶液:__________________________________。
2Na+2H2O===2Na++2OH-+H2↑
3. 离子共存
(1) 常见离子不能大量共存的情况
(2) 无色溶液中离子不能共存的情况
(3) 发生复分解反应不能共存的情况
(4) 发生氧化还原反应不能共存的情况
如 (H+)与Fe2+、Fe3+与I-、Fe2+与ClO-等发生氧化还原反应而不能共存
OH-
OH-
知识点 4
常见离子的检验
黄色
蓝色钴玻璃
紫色
典型例题
1
B
【解析】
2
C
【解析】 H+与OH-结合生成H2O,不能大量共存,B不选;NH与OH-结合生成NH3·H2O,不能大量共存,C不选;Ag+与Cl-结合生成AgCl沉淀,不能大量共存,D不选。
3
A
【解析】
4
D
1
B
【解析】
5
B
【解析】
6
D
(2020·江苏学测)下列反应不能用离子方程式H++ OH-===H2O来表示的是( )
A. CH3COOH+NH3·H2O===H2O+CH3COONH4
B. H2SO4 +2KOH===K2SO4 +2H2O
C. HNO3 +NaOH===NaNO3 +H2O
D. HCl+NaOH===NaCl+H2O
【解析】
7
A
【解析】
8
B
【解析】 Cl2与NaOH溶液反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,A错误;FeCl2溶液中通入Cl2的离子方程式为Cl2+2Fe2+===2Cl-+2Fe3+,B错误;反应物是石灰乳,故Ca(OH)2在离子反应中不拆分,石灰乳与浓缩的海水制备氢氧化镁的离子方程式为Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,C错误。
2
D
谢谢观赏
合格考总复习
课时3 离子反应
知识梳理
知识点 1
电解质与非电解质
类别 电解质 非电解质
相同点 均为________
不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质 区别 在水溶液里或熔融状态下_________________ 在水溶液里和熔融状态下______________________
化合物
自身能发生电离
自身均不能发生电离
物质 的类型 酸:HCl、H2SO4、HNO3、H2CO3等; 碱:NaOH、KOH、NH3·H2O等; 盐:KCl、Na2SO4、CaCO3等; 活泼金属氧化物:Na2O、CaO等 大多数非金属氧化物:CO2、SO2、SO3等;气态氢化物:NH3、CH4等;
大多数有机物:酒精、蔗糖等
要点 提醒 ①电解质和非电解质都是化合物。混合物和单质既不是电解质,也不是非电解质; ②能导电的物质不一定是电解质,如金属、硫酸溶液、盐酸等; ③溶于水能导电的化合物不一定是电解质,如CO2、SO2、NH3等是非电解质; ④酸、碱、盐和金属氧化物(如Na2O、CaO等)都是电解质 知识点 2
电离方程式
常见酸、碱、盐的电离方程式:
①HNO3===______________________;
②H2SO4===_____________________;
③NaOH===_____________________;
④Ca(OH)2===___________________;
⑤FeSO4===_____________________;
⑥Fe2(SO4)3===__________________;
Na++OH-
Ca2++2OH-
⑦Na2CO3===___________________;
⑧NaHCO3===__________________;
⑨Ca(NO3)2===__________________。
知识点 3
离子反应
1. 离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
2. 离子方程式
(1) 定义:用实际参加反应的离子符号来表示反应的式子。
(2) 离子方程式的书写步骤:
步骤 内容 举例
三删 删去等式两边不参加反应的离子,并将系数化为最简比 删去等式两边不参加反应的Cl-:
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
四查 检查所写的离子方程式两边各元素的原子个数和离子所带的电荷总数是否相等;“↑”“↓”等符号是否遗漏 该离子方程式两边Mn、Cl、O、H 4种元素原子个数相等,等式两边电荷总数都是2个单位正电荷
(3) 常见物质的溶解性
溶解性 举例
微溶 Ca(OH)2、CaSO4 、Ag2SO4、MgCO3
难溶 AgCl、BaSO4、CaCO3、Fe(OH)3、Al(OH)3、Mg(OH)2、BaCO3、
Fe(OH)2、Cu(OH)2
可溶 所有的铵盐、钾盐、钠盐、硝酸盐都可溶于水
(4) 离子方程式中常见不能拆分的物质
类别 常见物质 举例
单质 Na、Al 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
氧化物 Na2O、CuO、 Fe2O3、MnO2 Na2O+H2O===2Na++2OH-
过氧化物 H2O2、Na2O2 H2O2+2Fe2++2H+===2H2O+2Fe3+
难溶物 CaCO3、Cu(OH)2、Fe(OH)3 CaCO3+2H+===Ca2++CO2↑+H2O
类别 常见物质 举例
弱电 解质 CH3COOH、HClO、H2O Cl2+H2O?? H++Cl-+HClO
气体 NH3、NO2、CO2 +H+===CO2↑+H2O
特别 提醒 氨水在反应物中写为NH3·H2O,澄清石灰水中Ca(OH)2在反应物中拆分为“Ca2++2OH-” (5) 离子方程式正误判断的七个角度
①看是否符合客观事实
如铁与稀盐酸反应:
2Fe+6H+===2Fe3++3H2↑(?)
Fe+2H+===Fe2++H2↑(?)
②看是否符合拆分原则
如石灰石加入稀盐酸中:
√
×
√
×
③看是否遵守质量守恒定律
如Na2O2与H2O反应:
2Na2O2+2H2O===2Na++2OH-+O2↑(?)
2Na2O2+2H2O===4Na++4OH-+O2↑(?)
④看是否遵守电荷守恒
如氯化铁溶液腐蚀铜板:
Cu+Fe3+===Fe2++Cu2+ (?)
Cu+2Fe3+===2Fe2++Cu2+(?)
√
×
√
×
√
×
√
×
⑦看是否漏掉“↑”或“↓”
如锌与稀硫酸反应:
Zn+2H+===Zn2++H2(?)
Zn+2H+===Zn2++H2↑(?)
√
×
[及时巩固]
写出下列反应的离子方程式。
①铁与稀硫酸反应:_____________________________________;
②NaOH与盐酸反应:____________________________________;
③澄清石灰水和盐酸反应:_______________________________;
④硫酸钠溶液与氢氧化钡溶液反应:________________________;
Fe+2H+===Fe2++H2↑
H++ OH-===H2O
H++ OH-===H2O
⑤用NaHCO3治疗胃酸过多:_______________________________;
⑥实验室制取氯气:_______________________________________;
⑦金属钠与水反应:_______________________________________;
⑧电解饱和NaCl溶液:__________________________________。
2Na+2H2O===2Na++2OH-+H2↑
3. 离子共存
(1) 常见离子不能大量共存的情况
(2) 无色溶液中离子不能共存的情况
(3) 发生复分解反应不能共存的情况
(4) 发生氧化还原反应不能共存的情况
如 (H+)与Fe2+、Fe3+与I-、Fe2+与ClO-等发生氧化还原反应而不能共存
OH-
OH-
知识点 4
常见离子的检验
黄色
蓝色钴玻璃
紫色
典型例题
1
B
【解析】
2
C
【解析】 H+与OH-结合生成H2O,不能大量共存,B不选;NH与OH-结合生成NH3·H2O,不能大量共存,C不选;Ag+与Cl-结合生成AgCl沉淀,不能大量共存,D不选。
3
A
【解析】
4
D
1
B
【解析】
5
B
【解析】
6
D
(2020·江苏学测)下列反应不能用离子方程式H++ OH-===H2O来表示的是( )
A. CH3COOH+NH3·H2O===H2O+CH3COONH4
B. H2SO4 +2KOH===K2SO4 +2H2O
C. HNO3 +NaOH===NaNO3 +H2O
D. HCl+NaOH===NaCl+H2O
【解析】
7
A
【解析】
8
B
【解析】 Cl2与NaOH溶液反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,A错误;FeCl2溶液中通入Cl2的离子方程式为Cl2+2Fe2+===2Cl-+2Fe3+,B错误;反应物是石灰乳,故Ca(OH)2在离子反应中不拆分,石灰乳与浓缩的海水制备氢氧化镁的离子方程式为Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,C错误。
2
D
谢谢观赏
同课章节目录
