2025年高中化学学业水平总复习 课时14 反应热 原电池(25张)
文档属性
| 名称 | 2025年高中化学学业水平总复习 课时14 反应热 原电池(25张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 878.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-02 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
合格考总复习
课时14 反应热 原电池
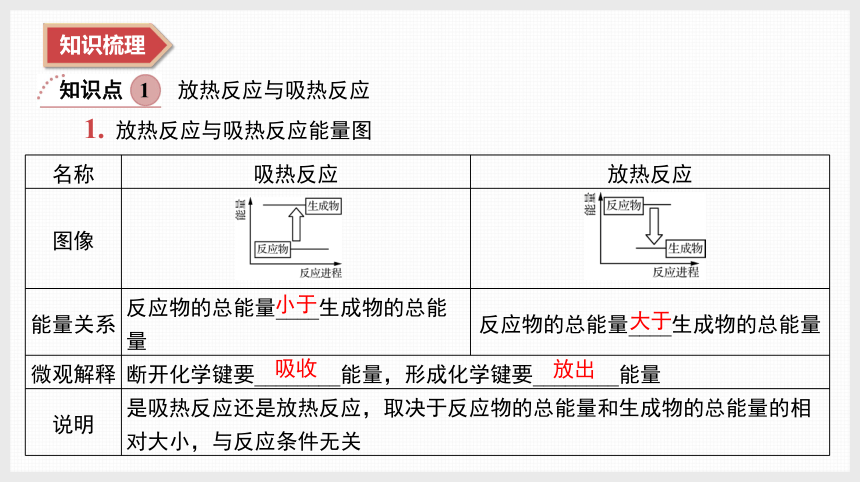
知识梳理
知识点 1
放热反应与吸热反应
1. 放热反应与吸热反应能量图
名称 吸热反应 放热反应
图像
能量关系 反应物的总能量____生成物的总能量 反应物的总能量____生成物的总能量
微观解释 断开化学键要________能量,形成化学键要________能量 说明 是吸热反应还是放热反应,取决于反应物的总能量和生成物的总能量的相对大小,与反应条件无关 小于
大于
吸收
放出
2. 常见的放热反应和吸热反应
3. 吸热过程和放热过程
名称 吸热过程 放热过程
举例 断开化学键 碘升华(固→气) 液氨汽化(液→气) 冰→水→水蒸气(固→液→气) 铵盐溶于水 形成化学键
水蒸气液化(气→液)
水结冰(液→固)
浓硫酸溶于水
强碱溶于水
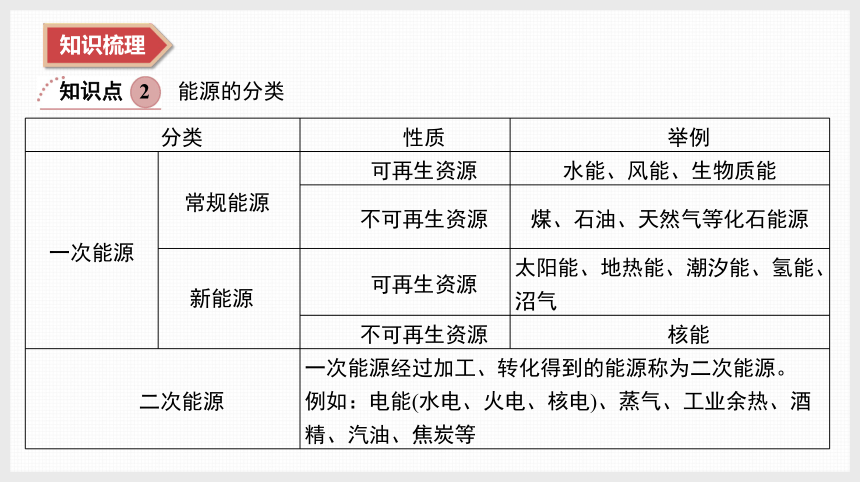
知识点 2
能源的分类
分类 性质 举例
一次能源 常规能源 可再生资源 水能、风能、生物质能
不可再生资源 煤、石油、天然气等化石能源
新能源 可再生资源 太阳能、地热能、潮汐能、氢能、沼气
不可再生资源 核能
二次能源 一次能源经过加工、转化得到的能源称为二次能源。 例如:电能(水电、火电、核电)、蒸气、工业余热、酒精、汽油、焦炭等 知识点 3
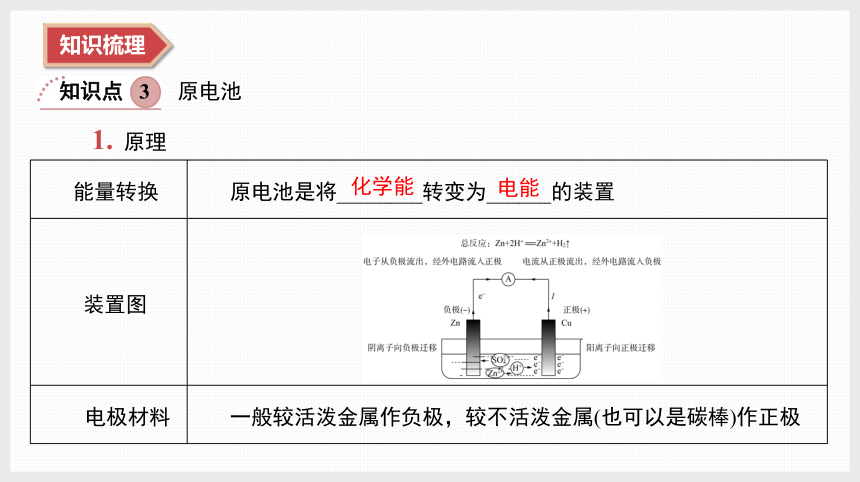
原电池
1. 原理
能量转换 原电池是将________转变为______的装置
装置图
电极材料 一般较活泼金属作负极,较不活泼金属(也可以是碳棒)作正极
化学能
电能
电极材料 一般较活泼金属作负极,较不活泼金属(也可以是碳棒)作正极
电极反应式 负极:________________________;正极:_____________________
电子的流向 电子由______极经外电路流入______极
电流的流向 电流由______极经外电路流入______极
离子的移向 阳离子向______极移动;阴离子向______极移动
注意 ①电子从负极、经导线流向正极,电子不能通过电解质溶液;
②电解质溶液中阴、阳离子的定向移动,组成了完整的闭合回路
Zn-2e-===Zn2+
2H++2e-===H2↑
负
正
正
负
正
负
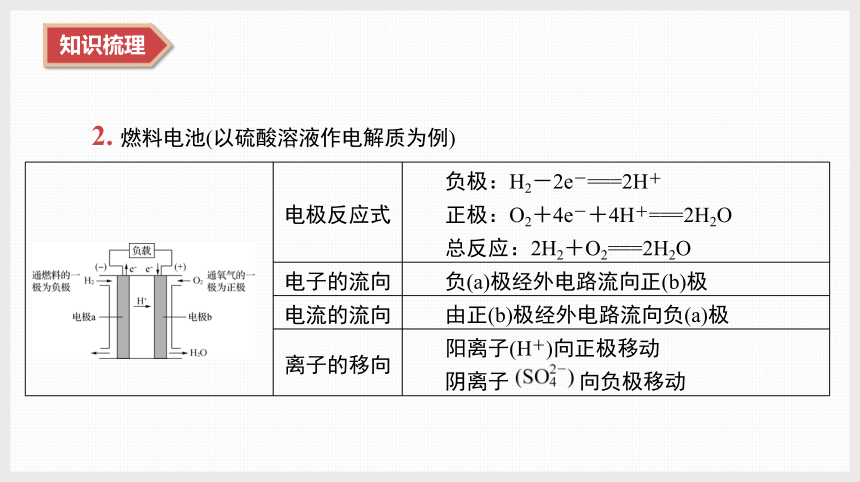
2. 燃料电池(以硫酸溶液作电解质为例)
电极反应式 负极:H2-2e-===2H+
正极:O2+4e-+4H+===2H2O
总反应:2H2+O2===2H2O
电子的流向 负(a)极经外电路流向正(b)极
电流的流向 由正(b)极经外电路流向负(a)极
离子的移向 阳离子(H+)向正极移动
阴离子 向负极移动
3. 原电池正、负极的判断
4. 电化学腐蚀的类型
类型 吸氧腐蚀 析氢腐蚀
条件 水膜呈中性、弱酸性或碱性 水膜呈较强酸性
正极反应式 O2+2H2O+4e-===4OH- 2H++2e-===H2↑
负极反应式 Fe-2e-===Fe2+ Fe-2e-===Fe2+
总反应 2Fe+O2+2H2O===2Fe(OH)2 Fe+2H+===Fe2++H2↑
5. 原电池的应用
应用 举例
加快反应速率 锌和稀硫酸制备氢气加入少量硫酸铜溶液可加快反应速率(构成锌-铜原电池)
判断原电池中两极活动性 一般来说,作负极的为较____的金属
保护金属 在轮船的外壳镶嵌比铁活泼的金属(如锌块),可保护船身
活泼
典型例题
类型1 反应热
(2023·江苏学测)乙醇-水催化重整制氢的反应有C2H5OH(g)+3H2O(g)
2CO2(g)+6H2(g)。已知正反应是吸热反应。下列有关该反应的说法正确的是( )
A. 反应物总能量大于生成物总能量
B. 反应的能量变化与化学键的断裂与形成有关
C. 断开H—O放出热量
D. 达到化学平衡时,C2H5OH完全转化为生成物
【解析】该反应是吸热反应,反应物总能量小于生成物总能量,A错误;断开化学键吸收热量,C错误;该反应是可逆反应,可逆反应达到化学平衡时,C2H5OH不可能完全转化为生成物,D错误。
1
B
(2022·江苏学测)下列有关H2的说法正确的是( )
A. 电解水是获得氢气的途径之一
B. 升高温度可使氢气转化为液态
C. 2H2+O2===2H2O反应过程吸收能量
D. 断开H—H释放能量
【解析】物质由气态变为液态,需要降温,B错误;H2与O2反应,属于氧化反应,过程中放出热量,C错误;断开化学键需要吸收能量,D错误。
2
A
(2021·江苏学测)分解水获得H2的能量变化如图。下列说法正确的是( )
A. 分解水属于吸热反应
B. 断开H—O放出能量
C. 形成H—H吸收能量
D. 反应物的总能量大于生成物的总能量
【解析】分解水属于吸热反应,A正确;断开化学键需要吸收热量,B错误;形成化学键放出热量,C错误;由图可知,反应物的总能量小于生成物的总能量,D错误。
3
A
(2020·江苏学测)下列过程需要吸收热量的是( )
A. 甲烷在空气中燃烧
B. 稀释浓硫酸
C. 镁条与盐酸反应
D. 冰融化成水
【解析】燃烧属于放热反应,A错误;稀释浓硫酸放出热量,B错误;金属与酸反应属于放热反应,C错误;冰融化成水需要吸收热量,D正确。
4
D
(2024·无锡合格考模拟)先进的甲醇蒸气重整-变压吸附技术可得到高浓度CO2混合气、H2,化学反应原理是CH3OH+H2O===CO2+3H2,其能量变化如图所示。下列说法错误的是( )
A. CH3OH转变成H2的过程是吸收能量的过程
B. 反应物的总能量大于生成物的总能量
C. 形成H—H放出能量
D. 断开H—C吸收能量
【解析】由图可知,该反应是放热反应,即CH3OH转变成H2的过程是放出能量的过程,A错误。
1
A
(2024·淮安合格考模拟)下列属于吸热反应的是( )
A. 镁的燃烧反应
B. 盐酸与氢氧化钠的反应
C. 水的分解反应
D. 铝与氧化铁的铝热反应
2
C
类型2 原电池
(2023·江苏学测)一种氢氧燃料电池的反应装置如图所示。下列有关该电池的说法正确的是( )
A. 电极a是正极
B. 电子经导线由电极b流向电极a
C. 该电池总反应为2H2+O2===2H2O
D. 该装置可将电能转化为化学能
【解析】根据H+的移动方向,氢氧燃料电池中,H2在负极a上被氧化,O2在正极b上被还原,所以a是负极,A错误;原电池中电子由负极a经过导线流向正极b,B错误;氢氧燃料电池的总反应为2H2+O2===2H2O,C正确;该装置可将化学能转化为电能,D错误。
5
C
(2022·江苏学测)某原电池结构如图所示。下列说法正确的是( )
A. Zn为正极
B. Cu表面气体为H2
C. 电子由Cu流向Zn
D. 可以将电能转化为化学能
【解析】铜-锌原电池中,Zn比Cu活泼,Zn作负极,A错误;Cu表面有H+得电子生成H2,B正确;电子由Zn经导线流向Cu,C错误;原电池可将化学能转化为电能,D错误。
6
B
(2021·江苏学测)某兴趣小组模拟纸电池进行实验(如图)。下列有关该纸电池说法正确的是( )
A. Zn为正极
B. 工作时Cu电极发生氧化反应
C. 工作时电子经外电路由Cu流向Zn
D. 工作一段时间后,Cu电极质量增加
【解析】Zn、Cu、CuSO4组成原电池,Zn为负极,发生氧化反应,A、B错误;电子从Zn极经外电路流入Cu极,C错误;正极反应式:Cu2++2e-===Cu,质量增加,D正确。
7
D
(2020·江苏学测)某同学用右图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
A. 锌片不断溶解,说明Zn失去电子
B. 铜片上产生气泡,说明溶液中H+在其表面得到电子
C. 电流计指针发生偏转,说明该装置将电能转化为化学能
D. 该装置中发生的总反应:
Zn+H2SO4 ===ZnSO4 +H2↑
【解析】该装置是原电池,是将化学能转化为电能的装置,C错误。
8
C
(2024·扬州合格考模拟)锂-海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法正确的是( )
A. 金属镍作负极
B. 金属锂发生还原反应
C. 电子从锂电极经用电设备流向镍电极
D. 可将电能转化为化学能
【解析】Li失去电子,发生氧化反应,Li作负极,金属镍作正极,A、B错误;电子从锂电极经用电设备流向镍电极,C正确;可将化学能转化为电能,D错误。
3
C
谢谢观赏
合格考总复习
课时14 反应热 原电池
知识梳理
知识点 1
放热反应与吸热反应
1. 放热反应与吸热反应能量图
名称 吸热反应 放热反应
图像
能量关系 反应物的总能量____生成物的总能量 反应物的总能量____生成物的总能量
微观解释 断开化学键要________能量,形成化学键要________能量 说明 是吸热反应还是放热反应,取决于反应物的总能量和生成物的总能量的相对大小,与反应条件无关 小于
大于
吸收
放出
2. 常见的放热反应和吸热反应
3. 吸热过程和放热过程
名称 吸热过程 放热过程
举例 断开化学键 碘升华(固→气) 液氨汽化(液→气) 冰→水→水蒸气(固→液→气) 铵盐溶于水 形成化学键
水蒸气液化(气→液)
水结冰(液→固)
浓硫酸溶于水
强碱溶于水
知识点 2
能源的分类
分类 性质 举例
一次能源 常规能源 可再生资源 水能、风能、生物质能
不可再生资源 煤、石油、天然气等化石能源
新能源 可再生资源 太阳能、地热能、潮汐能、氢能、沼气
不可再生资源 核能
二次能源 一次能源经过加工、转化得到的能源称为二次能源。 例如:电能(水电、火电、核电)、蒸气、工业余热、酒精、汽油、焦炭等 知识点 3
原电池
1. 原理
能量转换 原电池是将________转变为______的装置
装置图
电极材料 一般较活泼金属作负极,较不活泼金属(也可以是碳棒)作正极
化学能
电能
电极材料 一般较活泼金属作负极,较不活泼金属(也可以是碳棒)作正极
电极反应式 负极:________________________;正极:_____________________
电子的流向 电子由______极经外电路流入______极
电流的流向 电流由______极经外电路流入______极
离子的移向 阳离子向______极移动;阴离子向______极移动
注意 ①电子从负极、经导线流向正极,电子不能通过电解质溶液;
②电解质溶液中阴、阳离子的定向移动,组成了完整的闭合回路
Zn-2e-===Zn2+
2H++2e-===H2↑
负
正
正
负
正
负
2. 燃料电池(以硫酸溶液作电解质为例)
电极反应式 负极:H2-2e-===2H+
正极:O2+4e-+4H+===2H2O
总反应:2H2+O2===2H2O
电子的流向 负(a)极经外电路流向正(b)极
电流的流向 由正(b)极经外电路流向负(a)极
离子的移向 阳离子(H+)向正极移动
阴离子 向负极移动
3. 原电池正、负极的判断
4. 电化学腐蚀的类型
类型 吸氧腐蚀 析氢腐蚀
条件 水膜呈中性、弱酸性或碱性 水膜呈较强酸性
正极反应式 O2+2H2O+4e-===4OH- 2H++2e-===H2↑
负极反应式 Fe-2e-===Fe2+ Fe-2e-===Fe2+
总反应 2Fe+O2+2H2O===2Fe(OH)2 Fe+2H+===Fe2++H2↑
5. 原电池的应用
应用 举例
加快反应速率 锌和稀硫酸制备氢气加入少量硫酸铜溶液可加快反应速率(构成锌-铜原电池)
判断原电池中两极活动性 一般来说,作负极的为较____的金属
保护金属 在轮船的外壳镶嵌比铁活泼的金属(如锌块),可保护船身
活泼
典型例题
类型1 反应热
(2023·江苏学测)乙醇-水催化重整制氢的反应有C2H5OH(g)+3H2O(g)
2CO2(g)+6H2(g)。已知正反应是吸热反应。下列有关该反应的说法正确的是( )
A. 反应物总能量大于生成物总能量
B. 反应的能量变化与化学键的断裂与形成有关
C. 断开H—O放出热量
D. 达到化学平衡时,C2H5OH完全转化为生成物
【解析】该反应是吸热反应,反应物总能量小于生成物总能量,A错误;断开化学键吸收热量,C错误;该反应是可逆反应,可逆反应达到化学平衡时,C2H5OH不可能完全转化为生成物,D错误。
1
B
(2022·江苏学测)下列有关H2的说法正确的是( )
A. 电解水是获得氢气的途径之一
B. 升高温度可使氢气转化为液态
C. 2H2+O2===2H2O反应过程吸收能量
D. 断开H—H释放能量
【解析】物质由气态变为液态,需要降温,B错误;H2与O2反应,属于氧化反应,过程中放出热量,C错误;断开化学键需要吸收能量,D错误。
2
A
(2021·江苏学测)分解水获得H2的能量变化如图。下列说法正确的是( )
A. 分解水属于吸热反应
B. 断开H—O放出能量
C. 形成H—H吸收能量
D. 反应物的总能量大于生成物的总能量
【解析】分解水属于吸热反应,A正确;断开化学键需要吸收热量,B错误;形成化学键放出热量,C错误;由图可知,反应物的总能量小于生成物的总能量,D错误。
3
A
(2020·江苏学测)下列过程需要吸收热量的是( )
A. 甲烷在空气中燃烧
B. 稀释浓硫酸
C. 镁条与盐酸反应
D. 冰融化成水
【解析】燃烧属于放热反应,A错误;稀释浓硫酸放出热量,B错误;金属与酸反应属于放热反应,C错误;冰融化成水需要吸收热量,D正确。
4
D
(2024·无锡合格考模拟)先进的甲醇蒸气重整-变压吸附技术可得到高浓度CO2混合气、H2,化学反应原理是CH3OH+H2O===CO2+3H2,其能量变化如图所示。下列说法错误的是( )
A. CH3OH转变成H2的过程是吸收能量的过程
B. 反应物的总能量大于生成物的总能量
C. 形成H—H放出能量
D. 断开H—C吸收能量
【解析】由图可知,该反应是放热反应,即CH3OH转变成H2的过程是放出能量的过程,A错误。
1
A
(2024·淮安合格考模拟)下列属于吸热反应的是( )
A. 镁的燃烧反应
B. 盐酸与氢氧化钠的反应
C. 水的分解反应
D. 铝与氧化铁的铝热反应
2
C
类型2 原电池
(2023·江苏学测)一种氢氧燃料电池的反应装置如图所示。下列有关该电池的说法正确的是( )
A. 电极a是正极
B. 电子经导线由电极b流向电极a
C. 该电池总反应为2H2+O2===2H2O
D. 该装置可将电能转化为化学能
【解析】根据H+的移动方向,氢氧燃料电池中,H2在负极a上被氧化,O2在正极b上被还原,所以a是负极,A错误;原电池中电子由负极a经过导线流向正极b,B错误;氢氧燃料电池的总反应为2H2+O2===2H2O,C正确;该装置可将化学能转化为电能,D错误。
5
C
(2022·江苏学测)某原电池结构如图所示。下列说法正确的是( )
A. Zn为正极
B. Cu表面气体为H2
C. 电子由Cu流向Zn
D. 可以将电能转化为化学能
【解析】铜-锌原电池中,Zn比Cu活泼,Zn作负极,A错误;Cu表面有H+得电子生成H2,B正确;电子由Zn经导线流向Cu,C错误;原电池可将化学能转化为电能,D错误。
6
B
(2021·江苏学测)某兴趣小组模拟纸电池进行实验(如图)。下列有关该纸电池说法正确的是( )
A. Zn为正极
B. 工作时Cu电极发生氧化反应
C. 工作时电子经外电路由Cu流向Zn
D. 工作一段时间后,Cu电极质量增加
【解析】Zn、Cu、CuSO4组成原电池,Zn为负极,发生氧化反应,A、B错误;电子从Zn极经外电路流入Cu极,C错误;正极反应式:Cu2++2e-===Cu,质量增加,D正确。
7
D
(2020·江苏学测)某同学用右图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是( )
A. 锌片不断溶解,说明Zn失去电子
B. 铜片上产生气泡,说明溶液中H+在其表面得到电子
C. 电流计指针发生偏转,说明该装置将电能转化为化学能
D. 该装置中发生的总反应:
Zn+H2SO4 ===ZnSO4 +H2↑
【解析】该装置是原电池,是将化学能转化为电能的装置,C错误。
8
C
(2024·扬州合格考模拟)锂-海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法正确的是( )
A. 金属镍作负极
B. 金属锂发生还原反应
C. 电子从锂电极经用电设备流向镍电极
D. 可将电能转化为化学能
【解析】Li失去电子,发生氧化反应,Li作负极,金属镍作正极,A、B错误;电子从锂电极经用电设备流向镍电极,C正确;可将化学能转化为电能,D错误。
3
C
谢谢观赏
同课章节目录
