氯及其化合物(复习课)(共18张PPT)
文档属性
| 名称 | 氯及其化合物(复习课)(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-07 08:09:54 | ||
图片预览


文档简介
(共18张PPT)
氯及其化合物(复习课)
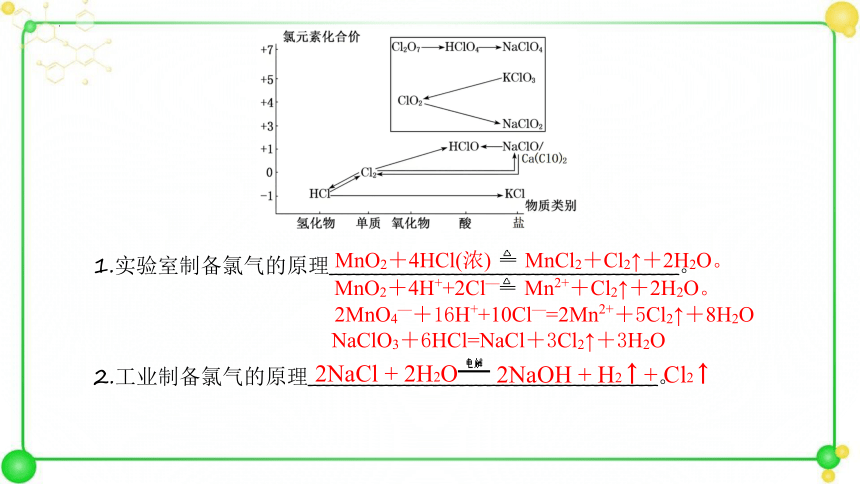
1.实验室制备氯气的原理_______________________________________。
2.工业制备氯气的原理_______________________________________。
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。
MnO2+4H++2Cl—
Mn2++Cl2↑+2H2O。
2MnO4—+16H++10Cl—=2Mn2++5Cl2↑+8H2O
NaClO3+6HCl=NaCl+3Cl2↑+3H2O
2NaCl + 2H2O
2NaOH + H2 ↑ + Cl2 ↑
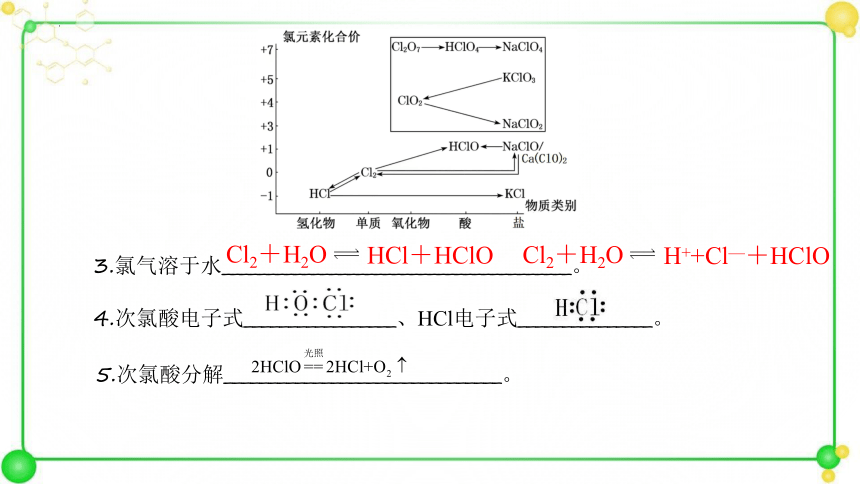
3.氯气溶于水_______________________________________。
4.次氯酸电子式_________________、HCl电子式_______________。
5.次氯酸分解_______________________________。
Cl2+H2O
HCl+HClO
Cl2+H2O
H++Cl—+HClO
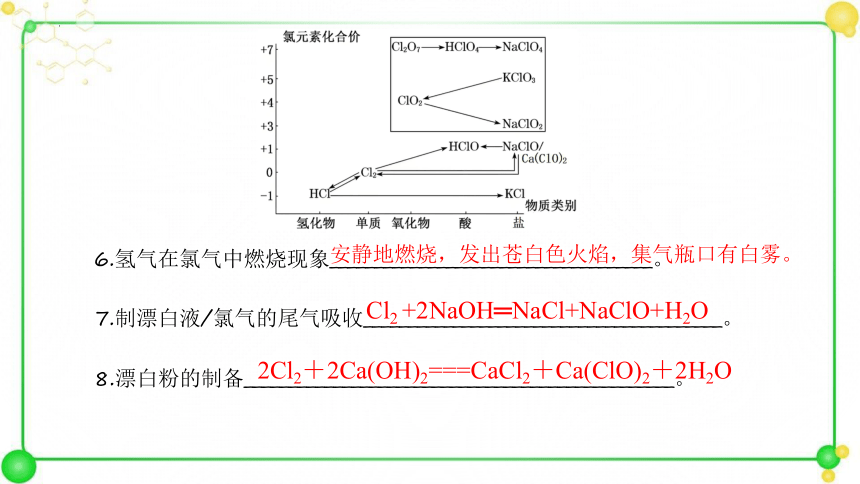
6.氢气在氯气中燃烧现象____________________________________。
7.制漂白液/氯气的尾气吸收________________________________________。
8.漂白粉的制备________________________________________________。
Cl2 +2NaOH═NaCl+NaClO+H2O
安静地燃烧,发出苍白色火焰,集气瓶口有白雾。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
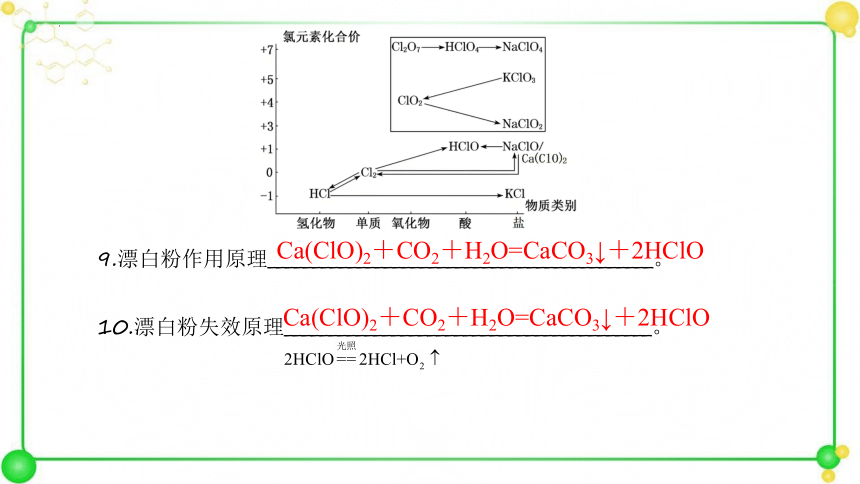
9.漂白粉作用原理___________________________________________。
10.漂白粉失效原理_________________________________________。
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
一、物质的性质及用途
1. 下列关于氯及其化合物的说法错误的是( )
A.ClO2具有强氧化性,可用作自来水消毒剂
B.Ca(ClO)2易溶于水,可用于制作漂白粉
C.氯气具有漂白性能使湿润的有色布条褪色
D.氯气与烧碱溶液或石灰乳反应均能得到含氯消毒剂
E.盐酸具有挥发性,可用于除水垢
F.通常状况下氯气与铁不反应,氯气的储存能用铁质容器
BCE
二、物质间的转化
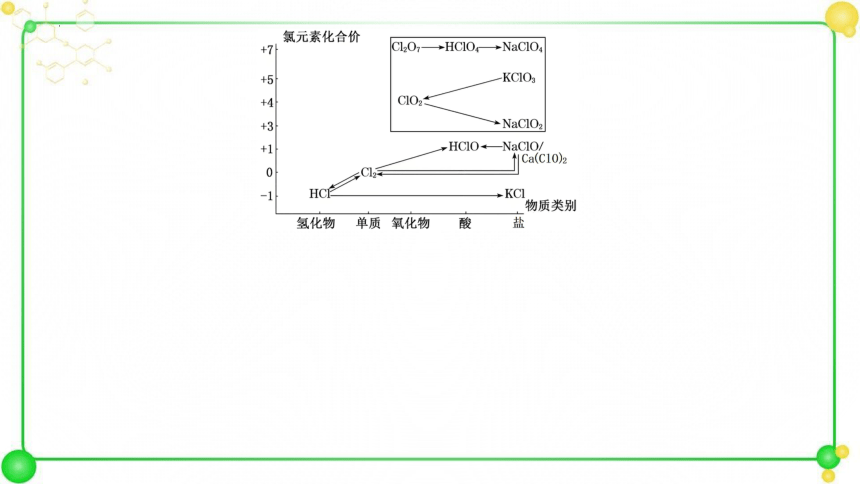
2.氯元素是一种重要的“成盐元素”。部分含氯物质的分类与相应化合价关系如图所示。下列说法不正确的是( )
A.存在f→d→a的转化关系
B.d的稳定性差,其溶液久置后酸性减弱
C.a溶液和f溶液混合可以制得b
D.e的钾盐常用于实验室制O2
B
三、常见物质的制备及性质探究
3.氯及其化合物广泛应用于日常生活中,氯气是制备含氯化合物的重要原料。下列说法中正确的是( )
C
证明氧化性
三、常见物质的制备及性质探究
4.实验室在低温条件下将Cl2通入KOH溶液制取KClO溶液。下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取Cl2 B.用装置乙除去Cl2中混有的HCl
C.用装置丙制取KClO溶液 D.用装置丁吸收尾气中的Cl2
A
三、常见物质的制备及性质探究
5.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
A.脱脂棉中的无水氯化钙可以用碱石灰代替
B.该实验装置可证明干燥的氯气没有漂白作用
C.湿润的紫色石蕊试纸变红色,说明反应生成了酸性物质
D.湿润的淀粉碘化钾试纸变蓝色,然后又逐渐褪去,说明氯气具有漂白性
B
四、陌生物质的制备
6.Cl2O是黄棕色具有强烈刺激性气味的气体,也是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机化合物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O。下列说法不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
C
四、陌生物质的制备
7.NaClO2是一种重要的杀菌消毒剂,NaClO2的一种生产工艺流程如图所示。下列说法错误的是( )
A.在该生产过程中,有三处涉及氧化还原反应
B.在电解过程中,NaClO2是还原产物
C.“尾气吸收”反应中,氧化剂与还原剂的个数之比为1:2
D.电解过程中,每反应5个ClO2转移电子数为5
C
四、陌生物质的制备
8.实验室可用干燥的氯气与亚氯酸钠(NaClO2)固体反应来制备ClO2,装置如图所示,已知ClO2常温下为黄绿色气体,熔点-56℃,沸点11℃,极易溶于水且不与水反应,高浓度的ClO2受热时易爆炸,下列说法不正确的是( )
A.导气管K的作用是平衡气压,保证液体顺利流下
B.C和F中不可选用同一种物质
C.D中通入一定量的干燥空气,目的主要是防止生成的ClO2浓度过高,发生爆炸
D.D中发生的化学反应中氧化剂与还原剂的物质的量之比为2∶1
B
四、守恒法微计算
9.将一定量的氯气通入热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO和NaClO3的共存体系。下列判断错误的是( )
A.参加反应的氯气与NaOH个数比为1:2
B.生成物中NaCl、NaClO和NaClO3的个数比可能为6:1:1
C.若有一个氯气参加反应,转移的电子数目1到4/3之间
D.反应后的溶液中,Na+与Cl—个数比可能为7:4
D
四、综合题
10.氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl—和少量的 ,可利用酸性FeSO4溶液将 转化为Cl—除去。
①关于二氧化氯的说法不正确的是 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为 。
BD
4Fe2++ClO2—+4H+=4Fe3++Cl—+2H2O
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH—NaClO2+O2+H2O(未配平)。
①ClO2的氧化性 H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:ClO2—+4I—+4H+=2H2O+2I2+Cl—,杂质不与I—反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2S2O32—=2I—+S4O62—)。计算该样品的纯度为 。(写出计算过程)
大于
90.50%
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl—,则SO2的氧化产物是 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。
结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是 。
SO42—
酸性条件下NaClO2发生歧化反应生成ClO2,温度升高,ClO2从溶液体系中溢出,且SO2的溶解度降低
氯及其化合物(复习课)
1.实验室制备氯气的原理_______________________________________。
2.工业制备氯气的原理_______________________________________。
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。
MnO2+4H++2Cl—
Mn2++Cl2↑+2H2O。
2MnO4—+16H++10Cl—=2Mn2++5Cl2↑+8H2O
NaClO3+6HCl=NaCl+3Cl2↑+3H2O
2NaCl + 2H2O
2NaOH + H2 ↑ + Cl2 ↑
3.氯气溶于水_______________________________________。
4.次氯酸电子式_________________、HCl电子式_______________。
5.次氯酸分解_______________________________。
Cl2+H2O
HCl+HClO
Cl2+H2O
H++Cl—+HClO
6.氢气在氯气中燃烧现象____________________________________。
7.制漂白液/氯气的尾气吸收________________________________________。
8.漂白粉的制备________________________________________________。
Cl2 +2NaOH═NaCl+NaClO+H2O
安静地燃烧,发出苍白色火焰,集气瓶口有白雾。
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
9.漂白粉作用原理___________________________________________。
10.漂白粉失效原理_________________________________________。
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
一、物质的性质及用途
1. 下列关于氯及其化合物的说法错误的是( )
A.ClO2具有强氧化性,可用作自来水消毒剂
B.Ca(ClO)2易溶于水,可用于制作漂白粉
C.氯气具有漂白性能使湿润的有色布条褪色
D.氯气与烧碱溶液或石灰乳反应均能得到含氯消毒剂
E.盐酸具有挥发性,可用于除水垢
F.通常状况下氯气与铁不反应,氯气的储存能用铁质容器
BCE
二、物质间的转化
2.氯元素是一种重要的“成盐元素”。部分含氯物质的分类与相应化合价关系如图所示。下列说法不正确的是( )
A.存在f→d→a的转化关系
B.d的稳定性差,其溶液久置后酸性减弱
C.a溶液和f溶液混合可以制得b
D.e的钾盐常用于实验室制O2
B
三、常见物质的制备及性质探究
3.氯及其化合物广泛应用于日常生活中,氯气是制备含氯化合物的重要原料。下列说法中正确的是( )
C
证明氧化性
三、常见物质的制备及性质探究
4.实验室在低温条件下将Cl2通入KOH溶液制取KClO溶液。下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取Cl2 B.用装置乙除去Cl2中混有的HCl
C.用装置丙制取KClO溶液 D.用装置丁吸收尾气中的Cl2
A
三、常见物质的制备及性质探究
5.如图是某同学设计的氯气制备及性质验证实验装置。相关说法正确的是( )
A.脱脂棉中的无水氯化钙可以用碱石灰代替
B.该实验装置可证明干燥的氯气没有漂白作用
C.湿润的紫色石蕊试纸变红色,说明反应生成了酸性物质
D.湿润的淀粉碘化钾试纸变蓝色,然后又逐渐褪去,说明氯气具有漂白性
B
四、陌生物质的制备
6.Cl2O是黄棕色具有强烈刺激性气味的气体,也是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机化合物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O。下列说法不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
C
四、陌生物质的制备
7.NaClO2是一种重要的杀菌消毒剂,NaClO2的一种生产工艺流程如图所示。下列说法错误的是( )
A.在该生产过程中,有三处涉及氧化还原反应
B.在电解过程中,NaClO2是还原产物
C.“尾气吸收”反应中,氧化剂与还原剂的个数之比为1:2
D.电解过程中,每反应5个ClO2转移电子数为5
C
四、陌生物质的制备
8.实验室可用干燥的氯气与亚氯酸钠(NaClO2)固体反应来制备ClO2,装置如图所示,已知ClO2常温下为黄绿色气体,熔点-56℃,沸点11℃,极易溶于水且不与水反应,高浓度的ClO2受热时易爆炸,下列说法不正确的是( )
A.导气管K的作用是平衡气压,保证液体顺利流下
B.C和F中不可选用同一种物质
C.D中通入一定量的干燥空气,目的主要是防止生成的ClO2浓度过高,发生爆炸
D.D中发生的化学反应中氧化剂与还原剂的物质的量之比为2∶1
B
四、守恒法微计算
9.将一定量的氯气通入热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO和NaClO3的共存体系。下列判断错误的是( )
A.参加反应的氯气与NaOH个数比为1:2
B.生成物中NaCl、NaClO和NaClO3的个数比可能为6:1:1
C.若有一个氯气参加反应,转移的电子数目1到4/3之间
D.反应后的溶液中,Na+与Cl—个数比可能为7:4
D
四、综合题
10.氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl—和少量的 ,可利用酸性FeSO4溶液将 转化为Cl—除去。
①关于二氧化氯的说法不正确的是 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为 。
BD
4Fe2++ClO2—+4H+=4Fe3++Cl—+2H2O
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH—NaClO2+O2+H2O(未配平)。
①ClO2的氧化性 H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:ClO2—+4I—+4H+=2H2O+2I2+Cl—,杂质不与I—反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2S2O32—=2I—+S4O62—)。计算该样品的纯度为 。(写出计算过程)
大于
90.50%
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl—,则SO2的氧化产物是 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。
结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是 。
SO42—
酸性条件下NaClO2发生歧化反应生成ClO2,温度升高,ClO2从溶液体系中溢出,且SO2的溶解度降低
同课章节目录
