高中化学苏教版(2019)选必修2 专题3 第三单元共价键课件(共23张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选必修2 专题3 第三单元共价键课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-07 08:10:23 | ||
图片预览





文档简介
(共23张PPT)
共价键
思考与讨论
思考1:为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
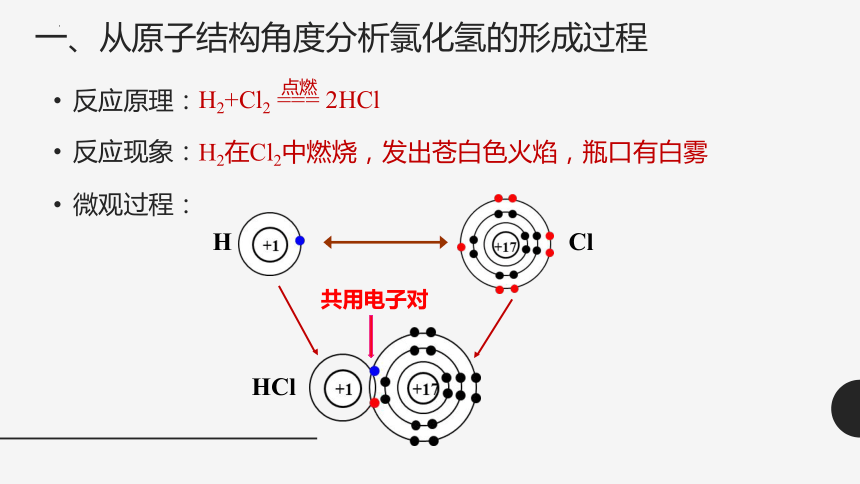
一、从原子结构角度分析氯化氢的形成过程
反应原理:
H2+Cl2 === 2HCl
点燃
反应现象:
H2在Cl2中燃烧,发出苍白色火焰,瓶口有白雾
微观过程:
HCl
共用电子对
H
Cl
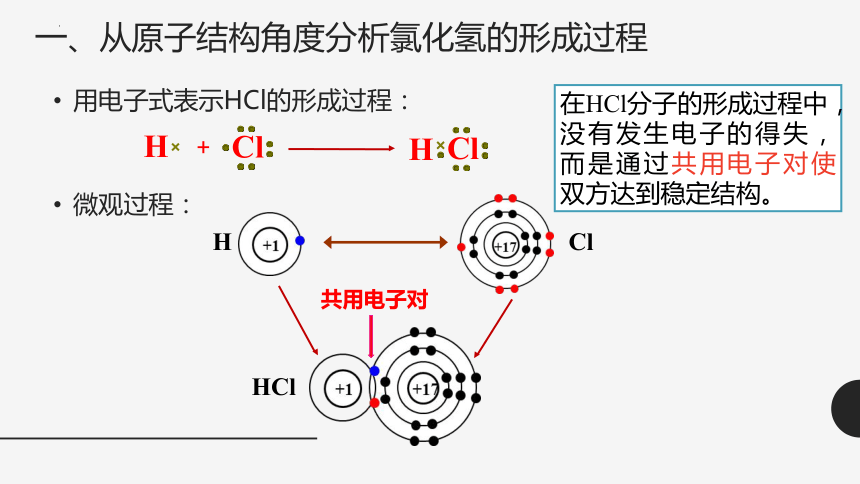
一、从原子结构角度分析氯化氢的形成过程
用电子式表示HCl的形成过程:
微观过程:
H
Cl
HCl
共用电子对
Cl
H
+
Cl
H
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对使双方达到稳定结构。
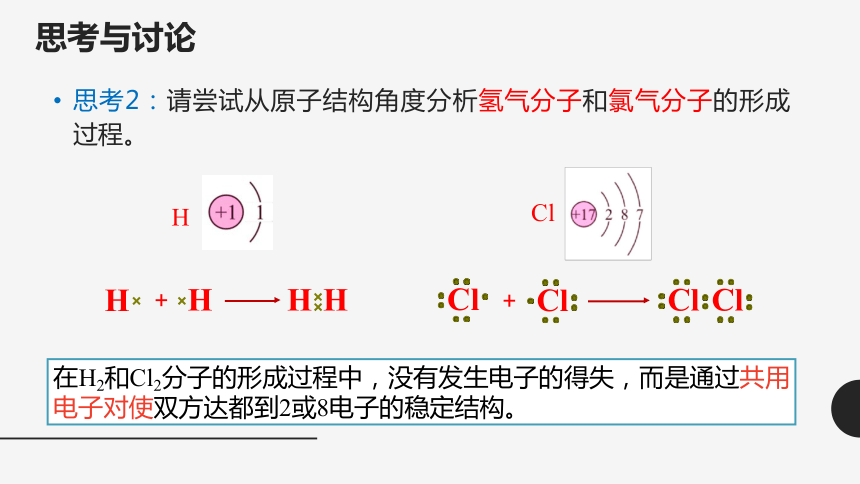
思考与讨论
思考2:请尝试从原子结构角度分析氢气分子和氯气分子的形成过程。
H
Cl
Cl
H
+
Cl
H
+
H
H
Cl
Cl
在H2和Cl2分子的形成过程中,没有发生电子的得失,而是通过共用电子对使双方达都到2或8电子的稳定结构。
二、共价键
定义:原子间通过共用电子对所形成的相互作用叫做共价键
1、成键粒子:原子
2、成键本质:共用电子对对两个原子的相互作用
3、成键原因:
①通过共用电子对,各原子最外层电子数目一般能达到饱和。由不稳定变稳定;
②两原子核都吸引共用电子对,使之处于平衡状态;
③原子通过共用电子对形成共价键后,体系总能量降低。
Cl
H
H
H
Cl
Cl
4、成键元素:一般为同种或不同种的非金属元素
二、共价键
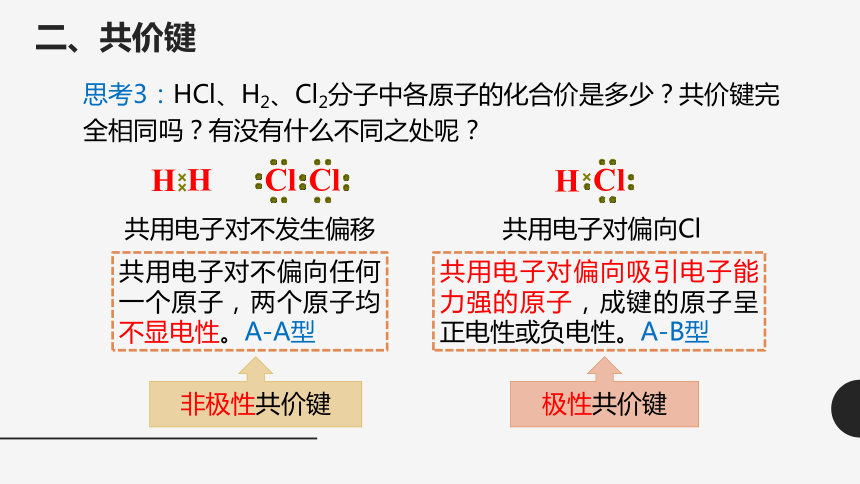
思考3:HCl、H2、Cl2分子中各原子的化合价是多少?共价键完全相同吗?有没有什么不同之处呢?
Cl
H
H
H
Cl
Cl
共用电子对不偏向任何一个原子,两个原子均不显电性。A-A型
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子,成键的原子呈正电性或负电性。A-B型
共用电子对偏向Cl
非极性共价键
极性共价键
二、共价键
4、成键元素:一般为同种或不同种的非金属元素
5、共价键类型:
①非极性共价键:同种原子间形成,共用电子对不发生偏移
②极性共价键:不同种原子间形成,共用电子对偏向吸引电子能力强的原子。
二、共价键
思考4:试分析下列物质或离子中是否存在共价键?
O2、Cl2、CO2、H2O、HF、NH3、NaOH、K2SO4、NH4Cl、ClO3- 、CO32-
共价键存在于:多原子单质分子、非金属氧化物、非金属氢化物、带电原子团等。
思考5: NaOH、K2SO4、NH4Cl中含有共价键,它们属于什么化合物?为什么?
都属于离子化合物。因为这些化合物由离子键构成。
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、弱碱、大多数有机化合物、少数盐类都是共价化合物。
物质类别 常见代表物 性质特点
共价化合物 ①非金属氧化物:CO2、H2O ②非金属氢化物:HCl、CH4 ③酸:H2SO4 、HNO3 ④弱碱:NH3 H2O ⑤大多数有机化合物:乙醇 、蔗糖等 ⑥少数盐:AlCl3 、FeCl3等 液态不能导电
熔沸点低、易挥发
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、弱碱、大多数有机化合物、少数盐类都是共价化合物。
思考6: 共价键是否只存在于共价化合物中?
不是。非金属单质,如Cl2中存在共价键。复杂的离子化合物中也存在共价键,如NaOH、NH4Cl、Na2SO4是离子化合物,但含有共价键。
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、大多数有机化合物、少数盐类都是共价化合物。
思考7: 共价化合物中一定不含金属元素?只含有非金属元素的化合物一定是共价化合物?
不是。AlCl3含铝元素,但属于共价化合物。 NH4Cl不含金属元素,但属于离子化合物。
一定含有离子键,可能含有共价键
只含有共价键
离子键
共用电子对
阴、阳离子
原子
离子化合物与共价化合物的比较
【思考】如何通过实验区分离子化合物和共价化合物?
看熔融状态下能否导电,能导电的是离子化合物,不能导电的是共价化合物。
三、共价化合物
思考8:试分析下列物质中是否存在共价键?属于什么类型的物质?
1. CaBr2
2. HF
3. CO2
4. HClO
5. HNO3
7. O2
8. NaOH
6. C2H5OH
9. NH4Cl
10. Na2O2
有 离子化合物
无 离子化合物
有 共价化合物
有 非金属单质
有 共价化合物
有 共价化合物
有 共价化合物
有 共价化合物
有 离子化合物
有 离子化合物
四、共价分子的表示方法
1、电子式
①每个原子一般达到2或8电子的相对稳定结构
②不加中括号[ ],不标正负电荷数
请尝试书写NH3、HF、H2S、CO2的电子式
请试着写出H2、HCl、H2O、CH4的电子式:
四、共价分子的表示方法
1、电子式
③以共价键结合的原子间形成的共用电子对,可以是1对,也可以形成2对或者3对。
④原子周围共用电子对数=8(或2)-原子最外层电子数
请尝试书写O2、CS2、HClO的电子式
O C O
N N
非金属原子 H C N O Cl
共用电子对数
1
1
4
3
2
四、共价分子的表示方法
思考:OH-、O22-、NH4+ 中是否存在共价键?电子式应该如何书写?
O H
[ ]-
O O
[ ]2-
[ ]+
N
H
H
H
H
【练习】写出以下物质的电子式: NaOH、Na2O2、H2O2、 NH4Cl
四、共价分子的表示方法
2、结构式
H—H
H—Cl
H-O-H
O C O
O=C=O
结构式:分别用“-、═、≡”表示一对、二对和三对共用电子对
请尝试书写NH3、CH4、N2、O2 、HClO 、H2O2的结构式
四、共价分子的表示方法
3、球棍模型
H—H
H—Cl
H-O-H
O=C=O
球棍模型:可以形象的展示出分子的空间结构和成键情况
直线形分子
V形(或角形)分子
4、空间填充模型
四、共价分子的表示方法
空间填充模型:表示每个原子的容积和分子实际形状的致密的分子模型。
H—H
H—Cl
H-O-H
O=C=O
四、共价分子的表示方法
分子 电子式 结构式 球棍模型 空间填充模型 空间结构
HCl
Cl2
CO2
H2O
NH3
CH4
V形
直线形
直线形
三角锥形
直线形
正四面体形
O C O
Cl
Cl
H—Cl
H-O-H
O=C=O
H-N-H
H
Cl—Cl
五、用电子式表示共价分子的形成过程
Cl
H
+
Cl
H
Cl
Cl
+
Cl
Cl
O
H
+
O
H
H
H
+
3
H
N
+
N
H
H
H
【注意事项】
①左边写原子电子式,相同原子可以合并;右边分子的电子式,相同原子不能合并。
②不用弧形箭头表示电子的转移。
请尝试用电子式表示CH4、N2、H2S的形成过程
请用电子式表示HCl、Cl2、H2O、NH3的形成过程:
小结:化学键
概念:相邻的原子之间强烈的相互作用叫做化学键。
分类:
化学键
共价键
离子键
非极性共价键
极性共价键
原子间电子的得失
原子间电子的共用
共用电子对不偏移
共用电子对偏移
共价键
思考与讨论
思考1:为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
一、从原子结构角度分析氯化氢的形成过程
反应原理:
H2+Cl2 === 2HCl
点燃
反应现象:
H2在Cl2中燃烧,发出苍白色火焰,瓶口有白雾
微观过程:
HCl
共用电子对
H
Cl
一、从原子结构角度分析氯化氢的形成过程
用电子式表示HCl的形成过程:
微观过程:
H
Cl
HCl
共用电子对
Cl
H
+
Cl
H
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对使双方达到稳定结构。
思考与讨论
思考2:请尝试从原子结构角度分析氢气分子和氯气分子的形成过程。
H
Cl
Cl
H
+
Cl
H
+
H
H
Cl
Cl
在H2和Cl2分子的形成过程中,没有发生电子的得失,而是通过共用电子对使双方达都到2或8电子的稳定结构。
二、共价键
定义:原子间通过共用电子对所形成的相互作用叫做共价键
1、成键粒子:原子
2、成键本质:共用电子对对两个原子的相互作用
3、成键原因:
①通过共用电子对,各原子最外层电子数目一般能达到饱和。由不稳定变稳定;
②两原子核都吸引共用电子对,使之处于平衡状态;
③原子通过共用电子对形成共价键后,体系总能量降低。
Cl
H
H
H
Cl
Cl
4、成键元素:一般为同种或不同种的非金属元素
二、共价键
思考3:HCl、H2、Cl2分子中各原子的化合价是多少?共价键完全相同吗?有没有什么不同之处呢?
Cl
H
H
H
Cl
Cl
共用电子对不偏向任何一个原子,两个原子均不显电性。A-A型
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子,成键的原子呈正电性或负电性。A-B型
共用电子对偏向Cl
非极性共价键
极性共价键
二、共价键
4、成键元素:一般为同种或不同种的非金属元素
5、共价键类型:
①非极性共价键:同种原子间形成,共用电子对不发生偏移
②极性共价键:不同种原子间形成,共用电子对偏向吸引电子能力强的原子。
二、共价键
思考4:试分析下列物质或离子中是否存在共价键?
O2、Cl2、CO2、H2O、HF、NH3、NaOH、K2SO4、NH4Cl、ClO3- 、CO32-
共价键存在于:多原子单质分子、非金属氧化物、非金属氢化物、带电原子团等。
思考5: NaOH、K2SO4、NH4Cl中含有共价键,它们属于什么化合物?为什么?
都属于离子化合物。因为这些化合物由离子键构成。
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、弱碱、大多数有机化合物、少数盐类都是共价化合物。
物质类别 常见代表物 性质特点
共价化合物 ①非金属氧化物:CO2、H2O ②非金属氢化物:HCl、CH4 ③酸:H2SO4 、HNO3 ④弱碱:NH3 H2O ⑤大多数有机化合物:乙醇 、蔗糖等 ⑥少数盐:AlCl3 、FeCl3等 液态不能导电
熔沸点低、易挥发
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、弱碱、大多数有机化合物、少数盐类都是共价化合物。
思考6: 共价键是否只存在于共价化合物中?
不是。非金属单质,如Cl2中存在共价键。复杂的离子化合物中也存在共价键,如NaOH、NH4Cl、Na2SO4是离子化合物,但含有共价键。
三、共价化合物
定义:只含有共价键的化合物称作共价化合物。
存在:非金属氢化物、酸、非金属氧化物、大多数有机化合物、少数盐类都是共价化合物。
思考7: 共价化合物中一定不含金属元素?只含有非金属元素的化合物一定是共价化合物?
不是。AlCl3含铝元素,但属于共价化合物。 NH4Cl不含金属元素,但属于离子化合物。
一定含有离子键,可能含有共价键
只含有共价键
离子键
共用电子对
阴、阳离子
原子
离子化合物与共价化合物的比较
【思考】如何通过实验区分离子化合物和共价化合物?
看熔融状态下能否导电,能导电的是离子化合物,不能导电的是共价化合物。
三、共价化合物
思考8:试分析下列物质中是否存在共价键?属于什么类型的物质?
1. CaBr2
2. HF
3. CO2
4. HClO
5. HNO3
7. O2
8. NaOH
6. C2H5OH
9. NH4Cl
10. Na2O2
有 离子化合物
无 离子化合物
有 共价化合物
有 非金属单质
有 共价化合物
有 共价化合物
有 共价化合物
有 共价化合物
有 离子化合物
有 离子化合物
四、共价分子的表示方法
1、电子式
①每个原子一般达到2或8电子的相对稳定结构
②不加中括号[ ],不标正负电荷数
请尝试书写NH3、HF、H2S、CO2的电子式
请试着写出H2、HCl、H2O、CH4的电子式:
四、共价分子的表示方法
1、电子式
③以共价键结合的原子间形成的共用电子对,可以是1对,也可以形成2对或者3对。
④原子周围共用电子对数=8(或2)-原子最外层电子数
请尝试书写O2、CS2、HClO的电子式
O C O
N N
非金属原子 H C N O Cl
共用电子对数
1
1
4
3
2
四、共价分子的表示方法
思考:OH-、O22-、NH4+ 中是否存在共价键?电子式应该如何书写?
O H
[ ]-
O O
[ ]2-
[ ]+
N
H
H
H
H
【练习】写出以下物质的电子式: NaOH、Na2O2、H2O2、 NH4Cl
四、共价分子的表示方法
2、结构式
H—H
H—Cl
H-O-H
O C O
O=C=O
结构式:分别用“-、═、≡”表示一对、二对和三对共用电子对
请尝试书写NH3、CH4、N2、O2 、HClO 、H2O2的结构式
四、共价分子的表示方法
3、球棍模型
H—H
H—Cl
H-O-H
O=C=O
球棍模型:可以形象的展示出分子的空间结构和成键情况
直线形分子
V形(或角形)分子
4、空间填充模型
四、共价分子的表示方法
空间填充模型:表示每个原子的容积和分子实际形状的致密的分子模型。
H—H
H—Cl
H-O-H
O=C=O
四、共价分子的表示方法
分子 电子式 结构式 球棍模型 空间填充模型 空间结构
HCl
Cl2
CO2
H2O
NH3
CH4
V形
直线形
直线形
三角锥形
直线形
正四面体形
O C O
Cl
Cl
H—Cl
H-O-H
O=C=O
H-N-H
H
Cl—Cl
五、用电子式表示共价分子的形成过程
Cl
H
+
Cl
H
Cl
Cl
+
Cl
Cl
O
H
+
O
H
H
H
+
3
H
N
+
N
H
H
H
【注意事项】
①左边写原子电子式,相同原子可以合并;右边分子的电子式,相同原子不能合并。
②不用弧形箭头表示电子的转移。
请尝试用电子式表示CH4、N2、H2S的形成过程
请用电子式表示HCl、Cl2、H2O、NH3的形成过程:
小结:化学键
概念:相邻的原子之间强烈的相互作用叫做化学键。
分类:
化学键
共价键
离子键
非极性共价键
极性共价键
原子间电子的得失
原子间电子的共用
共用电子对不偏移
共用电子对偏移
