4.2 课时3 电解原理的应用(18页)课件 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 课时3 电解原理的应用(18页)课件 2024-2025学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-04 14:45:07 | ||
图片预览

文档简介
(共18张PPT)
电解原理的应用
第四章 化学反应与电能
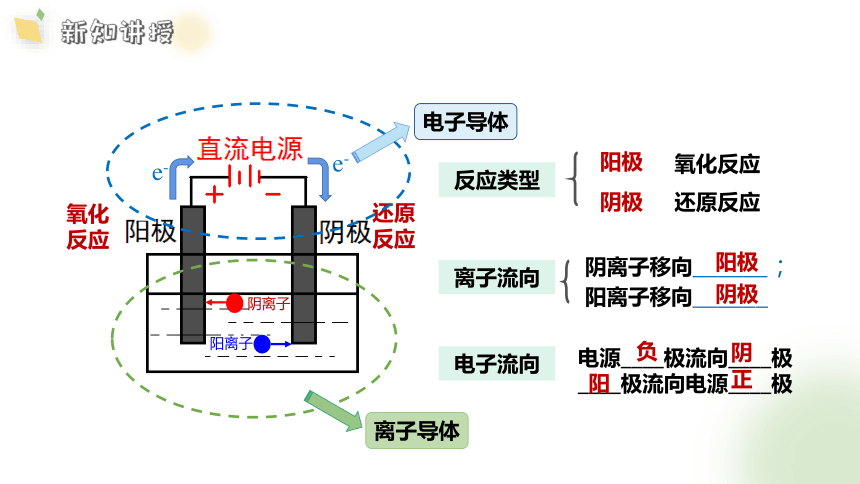
氧化
反应
还原
反应
阴离子
阳离子
氧化反应
还原反应
阳极
阴极
阴离子移向______;
阳离子移向______
阳极
阴极
离子流向
反应类型
电子流向
电源____极流向____极
____极流向电源____极
负
阴
阳
正
e-
e-
电子导体
离子导体
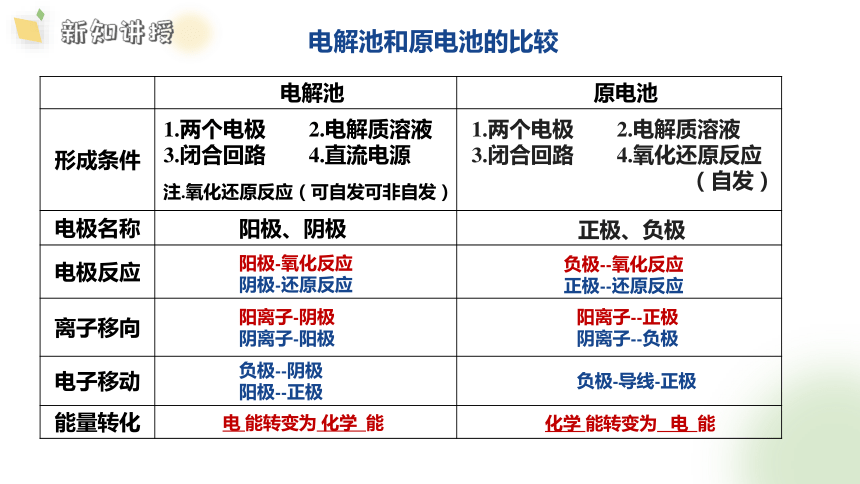
电解池和原电池的比较
电解池 原电池
形成条件
电极名称
电极反应
离子移向
电子移动
能量转化
1.两个电极 2.电解质溶液
3.闭合回路 4.直流电源
1.两个电极 2.电解质溶液
3.闭合回路 4.氧化还原反应
(自发)
阳极、阴极
正极、负极
阳极-氧化反应
阴极-还原反应
负极--氧化反应
正极--还原反应
阳离子-阴极
阴离子-阳极
阳离子--正极
阴离子--负极
负极--阴极
阳极--正极
负极-导线-正极
注.氧化还原反应(可自发可非自发)
化学 能转变为 电 能
电 能转变为 化学 能
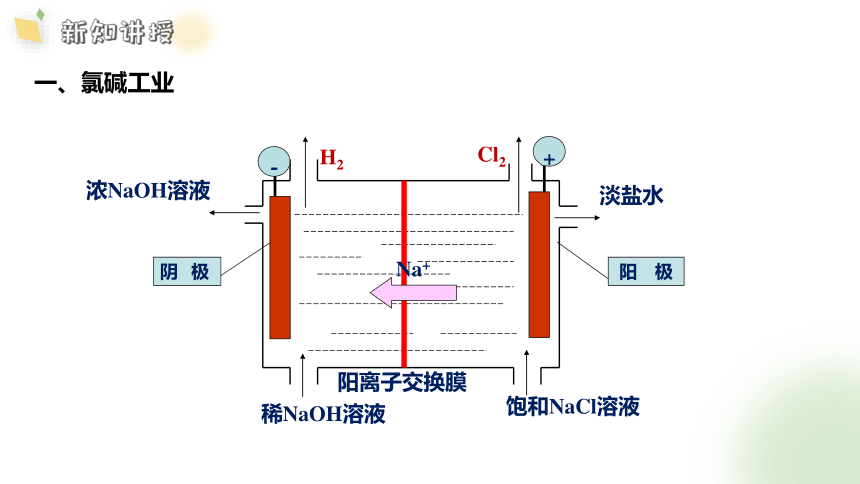
一、氯碱工业
+
-
Cl2
H2
Na+
淡盐水
NaOH溶液
饱和NaCl溶液
阳离子交换膜
阳 极
阴 极
饱和NaCl溶液
稀NaOH溶液
浓NaOH溶液
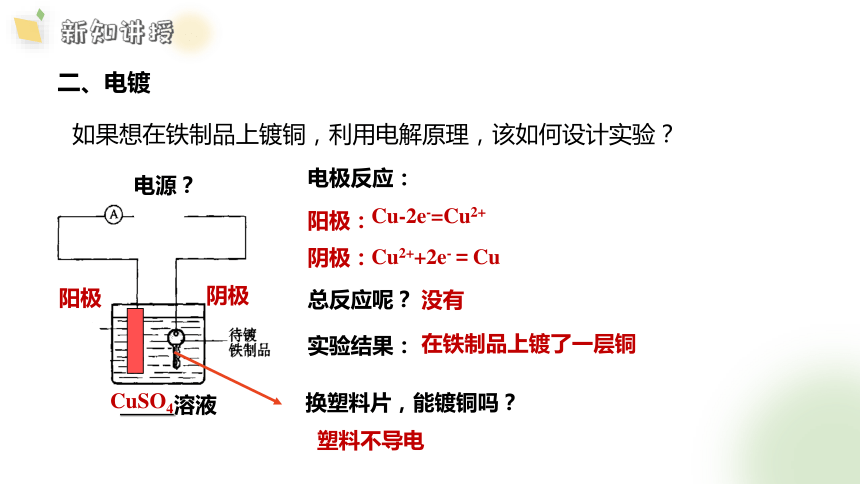
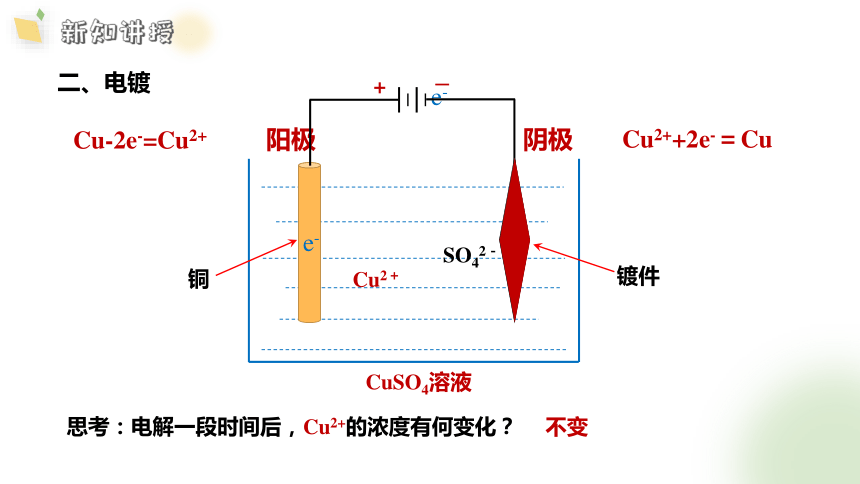
二、电镀
阳极:
阴极:
Cu2++2e-=Cu
Cu-2e-=Cu2+
如果想在铁制品上镀铜,利用电解原理,该如何设计实验?
电极反应:
阳极
阴极
溶液
CuSO4
电源?
总反应呢?
没有
实验结果:
在铁制品上镀了一层铜
换塑料片,能镀铜吗?
塑料不导电
e-
二、电镀
阴极
镀件
CuSO4溶液
阳极
+
-
铜
Cu2+
SO42-
e-
Cu2++2e-=Cu
Cu-2e-=Cu2+
思考:电解一段时间后,Cu2+的浓度有何变化?
不变
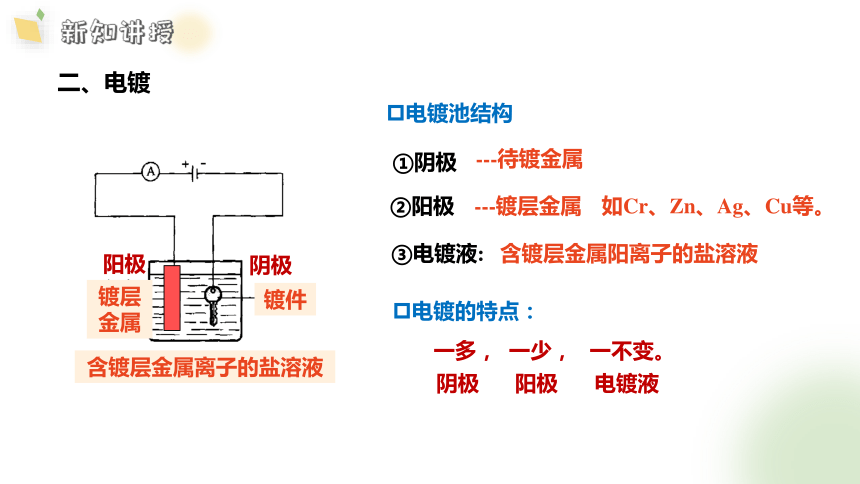
二、电镀
阳极
阴极
溶液?
CuSO4
镀件
含镀层金属离子的盐溶液
电镀池结构
①阴极
②阳极
③电镀液:
电镀的特点:
一多, 一少, 一不变。
---镀层金属
---待镀金属
含镀层金属阳离子的盐溶液
如Cr、Zn、Ag、Cu等。
阴极
阳极
电镀液
镀层金属
【例1】利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-=Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
C
思考:工业上制备的铜,其含Cu约98.5%,还含有Fe、Ag、Au等杂质,为粗铜,需要通过再次精炼处理才能得到纯度为99.99%精铜(用于电器及其他很多工),如何用电解的方法得到纯铜?
粗铜
精铜
三、电解精炼
(1)粗铜 含杂质(Zn Fe Ni Ag Au 等)
(2)粗铜的精炼模型
阳极:
阴极:
电解液:
粗铜
纯铜
CuSO4溶液
+
纯铜
粗铜
-
CuSO4溶液
【思考】通电后,阳极和阴极上的金属微粒发生了哪些变化?
---不活泼金属: Au、Ag
提炼金、银等贵重金属。
问:电解完后,电解质溶液有何变化?
①电解质溶液的Cu2+浓度减小,不断补充CuSO4溶液
②引入了Zn2+、Fe2+、Ni2+等杂质,需定时除去
【例2】粗铜中含有杂质,用下图装置精炼铜。下列有关说法正确的是( )
A、a 是粗铜、b 是纯铜
B、反应前后CuSO4 电解液的浓度保持不变
C、阴极电极反应为:Cu2++2e-=Cu
D、电解过程中,a、b两极质量的变化量一直相等
C
【例3】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A、阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
D
四、电冶金
使矿石中的金属离子获得电子变成金属单质的过程
金属冶炼:
得电子,被还原
Mn+ M
+ne-
正价
0价
K Ca Na Mg Al︱Zn Fe Sn Pb (H) Cu ︱ Hg Ag ︱Pt Au
电解法
热还原法
热分解法
富集法
通常极难被还原的活泼金属从它们的化合物中还原出来
(1)金属钠
电解熔融的氯化钠
阳极:
2Cl- -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
总方程式 阳极、阴极反应式
冶炼钠 2NaCl(熔融) 2Na+Cl2↑ 2Cl--2e-= Cl2↑
2Na++2e-= 2Na
冶炼镁 MgCl2(熔融) Mg+Cl2↑ 2Cl--2e-= Cl2↑
Mg2++2e-= Mg
冶炼铝 2Al2O3(熔融) 4Al+3O2↑ 6O2--12e-= 3O2↑
4Al3++12e-= 4Al
(2)应用
制取一些活泼金属单质
注意:冰晶石(六氟合铝酸钠Na3AlF6)作为助熔剂,降低Al2O3的熔点
【例4】下列可被工业上采用的冶金方法是( )
A.电解氯化钠溶液制钠 B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝 D.高温下用一氧化碳还原氧化铁制铁
BD
【例5】污水处理——含氰废水处理
废水处理装置示意图
OH-
N2
-3 0
CN- N2
思考1:废水处理时, N2在哪个电极产生?
+2 -3
某厂电镀废水中含有毒性较大的CN-,可在碱性条件下用电解法将其转变为N2
思考2:书写阴极区发生的电极反应,并分析阴离子交换膜的作用?
负离子交换膜
NaOH溶液
氧化反应
+ -
2CN-+ 12OH--10e- 2CO32-+N2+6H2O
2H2O + 2e- === H2 +2OH-
H2
电解原理的应用
第四章 化学反应与电能
氧化
反应
还原
反应
阴离子
阳离子
氧化反应
还原反应
阳极
阴极
阴离子移向______;
阳离子移向______
阳极
阴极
离子流向
反应类型
电子流向
电源____极流向____极
____极流向电源____极
负
阴
阳
正
e-
e-
电子导体
离子导体
电解池和原电池的比较
电解池 原电池
形成条件
电极名称
电极反应
离子移向
电子移动
能量转化
1.两个电极 2.电解质溶液
3.闭合回路 4.直流电源
1.两个电极 2.电解质溶液
3.闭合回路 4.氧化还原反应
(自发)
阳极、阴极
正极、负极
阳极-氧化反应
阴极-还原反应
负极--氧化反应
正极--还原反应
阳离子-阴极
阴离子-阳极
阳离子--正极
阴离子--负极
负极--阴极
阳极--正极
负极-导线-正极
注.氧化还原反应(可自发可非自发)
化学 能转变为 电 能
电 能转变为 化学 能
一、氯碱工业
+
-
Cl2
H2
Na+
淡盐水
NaOH溶液
饱和NaCl溶液
阳离子交换膜
阳 极
阴 极
饱和NaCl溶液
稀NaOH溶液
浓NaOH溶液
二、电镀
阳极:
阴极:
Cu2++2e-=Cu
Cu-2e-=Cu2+
如果想在铁制品上镀铜,利用电解原理,该如何设计实验?
电极反应:
阳极
阴极
溶液
CuSO4
电源?
总反应呢?
没有
实验结果:
在铁制品上镀了一层铜
换塑料片,能镀铜吗?
塑料不导电
e-
二、电镀
阴极
镀件
CuSO4溶液
阳极
+
-
铜
Cu2+
SO42-
e-
Cu2++2e-=Cu
Cu-2e-=Cu2+
思考:电解一段时间后,Cu2+的浓度有何变化?
不变
二、电镀
阳极
阴极
溶液?
CuSO4
镀件
含镀层金属离子的盐溶液
电镀池结构
①阴极
②阳极
③电镀液:
电镀的特点:
一多, 一少, 一不变。
---镀层金属
---待镀金属
含镀层金属阳离子的盐溶液
如Cr、Zn、Ag、Cu等。
阴极
阳极
电镀液
镀层金属
【例1】利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-=Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
C
思考:工业上制备的铜,其含Cu约98.5%,还含有Fe、Ag、Au等杂质,为粗铜,需要通过再次精炼处理才能得到纯度为99.99%精铜(用于电器及其他很多工),如何用电解的方法得到纯铜?
粗铜
精铜
三、电解精炼
(1)粗铜 含杂质(Zn Fe Ni Ag Au 等)
(2)粗铜的精炼模型
阳极:
阴极:
电解液:
粗铜
纯铜
CuSO4溶液
+
纯铜
粗铜
-
CuSO4溶液
【思考】通电后,阳极和阴极上的金属微粒发生了哪些变化?
---不活泼金属: Au、Ag
提炼金、银等贵重金属。
问:电解完后,电解质溶液有何变化?
①电解质溶液的Cu2+浓度减小,不断补充CuSO4溶液
②引入了Zn2+、Fe2+、Ni2+等杂质,需定时除去
【例2】粗铜中含有杂质,用下图装置精炼铜。下列有关说法正确的是( )
A、a 是粗铜、b 是纯铜
B、反应前后CuSO4 电解液的浓度保持不变
C、阴极电极反应为:Cu2++2e-=Cu
D、电解过程中,a、b两极质量的变化量一直相等
C
【例3】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A、阳极发生还原反应,其电极反应式:Ni2+ + 2e- = Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
D
四、电冶金
使矿石中的金属离子获得电子变成金属单质的过程
金属冶炼:
得电子,被还原
Mn+ M
+ne-
正价
0价
K Ca Na Mg Al︱Zn Fe Sn Pb (H) Cu ︱ Hg Ag ︱Pt Au
电解法
热还原法
热分解法
富集法
通常极难被还原的活泼金属从它们的化合物中还原出来
(1)金属钠
电解熔融的氯化钠
阳极:
2Cl- -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
总方程式 阳极、阴极反应式
冶炼钠 2NaCl(熔融) 2Na+Cl2↑ 2Cl--2e-= Cl2↑
2Na++2e-= 2Na
冶炼镁 MgCl2(熔融) Mg+Cl2↑ 2Cl--2e-= Cl2↑
Mg2++2e-= Mg
冶炼铝 2Al2O3(熔融) 4Al+3O2↑ 6O2--12e-= 3O2↑
4Al3++12e-= 4Al
(2)应用
制取一些活泼金属单质
注意:冰晶石(六氟合铝酸钠Na3AlF6)作为助熔剂,降低Al2O3的熔点
【例4】下列可被工业上采用的冶金方法是( )
A.电解氯化钠溶液制钠 B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝 D.高温下用一氧化碳还原氧化铁制铁
BD
【例5】污水处理——含氰废水处理
废水处理装置示意图
OH-
N2
-3 0
CN- N2
思考1:废水处理时, N2在哪个电极产生?
+2 -3
某厂电镀废水中含有毒性较大的CN-,可在碱性条件下用电解法将其转变为N2
思考2:书写阴极区发生的电极反应,并分析阴离子交换膜的作用?
负离子交换膜
NaOH溶液
氧化反应
+ -
2CN-+ 12OH--10e- 2CO32-+N2+6H2O
2H2O + 2e- === H2 +2OH-
H2
