4.3 金属的腐蚀与防护(30页)课件 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3 金属的腐蚀与防护(30页)课件 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 41.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-04 00:00:00 | ||
图片预览









文档简介
(共30张PPT)
金属的腐蚀与防护
第四章 化学反应与电能
1.认识金属腐蚀的危害,能利用原电池原理解释电化学腐蚀的原因。
2.能正确书写析氢腐蚀和吸氧腐蚀的电极反应式和总反应式。
3.了解金属腐蚀的防护方法。
经济
据统计,我国每年因金属腐蚀而造成的损失
约占国民生产总值的3%~5%,远远超过各
项大灾损失的总和。
安全
腐蚀不仅造成经济损失,也常造成安全
事故。如油管因裂缝而漏油,引起着火
爆炸;桥梁因钢梁产生裂缝而塌陷等。
了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要意义。
一、金属腐蚀
1.定义:金属或合金与周围的气体或液体物质发生氧化还原反应而
引起损耗的现象。
2.本质:M-ne-→Mn+
如Fe →Fe2O3 xH2O Cu→Cu2(OH)2 CO3
金属腐蚀
化学腐蚀:
电化学腐蚀:
金属跟其表面接触到的一些物质直接反应
不纯的金属与电解质溶液接触时会发生原电池反应,较活泼的金属发生氧化反应而被腐蚀
无电流产生
有微弱电流产生
化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍
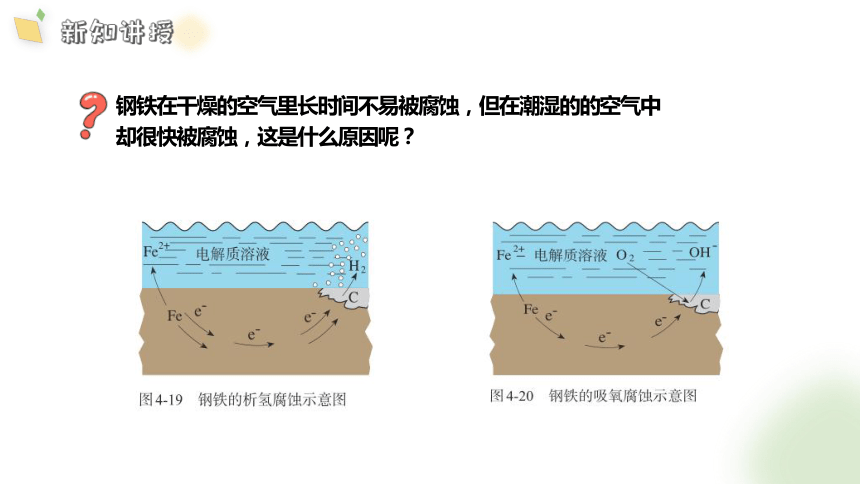
钢铁在干燥的空气里长时间不易被腐蚀,但在潮湿的的空气中
却很快被腐蚀,这是什么原因呢?
酸性环境
Fe + 2H+ =Fe2+ + H2↑
总反应:
2H++ 2e- =H2 ↑
正极:
负极:
Fe - 2e- = Fe2+
C正极材料
Fe负极材料
负极反应物
酸性较强水膜或电解质溶液
H+
钢铁析氢腐蚀
酸性很弱或中性环境
酸性很弱或中性的电解质溶液
负极材料
负极反应物
正极材料
正极反应物
2Fe - 4e- = 2Fe2+
负极:
O2 + 2H2O + 4e-= 4OH-
正极:
2Fe+ O2+2H2O =2Fe(OH)2
总反应:
4Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O
钢铁吸氧腐蚀
进一步反应:(记下来)
白色变为灰绿色,后迅速变为红褐色
铁锈的主要成分
条件 析氢腐蚀 水膜呈酸性(PH<4),且酸性较强 吸氧腐蚀
水膜呈中性或酸性很弱
电极 反应 负极(Fe) 正极(Cu或C ) Fe -2e- = Fe2+ 2H+ + 2e- = H2↑ 2Fe - 4e- = 2Fe2+
O2 + 2H2O + 4e- = 4OH-
总反应 Fe + 2H+ = Fe2++ H2↑ 2Fe+2H2O+O2= 2 Fe(OH)2
生成铁锈的反应 4Fe(OH)2+2H2O+O2= 4Fe(OH)3 2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O 联系 通常两种腐蚀同时存在,但吸氧腐蚀更普遍,且负极反应相同 Fe2O3 · nH2O
【微点拨】通常情况下,潮湿空气中水膜酸性较弱,发生的主要是吸氧腐蚀
氯化铵溶液(呈酸性)
若为碱性环境,仍发生吸氧腐蚀,负极:Fe -2e-+2OH- =Fe(OH)2
判断方法:①看环境
②只有氢前金属才会发生析氢腐蚀,氢前和氢后金属都会发生吸氧腐蚀
【实验4-3】
(1)将经过酸洗除锈的铁钉用饱和食盐水浸泡一下,
放入图 4-21 所示的具支试管中。几分钟后,观察导管中水
柱的变化,解释引起这种变化的原因。
(2)取两支试管,分别放入两颗锌粒和等体积、等浓
度的稀盐酸,观察现象。然后,向其中一支试管中滴加 1~2
滴硫酸铜溶液,再观察现象。解释产生不同现象的原因。
吸氧腐蚀,压强减小,
滴加硫酸铜溶液的试管产生气泡的速率快,Zn把Cu置换出来,构成原电池,加快反应速率
实验操作 实验现象 实验解释
导管中液面上升
Fe-C-NaCl构成原电池,铁钉发生吸氧腐蚀,导致压强变小
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,Zn-Cu-稀盐酸构成原电池,形成电化学腐蚀,加快反应速率
1.结合图像分析吸氧腐蚀
与析氢腐蚀时溶液的pH。
2. pH不同时,正极放电
物质不同的原因。
交流讨论:
酸性条件下析氢腐蚀与吸氧腐蚀同时发生;
pH在2.0~3.5时,主要发生
析氢腐蚀,pH≥4.0时主要发生吸氧腐蚀。
不同pH条件下体系压强随时间的变化情况
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H++ 2e- = H2↑
水膜酸性较弱或呈
中性,c(H+)较小
氧化性
H+吸氧腐蚀
O2+2H2O+4e-=4OH-
或O2+4H++4e-=2H2O
浓度
性质
反应
影响
决定
①钢铁发生析氢腐蚀或吸氧腐蚀时,负极Fe-2e-=Fe2+
②只有位于金属活动性顺序中氢前的金属才可能发生析氢腐蚀,
氢前和氢后的金属都可发生吸氧腐蚀。
二、金属防护
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成性能优异的合金
把铬、镍等加入普通钢中制成不锈钢
钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
2.在金属表面覆盖保护层
汽车表面喷涂油漆
覆盖搪瓷
塑料包裹
电镀
钢铁进行发蓝处理
钝化处理等等
思考与讨论
常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损时,请分析并说明白铁皮、马口铁的腐蚀情况
金属活泼性:Zn > Fe > Sn
白铁皮:锌为负极,铁为正极被保护
马口铁:锡为正极,铁为负极腐蚀加快
白铁皮
负极:2Zn – 4e- = 2Zn2+
正极:O2 + 4e- + 2H2O = 4OH-
总反应: 2Zn +O2 + 2H2O = 2Zn(OH)2
牺牲锌保护铁
马口铁
负极:2Fe – 4e- = 2Fe2+
正极:O2 + 4e- + 2H2O = 4OH-
总反应: 2Fe +O2 + 2H2O = 2Fe(OH)2
牺牲铁保护锡
3、电化学防护:
①牺牲阳极法——原电池原理
负极:更活泼金属
正极:被保护的金属
应用:锅炉内壁、船舶外壳安装镁合金或锌块
实验装置 电流表 阳极 阴极
现象
有关反应 ——
Zn-2e- = Zn2+
2H++2e- = H2↑
偏转
锌片逐渐溶解
有气泡产生,无蓝色沉淀
Fe2+的检验:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。这是检验溶液中Fe2+的常用方法。
实验现象 实验解释及结论
锌片逐渐溶解, 铁钉附近溶液变红
锌作负极:Zn-2e- = Zn2+
铁作正极:O2+2H2O+4e- =4OH-
铁作正极,不反应,被保护。
铜丝周围变红,铁钉逐渐溶解,铁钉附近溶液有蓝色沉淀生成
铁作负极:Fe-2e- = Fe2+
铜作正极:O2 +2H2O+4e- =4OH-
铁作负极,被腐蚀。
3、电化学防护:①牺牲阳极法——原电池原理
3、电化学防护:②外加电流法——电解池原理
①原理——电解池原理:
阴极:被保护金属
阳极:惰性电极作辅助阳极
海水
钢闸门
e
e
-
-
-
-
-
-
-
-
-
-
被保护的阴极
辅助阳极
不溶性
②应用:该法常用来保护土壤、海水中的金属设备。
方法 牺牲阳极保护法 外加电流保护法
原理 原电池原理 电解原理
被保护金属 正极(阴极) 阴极
构成 被保护金属、比被保护金属活泼的金属 被保护金属、惰性电极及直流电源
优、缺点 无需外加电源,但需要定期更换被腐蚀的金属 无需更换金属,但消耗电能
应用 一些钢铁设备如锅炉内壁、船体外壳等装上镁合金或锌块 土壤、海水及水中的金属设备
课堂小结
1、下图各烧杯中盛有稀盐酸,铁在其中被腐蚀由快到慢的顺序是怎样的?
①
②
③
④
⑤
⑥
电解池的阳极
原电池的负极
化学腐蚀
原电池的正极
电解池的阴极
>
>
>
>
金属活动性差别越大,活泼性强的金属腐蚀越快
牺牲阳极法
外加电流法
腐蚀由快到慢:①②③④⑤⑥
金属活动性顺序:Zn>Fe>Sn>Cu
防腐措施由好到坏的顺序是:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀>原电池的负极>电解池的阳极
2.下列各种镀有金属保护层的铁板,镀层破损后在相同的环境中,铁板最易被腐蚀的是 ( )
A.镀锌铁(白铁) B.镀锡铁(马口铁)
C.镀铜铁 D.镀银铁
D
解析:镀有金属保护层的铁板,在镀层破损时,与周围环境形成原电池。
A中镀层破损时,锌作负极,铁作正极受到保护;
B、C、D中镀层破损时,铁均作负极而被腐蚀,且负极与正极金属的活动性相差越大,负极被腐蚀的速率越快,
3.“暖宝宝”主要成分有铁粉、水、食盐、活性炭、吸水性树脂等,工作时利用微孔透氧技术反应发热。下列说法错误的是 ( )
A.发热时铁粉发生了吸氧腐蚀
B.食盐作电解质,活性炭为正极
C.工作时,吸水性树脂可供水
D.暖宝宝可以重复使用
D
4、 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化如图 1 所示。下列说法错误的是( ) 。
A. 0 ~ t1 时,铁可能发生了析氢腐蚀
B. 铁粉发生的反应为: Fe - 3e = Fe3+
C. t1 ~ t2 时,铁一定发生了吸氧腐蚀
D. 碳粉上发生了还原反应
B
5 、“雪龙 2”号从深圳启航,执行中国第 36 次南极考察任务。下列有关科考船的说 法正确的是( ) 。
A. 外壳镶嵌一些铅块可提高科考船的抗腐蚀能力
B. 停靠期间可将电源正极与船体相连保护船体
C. 利用牺牲阳极的阴极保护法保护船体时,正极:O2 + 2H2O + 4e = 4OH-
D. 科考船只采用电化学保护法提高船体抗腐蚀能力
C
金属的腐蚀与防护
金属的腐蚀
金属的防护
定义
本质
分类
电化学腐蚀
化学腐蚀
吸氧腐蚀
析氢腐蚀
无电流产生
牺牲阳极法
外加电流法
改变金属内部组织结构
在金属表面覆盖防护层
被保护金属作原电池正极
被保护金属作电解池阴极
制成合金等
涂油漆、电镀等
金属的腐蚀与防护
第四章 化学反应与电能
1.认识金属腐蚀的危害,能利用原电池原理解释电化学腐蚀的原因。
2.能正确书写析氢腐蚀和吸氧腐蚀的电极反应式和总反应式。
3.了解金属腐蚀的防护方法。
经济
据统计,我国每年因金属腐蚀而造成的损失
约占国民生产总值的3%~5%,远远超过各
项大灾损失的总和。
安全
腐蚀不仅造成经济损失,也常造成安全
事故。如油管因裂缝而漏油,引起着火
爆炸;桥梁因钢梁产生裂缝而塌陷等。
了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要意义。
一、金属腐蚀
1.定义:金属或合金与周围的气体或液体物质发生氧化还原反应而
引起损耗的现象。
2.本质:M-ne-→Mn+
如Fe →Fe2O3 xH2O Cu→Cu2(OH)2 CO3
金属腐蚀
化学腐蚀:
电化学腐蚀:
金属跟其表面接触到的一些物质直接反应
不纯的金属与电解质溶液接触时会发生原电池反应,较活泼的金属发生氧化反应而被腐蚀
无电流产生
有微弱电流产生
化学腐蚀和电化学腐蚀同时发生,但电化学腐蚀更普遍
钢铁在干燥的空气里长时间不易被腐蚀,但在潮湿的的空气中
却很快被腐蚀,这是什么原因呢?
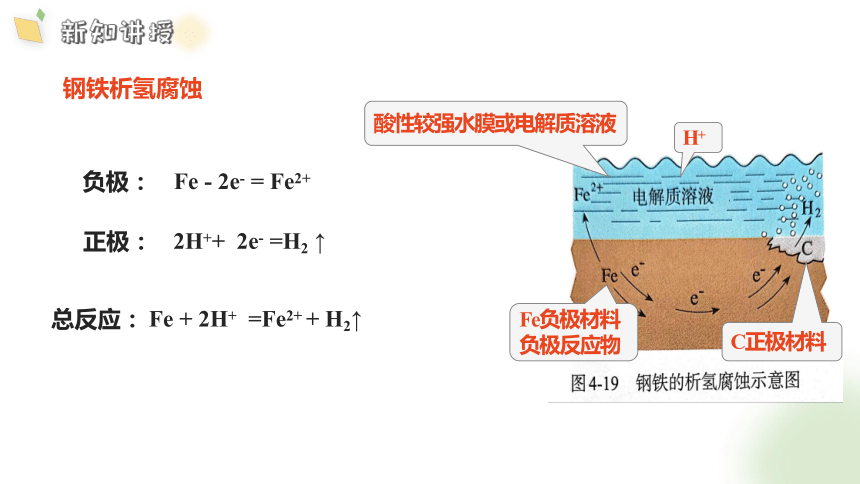
酸性环境
Fe + 2H+ =Fe2+ + H2↑
总反应:
2H++ 2e- =H2 ↑
正极:
负极:
Fe - 2e- = Fe2+
C正极材料
Fe负极材料
负极反应物
酸性较强水膜或电解质溶液
H+
钢铁析氢腐蚀
酸性很弱或中性环境
酸性很弱或中性的电解质溶液
负极材料
负极反应物
正极材料
正极反应物
2Fe - 4e- = 2Fe2+
负极:
O2 + 2H2O + 4e-= 4OH-
正极:
2Fe+ O2+2H2O =2Fe(OH)2
总反应:
4Fe(OH)2 +O2 + 2H2O = 4 Fe(OH)3
2Fe(OH)3=Fe2O3·nH2O+(3-n) H2O
钢铁吸氧腐蚀
进一步反应:(记下来)
白色变为灰绿色,后迅速变为红褐色
铁锈的主要成分
条件 析氢腐蚀 水膜呈酸性(PH<4),且酸性较强 吸氧腐蚀
水膜呈中性或酸性很弱
电极 反应 负极(Fe) 正极(Cu或C ) Fe -2e- = Fe2+ 2H+ + 2e- = H2↑ 2Fe - 4e- = 2Fe2+
O2 + 2H2O + 4e- = 4OH-
总反应 Fe + 2H+ = Fe2++ H2↑ 2Fe+2H2O+O2= 2 Fe(OH)2
生成铁锈的反应 4Fe(OH)2+2H2O+O2= 4Fe(OH)3 2Fe(OH)3=Fe2O3·nH2O+(3-n)H2O 联系 通常两种腐蚀同时存在,但吸氧腐蚀更普遍,且负极反应相同 Fe2O3 · nH2O
【微点拨】通常情况下,潮湿空气中水膜酸性较弱,发生的主要是吸氧腐蚀
氯化铵溶液(呈酸性)
若为碱性环境,仍发生吸氧腐蚀,负极:Fe -2e-+2OH- =Fe(OH)2
判断方法:①看环境
②只有氢前金属才会发生析氢腐蚀,氢前和氢后金属都会发生吸氧腐蚀
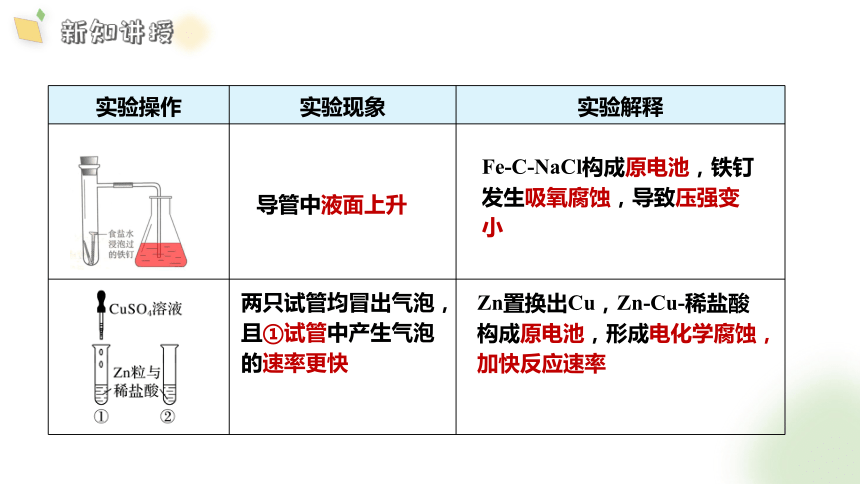
【实验4-3】
(1)将经过酸洗除锈的铁钉用饱和食盐水浸泡一下,
放入图 4-21 所示的具支试管中。几分钟后,观察导管中水
柱的变化,解释引起这种变化的原因。
(2)取两支试管,分别放入两颗锌粒和等体积、等浓
度的稀盐酸,观察现象。然后,向其中一支试管中滴加 1~2
滴硫酸铜溶液,再观察现象。解释产生不同现象的原因。
吸氧腐蚀,压强减小,
滴加硫酸铜溶液的试管产生气泡的速率快,Zn把Cu置换出来,构成原电池,加快反应速率
实验操作 实验现象 实验解释
导管中液面上升
Fe-C-NaCl构成原电池,铁钉发生吸氧腐蚀,导致压强变小
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,Zn-Cu-稀盐酸构成原电池,形成电化学腐蚀,加快反应速率
1.结合图像分析吸氧腐蚀
与析氢腐蚀时溶液的pH。
2. pH不同时,正极放电
物质不同的原因。
交流讨论:
酸性条件下析氢腐蚀与吸氧腐蚀同时发生;
pH在2.0~3.5时,主要发生
析氢腐蚀,pH≥4.0时主要发生吸氧腐蚀。
不同pH条件下体系压强随时间的变化情况
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H++ 2e- = H2↑
水膜酸性较弱或呈
中性,c(H+)较小
氧化性
H+
O2+2H2O+4e-=4OH-
或O2+4H++4e-=2H2O
浓度
性质
反应
影响
决定
①钢铁发生析氢腐蚀或吸氧腐蚀时,负极Fe-2e-=Fe2+
②只有位于金属活动性顺序中氢前的金属才可能发生析氢腐蚀,
氢前和氢后的金属都可发生吸氧腐蚀。
二、金属防护
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成性能优异的合金
把铬、镍等加入普通钢中制成不锈钢
钛合金不仅具有优异的抗腐蚀性,还具有良好的生物相容性。
2.在金属表面覆盖保护层
汽车表面喷涂油漆
覆盖搪瓷
塑料包裹
电镀
钢铁进行发蓝处理
钝化处理等等
思考与讨论
常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损时,请分析并说明白铁皮、马口铁的腐蚀情况
金属活泼性:Zn > Fe > Sn
白铁皮:锌为负极,铁为正极被保护
马口铁:锡为正极,铁为负极腐蚀加快
白铁皮
负极:2Zn – 4e- = 2Zn2+
正极:O2 + 4e- + 2H2O = 4OH-
总反应: 2Zn +O2 + 2H2O = 2Zn(OH)2
牺牲锌保护铁
马口铁
负极:2Fe – 4e- = 2Fe2+
正极:O2 + 4e- + 2H2O = 4OH-
总反应: 2Fe +O2 + 2H2O = 2Fe(OH)2
牺牲铁保护锡
3、电化学防护:
①牺牲阳极法——原电池原理
负极:更活泼金属
正极:被保护的金属
应用:锅炉内壁、船舶外壳安装镁合金或锌块
实验装置 电流表 阳极 阴极
现象
有关反应 ——
Zn-2e- = Zn2+
2H++2e- = H2↑
偏转
锌片逐渐溶解
有气泡产生,无蓝色沉淀
Fe2+的检验:Fe2+与K3[Fe(CN)6]溶液(黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。这是检验溶液中Fe2+的常用方法。
实验现象 实验解释及结论
锌片逐渐溶解, 铁钉附近溶液变红
锌作负极:Zn-2e- = Zn2+
铁作正极:O2+2H2O+4e- =4OH-
铁作正极,不反应,被保护。
铜丝周围变红,铁钉逐渐溶解,铁钉附近溶液有蓝色沉淀生成
铁作负极:Fe-2e- = Fe2+
铜作正极:O2 +2H2O+4e- =4OH-
铁作负极,被腐蚀。
3、电化学防护:①牺牲阳极法——原电池原理
3、电化学防护:②外加电流法——电解池原理
①原理——电解池原理:
阴极:被保护金属
阳极:惰性电极作辅助阳极
海水
钢闸门
e
e
-
-
-
-
-
-
-
-
-
-
被保护的阴极
辅助阳极
不溶性
②应用:该法常用来保护土壤、海水中的金属设备。
方法 牺牲阳极保护法 外加电流保护法
原理 原电池原理 电解原理
被保护金属 正极(阴极) 阴极
构成 被保护金属、比被保护金属活泼的金属 被保护金属、惰性电极及直流电源
优、缺点 无需外加电源,但需要定期更换被腐蚀的金属 无需更换金属,但消耗电能
应用 一些钢铁设备如锅炉内壁、船体外壳等装上镁合金或锌块 土壤、海水及水中的金属设备
课堂小结
1、下图各烧杯中盛有稀盐酸,铁在其中被腐蚀由快到慢的顺序是怎样的?
①
②
③
④
⑤
⑥
电解池的阳极
原电池的负极
化学腐蚀
原电池的正极
电解池的阴极
>
>
>
>
金属活动性差别越大,活泼性强的金属腐蚀越快
牺牲阳极法
外加电流法
腐蚀由快到慢:①②③④⑤⑥
金属活动性顺序:Zn>Fe>Sn>Cu
防腐措施由好到坏的顺序是:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀>原电池的负极>电解池的阳极
2.下列各种镀有金属保护层的铁板,镀层破损后在相同的环境中,铁板最易被腐蚀的是 ( )
A.镀锌铁(白铁) B.镀锡铁(马口铁)
C.镀铜铁 D.镀银铁
D
解析:镀有金属保护层的铁板,在镀层破损时,与周围环境形成原电池。
A中镀层破损时,锌作负极,铁作正极受到保护;
B、C、D中镀层破损时,铁均作负极而被腐蚀,且负极与正极金属的活动性相差越大,负极被腐蚀的速率越快,
3.“暖宝宝”主要成分有铁粉、水、食盐、活性炭、吸水性树脂等,工作时利用微孔透氧技术反应发热。下列说法错误的是 ( )
A.发热时铁粉发生了吸氧腐蚀
B.食盐作电解质,活性炭为正极
C.工作时,吸水性树脂可供水
D.暖宝宝可以重复使用
D
4、 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化如图 1 所示。下列说法错误的是( ) 。
A. 0 ~ t1 时,铁可能发生了析氢腐蚀
B. 铁粉发生的反应为: Fe - 3e = Fe3+
C. t1 ~ t2 时,铁一定发生了吸氧腐蚀
D. 碳粉上发生了还原反应
B
5 、“雪龙 2”号从深圳启航,执行中国第 36 次南极考察任务。下列有关科考船的说 法正确的是( ) 。
A. 外壳镶嵌一些铅块可提高科考船的抗腐蚀能力
B. 停靠期间可将电源正极与船体相连保护船体
C. 利用牺牲阳极的阴极保护法保护船体时,正极:O2 + 2H2O + 4e = 4OH-
D. 科考船只采用电化学保护法提高船体抗腐蚀能力
C
金属的腐蚀与防护
金属的腐蚀
金属的防护
定义
本质
分类
电化学腐蚀
化学腐蚀
吸氧腐蚀
析氢腐蚀
无电流产生
牺牲阳极法
外加电流法
改变金属内部组织结构
在金属表面覆盖防护层
被保护金属作原电池正极
被保护金属作电解池阴极
制成合金等
涂油漆、电镀等
