4.2 课时1 电解原理(25页 )课件 2024-2025学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 课时1 电解原理(25页 )课件 2024-2025学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 147.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-04 14:47:36 | ||
图片预览






文档简介
(共25张PPT)
电解原理
第四章 化学反应与电能
1.以电解氯化铜为例,分析理解电解池的工作原理。
2.会判断离子的放电顺序,会书写其电极反应式。
3.认识电解在实现物质转化和储存能量中的具体应用,可以应用电解的知识分析解决新型电解池。
使用时:
化学能转化为电能
充电时:
电能转化为化学能
任务一:电解池的工作原理
复习回忆:在通电条件下水分解生成氧气和氢气
进一步探究电解的原理
实验探究
用石墨电极电解CuCl2溶液
任务一:电解池的工作原理
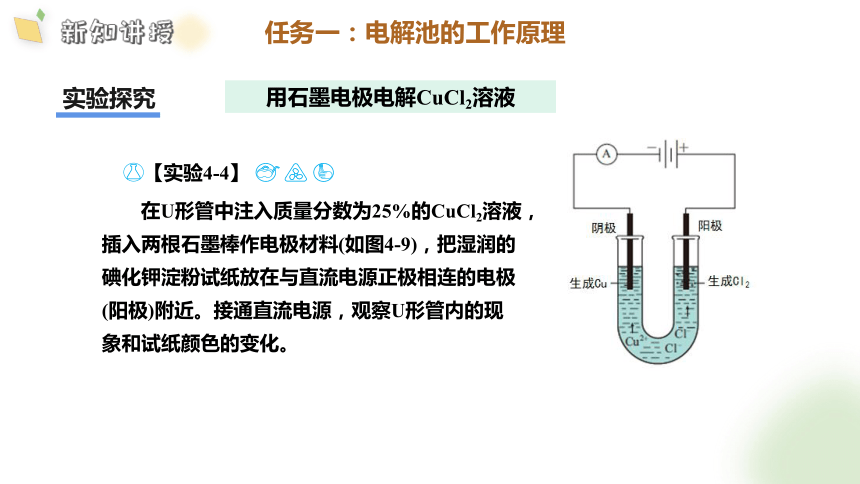
【实验4-4】
在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨棒作电极材料(如图4-9),把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
任务一:电解池的工作原理
任务一:电解池的工作原理
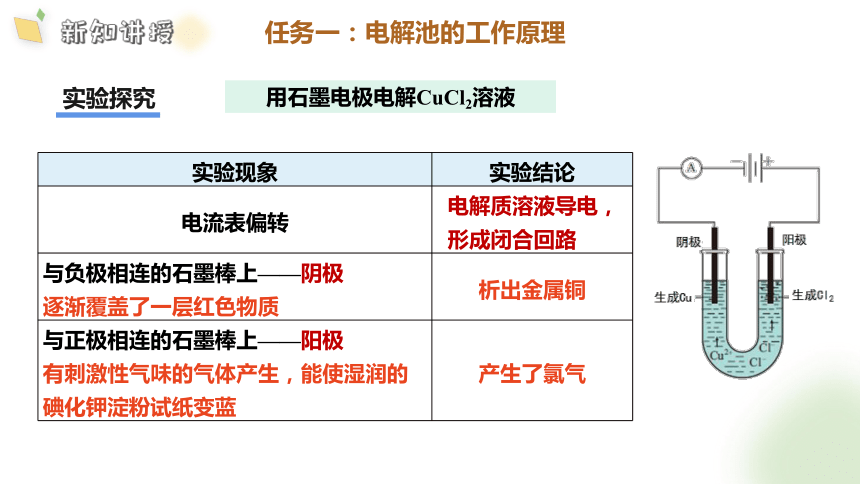
实验探究
用石墨电极电解CuCl2溶液
实验现象 实验结论
电流表偏转 电解质溶液导电,
形成闭合回路
与负极相连的石墨棒上——阴极 逐渐覆盖了一层红色物质 析出金属铜
与正极相连的石墨棒上——阳极 有刺激性气味的气体产生,能使湿润的碘化钾淀粉试纸变蓝 产生了氯气
思考探究
(1)通电前,CuCl2溶液中存在哪些离子?
(2)通电后,溶液中Cl-的移动方向?
阳极电极反应式及反应类型?(“氧化反应”或“还原反应”,下同)
(3)通电后,溶液中Cu2+的移动方向?
阴极反应式及反应类型?
(4)在CuCl2溶液中除了Cu2+和Cl-之外
还有H+和OH-,这两种离子为什么没得到或失去电子?
任务一:电解池的工作原理
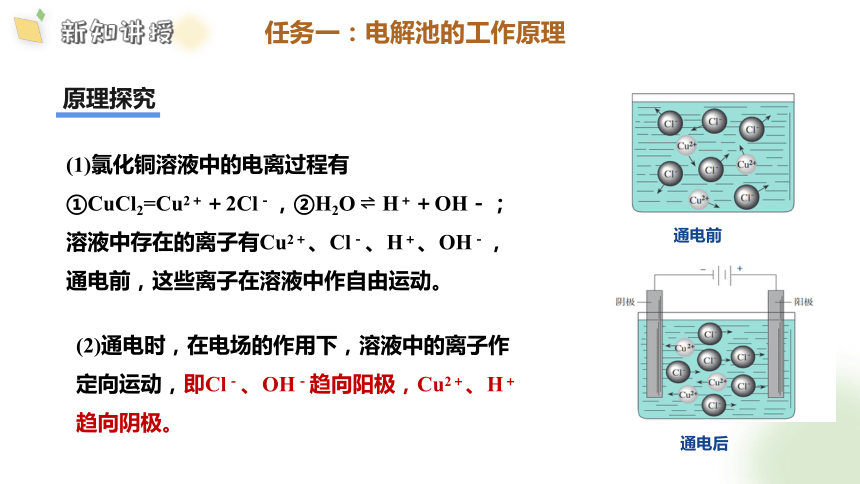
(1)氯化铜溶液中的电离过程有
①CuCl2=Cu2++2Cl-,②H2O H++OH-;
溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前,这些离子在溶液中作自由运动。
通电前
通电后
(2)通电时,在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-趋向阳极,Cu2+、H+趋向阴极。
原理探究
任务一:电解池的工作原理
原理探究
--
阴极:Cu2++ 2e- = Cu(还原反应)
Cu2+ > H+
放电顺序
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
放电顺序
Cl- > OH-
总反应:Cu2+ + 2Cl- === Cu + Cl2↑
在两极上发生氧化还原反应,这个过程叫做放电。
任务一:电解池的工作原理
将电能转化为化学能的装置
1
电解池(电解槽):
2
构成条件:
阴极:与电源负极相连
阳极:与电源正极相连
①直流电源
②电极
③离子导体:电解质溶液或熔融电解质
④形成闭合回路
一、电解原理
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
任务一:电解池的工作原理
一、电解原理
电子流向:
阴
极
阳
极
e-
e-
H+
Cu2+
由负极流出,流向阴极;
由阳极流出,流回正极。
电流流向:
与电子流向相反。
离子流向:
阳离子移向阴极,
阴离子移向阳极。
Cl- OH-
3
三大流向:
任务一:电解池的工作原理
氧化
反应
还原
反应
阴离子
阳离子
氧化反应
还原反应
阳极
阴极
阴离子移向______;
阳离子移向______
阳极
阴极
离子流向
反应类型
电子流向
电源____极流向____极
____极流向电源____极
负
阴
阳
正
e-
e-
电子导体
离子导体
电解池中阳极、阴极的判断
①电子流向:
电源负极→阴极,阳极→电源正极
②离子移动方向:
阳离子移向阴极,阴离子移向阳极
③电流闭合:
电源正极→阳极→溶液→阴极→电源负极
(1)电解时必须使用直流电源,不能使用交流电源。
(2)常见的惰性电极指石墨、铂(Pt)、金(Au),活性电极是指金属活动性顺序中Ag和Ag之前的金属。
(3)电解过程是化学变化,而金属的导电是物理变化;
书写电解总反应式要注明“电解”或“通电”这一反应条件。
(4)原电池装置和电解池装置的最大区别是看有无外接直流电源,有外接直流电源的是电解池。
【注意事项】
【例1】如图所示装置中属于电解池的是_______(填序号)。
③⑥
任务二:电极反应式书写
1、阴极:阳离子先得电子
2、阳极:活泼金属(Pt前)或者阴离子失电子
Ag+>Hg2+>Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)
>Al3+>Mg2+>Na+>Ca2+>K+
仅在熔融状态下考虑
水溶液中不考虑
【例2】写出下列装置的电极反应式
阴极:
2H2O- 4e- = O2↑+4H+
阳极:
总反应:
2Cu2++ 4e- = 2Cu
【思考】书写电极反应式的一般思路?
电极反应式书写的一般思路
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原分析得出产物
①判断电极材料
⑤ 阴极+阳极反应式 = 总反应式
任务二:电极反应式书写
【例3】写出用石墨做电极电解CuSO4溶液的电极反应式及总电解方程式
阴极:
阳极:
③两极反应式相加得总方程式
2H2O -4eˉ =O2↑+4H+
2Cu2++4eˉ =2Cu
OH->SO42ˉ
H+ < Cu2+
①首先分析、比较出阴阳极的放电离子
②然后写电极反应式 :
电解
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
电解
2Cu+O2↑+4H+
2Cu2++2H2O
阴极:
阳极:
来自弱电解质的离子用分子形式表示,否则仍写成离子。
1、如图,电解质溶液是NaCl的水溶液,经过一段时间发现d极附近有黄绿色气体产生,以下说法正确的是( )
A.a是电源的正极
B.电子流动的方向:d→b
C.c极发生氧化反应
D.如果将c、d两电极互换,则c上也一定会生成黄绿色气体
B
2、为使反应Cu+2H2O=Cu(OH)2↓+H2↑能够发生,下列设计方案正确的是( )
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
C
3、不同电极电解NaCl溶液,电极反应式如何书写?
已知:氧化性Cu2+ > H+ > Na+;还原性Cl- > OH-
阳极 (C) :2Cl--2e-===Cl2↑
阴极 (Fe):2H+ + 2e-===H2↑
阳极(Fe):Fe-2e- ===Fe2+
阴极 (C):2H+ +2e-===H2↑
4.根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
电解原理
第四章 化学反应与电能
1.以电解氯化铜为例,分析理解电解池的工作原理。
2.会判断离子的放电顺序,会书写其电极反应式。
3.认识电解在实现物质转化和储存能量中的具体应用,可以应用电解的知识分析解决新型电解池。
使用时:
化学能转化为电能
充电时:
电能转化为化学能
任务一:电解池的工作原理
复习回忆:在通电条件下水分解生成氧气和氢气
进一步探究电解的原理
实验探究
用石墨电极电解CuCl2溶液
任务一:电解池的工作原理
【实验4-4】
在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨棒作电极材料(如图4-9),把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
任务一:电解池的工作原理
任务一:电解池的工作原理
实验探究
用石墨电极电解CuCl2溶液
实验现象 实验结论
电流表偏转 电解质溶液导电,
形成闭合回路
与负极相连的石墨棒上——阴极 逐渐覆盖了一层红色物质 析出金属铜
与正极相连的石墨棒上——阳极 有刺激性气味的气体产生,能使湿润的碘化钾淀粉试纸变蓝 产生了氯气
思考探究
(1)通电前,CuCl2溶液中存在哪些离子?
(2)通电后,溶液中Cl-的移动方向?
阳极电极反应式及反应类型?(“氧化反应”或“还原反应”,下同)
(3)通电后,溶液中Cu2+的移动方向?
阴极反应式及反应类型?
(4)在CuCl2溶液中除了Cu2+和Cl-之外
还有H+和OH-,这两种离子为什么没得到或失去电子?
任务一:电解池的工作原理
(1)氯化铜溶液中的电离过程有
①CuCl2=Cu2++2Cl-,②H2O H++OH-;
溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前,这些离子在溶液中作自由运动。
通电前
通电后
(2)通电时,在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-趋向阳极,Cu2+、H+趋向阴极。
原理探究
任务一:电解池的工作原理
原理探究
--
阴极:Cu2++ 2e- = Cu(还原反应)
Cu2+ > H+
放电顺序
阳极:2Cl- - 2e- = Cl2↑(氧化反应)
放电顺序
Cl- > OH-
总反应:Cu2+ + 2Cl- === Cu + Cl2↑
在两极上发生氧化还原反应,这个过程叫做放电。
任务一:电解池的工作原理
将电能转化为化学能的装置
1
电解池(电解槽):
2
构成条件:
阴极:与电源负极相连
阳极:与电源正极相连
①直流电源
②电极
③离子导体:电解质溶液或熔融电解质
④形成闭合回路
一、电解原理
惰性电极:C、Pt、Au等
活性电极:Fe、Cu、Ag等
任务一:电解池的工作原理
一、电解原理
电子流向:
阴
极
阳
极
e-
e-
H+
Cu2+
由负极流出,流向阴极;
由阳极流出,流回正极。
电流流向:
与电子流向相反。
离子流向:
阳离子移向阴极,
阴离子移向阳极。
Cl- OH-
3
三大流向:
任务一:电解池的工作原理
氧化
反应
还原
反应
阴离子
阳离子
氧化反应
还原反应
阳极
阴极
阴离子移向______;
阳离子移向______
阳极
阴极
离子流向
反应类型
电子流向
电源____极流向____极
____极流向电源____极
负
阴
阳
正
e-
e-
电子导体
离子导体
电解池中阳极、阴极的判断
①电子流向:
电源负极→阴极,阳极→电源正极
②离子移动方向:
阳离子移向阴极,阴离子移向阳极
③电流闭合:
电源正极→阳极→溶液→阴极→电源负极
(1)电解时必须使用直流电源,不能使用交流电源。
(2)常见的惰性电极指石墨、铂(Pt)、金(Au),活性电极是指金属活动性顺序中Ag和Ag之前的金属。
(3)电解过程是化学变化,而金属的导电是物理变化;
书写电解总反应式要注明“电解”或“通电”这一反应条件。
(4)原电池装置和电解池装置的最大区别是看有无外接直流电源,有外接直流电源的是电解池。
【注意事项】
【例1】如图所示装置中属于电解池的是_______(填序号)。
③⑥
任务二:电极反应式书写
1、阴极:阳离子先得电子
2、阳极:活泼金属(Pt前)或者阴离子失电子
Ag+>Hg2+>Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)
>Al3+>Mg2+>Na+>Ca2+>K+
仅在熔融状态下考虑
水溶液中不考虑
【例2】写出下列装置的电极反应式
阴极:
2H2O- 4e- = O2↑+4H+
阳极:
总反应:
2Cu2++ 4e- = 2Cu
【思考】书写电极反应式的一般思路?
电极反应式书写的一般思路
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原分析得出产物
①判断电极材料
⑤ 阴极+阳极反应式 = 总反应式
任务二:电极反应式书写
【例3】写出用石墨做电极电解CuSO4溶液的电极反应式及总电解方程式
阴极:
阳极:
③两极反应式相加得总方程式
2H2O -4eˉ =O2↑+4H+
2Cu2++4eˉ =2Cu
OH->SO42ˉ
H+ < Cu2+
①首先分析、比较出阴阳极的放电离子
②然后写电极反应式 :
电解
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
电解
2Cu+O2↑+4H+
2Cu2++2H2O
阴极:
阳极:
来自弱电解质的离子用分子形式表示,否则仍写成离子。
1、如图,电解质溶液是NaCl的水溶液,经过一段时间发现d极附近有黄绿色气体产生,以下说法正确的是( )
A.a是电源的正极
B.电子流动的方向:d→b
C.c极发生氧化反应
D.如果将c、d两电极互换,则c上也一定会生成黄绿色气体
B
2、为使反应Cu+2H2O=Cu(OH)2↓+H2↑能够发生,下列设计方案正确的是( )
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
C
3、不同电极电解NaCl溶液,电极反应式如何书写?
已知:氧化性Cu2+ > H+ > Na+;还原性Cl- > OH-
阳极 (C) :2Cl--2e-===Cl2↑
阴极 (Fe):2H+ + 2e-===H2↑
阳极(Fe):Fe-2e- ===Fe2+
阴极 (C):2H+ +2e-===H2↑
4.根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四种电极材料和电解液中,能实现该反应最为恰当的是( )
A B C D
阳极 石墨 Cu Cu Cu
阴极 石墨 石墨 Fe Pt
电解液 CuSO4溶液 Na2SO4溶液 H2SO4溶液 H2O
B
