专题6 第三单元 第2课时 化学电源 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019)
文档属性
| 名称 | 专题6 第三单元 第2课时 化学电源 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019) |

|
|
| 格式 | docx | ||
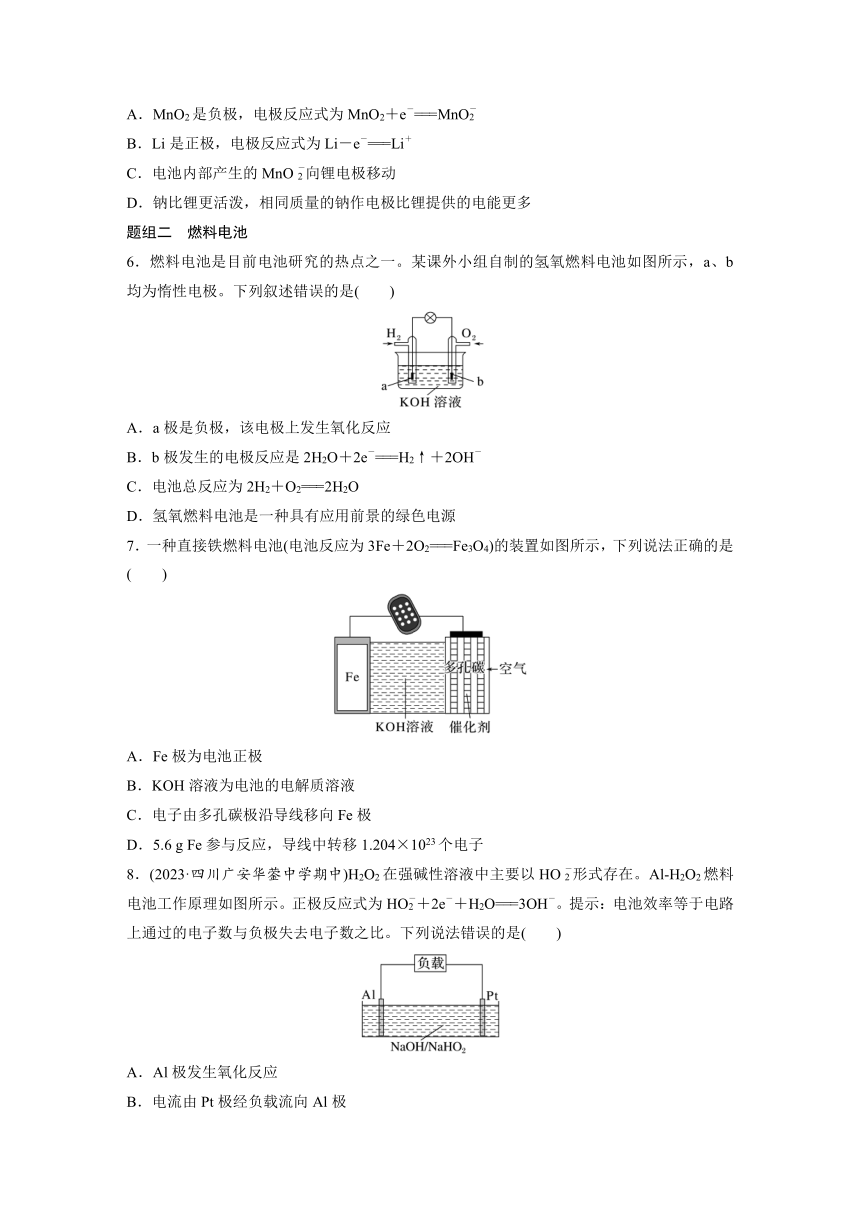
| 文件大小 | 787.0KB | ||
| 资源类型 | 教案 | ||
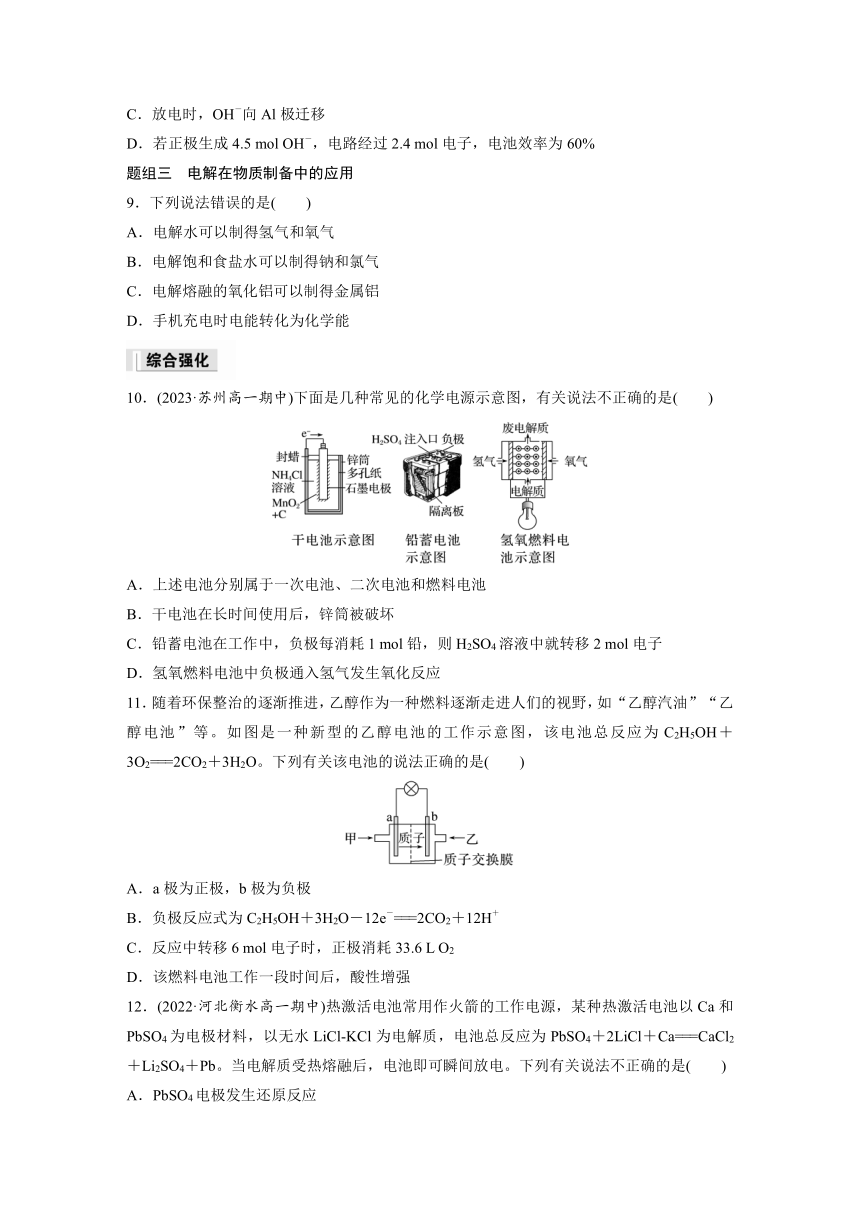
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-04 22:46:14 | ||
图片预览



文档简介
第2课时 化学电源
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2OZn(OH)2+2Ag。
下列说法不正确的是( )
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
3.铅蓄电池是一种典型的可充电电池,其放电时的电池总反应为Pb+PbO2+4H++2SO===2PbSO4+2H2O,则下列说法不正确的是( )
A.电池工作时,负极反应式:Pb-2e-===Pb2+
B.铅蓄电池是二次电池,放电时是化学能转化为电能
C.电池工作时,电子由Pb板通过导线流向PbO2板
D.电池工作时,溶液中H+移向PbO2板
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极上发生还原反应
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法中正确的是( )
A.MnO2是负极,电极反应式为MnO2+e-===MnO
B.Li是正极,电极反应式为Li-e-===Li+
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是( )
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204×1023个电子
8.(2023·四川广安华蓥中学期中)H2O2在强碱性溶液中主要以HO形式存在。Al-H2O2燃料电池工作原理如图所示。正极反应式为HO+2e-+H2O===3OH-。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,OH-向Al极迁移
D.若正极生成4.5 mol OH-,电路经过2.4 mol电子,电池效率为60%
题组三 电解在物质制备中的应用
9.下列说法错误的是( )
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
10.(2023·苏州高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则H2SO4溶液中就转移2 mol电子
D.氢氧燃料电池中负极通入氢气发生氧化反应
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是( )
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
12.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是( )
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
13.(2023·徐州高一检测)锌-空气电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== 2Zn(OH),下列有关说法正确的是( )
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
14.一种肼(N2H4)-空气碱性燃料电池工作原理如图所示(已知阴离子交换膜只允许阴离子通过)。下列说法错误的是( )
A.a为空气,b为N2H4
B.M电极为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的________(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为___________________,
电池总反应式为________________________________________________________________。
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_________________________________________________,b是______极,b电极反应式为____________________________________________________,生产过程中H+向______(填“a”或“b”)电极区域移动。
②该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1 H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为________(填“正极”或“负极”),电极c的反应式为_______________________________________________________________。
当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为________g (假设反应物耗尽,忽略气体的溶解)。
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
答案 A
解析 A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;B项,在外电路中电子从锌外壳流向石墨棒,故错误;C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;D项,电池内部,阳离子向正极石墨棒移动,故错误。
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2OZn(OH)2+2Ag。
下列说法不正确的是( )
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
答案 D
解析 Zn失电子发生氧化反应而作负极,故A正确;正极上Ag2O得电子发生还原反应,故B正确;原电池中电流从正极沿导线流向负极,该电池中Zn是负极、Ag2O是正极,所以放电时电流从Ag2O经导线流向Zn,故C正确;碱性条件下锌离子生成Zn(OH)2,所以负极电极反应式为Zn+2OH--2e-===Zn(OH)2,故D错误。
3.铅蓄电池是一种典型的可充电电池,其放电时的电池总反应为Pb+PbO2+4H++2SO===2PbSO4+2H2O,则下列说法不正确的是( )
A.电池工作时,负极反应式:Pb-2e-===Pb2+
B.铅蓄电池是二次电池,放电时是化学能转化为电能
C.电池工作时,电子由Pb板通过导线流向PbO2板
D.电池工作时,溶液中H+移向PbO2板
答案 A
解析 负极反应为Pb-2e-+SO===PbSO4,故A错误。
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极上发生还原反应
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
答案 C
解析 由电池总反应可知,Zn失去电子生成Zn(OH)2,故A正确;MnO2为原电池的正极,发生还原反应,故B正确;原电池中,电子由负极通过外电路流向正极,故C错误;负极反应为Zn-2e-+2OH-===Zn(OH)2,消耗1 mol Zn转移2 mol电子,若转移0.2 mol电子,消耗0.1 mol Zn,质量为6.5 g,故D正确。
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法中正确的是( )
A.MnO2是负极,电极反应式为MnO2+e-===MnO
B.Li是正极,电极反应式为Li-e-===Li+
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
答案 C
解析 由锂电池的总反应为Li+MnO2===LiMnO2可知Li失去电子,Li作负极,正极上MnO2得到电子,正极反应为MnO2+e-===MnO,故A错误;电池内部产生的MnO向负极即锂电极移动,故C正确;钠和锂为同主族元素,相同物质的量的Na和Li失电子数相同,Li的相对原子质量较小,则相同质量的钠作电极比锂失电子数少,提供的电能少,故D错误。
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
答案 B
解析 A项,a极通入H2,为负极,电极反应式为2H2+4OH--4e-===4H2O,发生的是氧化反应,正确;B项,b极通入O2,为正极,电极反应式为O2+2H2O+4e-===4OH-,错误;C项,正、负极电极反应式相加可得,电池总反应为2H2+O2===2H2O,正确;D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源,正确。
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是( )
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204×1023个电子
答案 B
解析 该电池中铁失去电子,为电池负极,A项错误;电子由Fe极沿导线移向多孔碳极,C项错误;根据电池反应3Fe+2O2===Fe3O4,可知,3 mol铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移1.605×1023个电子,D项错误。
8.(2023·四川广安华蓥中学期中)H2O2在强碱性溶液中主要以HO形式存在。Al-H2O2燃料电池工作原理如图所示。正极反应式为HO+2e-+H2O===3OH-。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,OH-向Al极迁移
D.若正极生成4.5 mol OH-,电路经过2.4 mol电子,电池效率为60%
答案 D
解析 观察图示知,Al-H2O2燃料电池中铝电极为负极,铂电极为正极。负极发生氧化反应,A项正确;电流由正极经外电路流向负极,B项正确;铂极为正极,铝极为负极,OH-向负极迁移,C项正确;正极反应式为HO+2e-+H2O===3OH-,n(OH-)=4.5 mol,n(e-)=3 mol,电池效率η=×100%=80%,D项错误。
题组三 电解在物质制备中的应用
9.下列说法错误的是( )
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
答案 B
解析 电解饱和食盐水得到的是NaOH、H2和Cl2,电解熔融NaCl可以得到Na和Cl2,B项错误。
10.(2023·苏州高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则H2SO4溶液中就转移2 mol电子
D.氢氧燃料电池中负极通入氢气发生氧化反应
答案 C
解析 干电池是一次电池,铅蓄电池是可充电电池,属于二次电池,氢氧燃料电池属于燃料电池,故A正确;在干电池中,Zn作负极,被氧化,故B正确;铅蓄电池工作过程中负极每消耗1 mol铅,则线路中会转移2 mol电子,硫酸中无电子转移,故C错误。
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是( )
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
答案 B
解析 依据质子(H+)向正极移动,可确定a极为负极,b极为正极,A项错误;在电池负极,C2H5OH在酸性电解质溶液中失电子,生成二氧化碳等,负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+,B项正确;正极反应式为O2+4e-+4H+===2H2O,当反应中转移6 mol电子时,正极消耗1.5 mol O2,但由于温度、压强未知,所以O2的体积不一定是33.6 L,C项错误;由电池总反应C2H5OH+3O2===2CO2+3H2O可知,该燃料电池工作一段时间后,H+的物质的量不变,但溶剂的质量增加,所以溶液的酸性减弱,D项错误。
12.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是( )
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
答案 C
解析 放电时,原电池电解质溶液中的阳离子移向正极。
13.(2023·徐州高一检测)锌-空气电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== 2Zn(OH),下列有关说法正确的是( )
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
答案 D
解析 原电池中阴离子向负极移动,故放电时电解质溶液中OH-向负极移动,A错误;没有说明是标况,不能计算氧气体积,B错误;反应在碱性条件下进行,发生OER反应的电极反应式为4OH--4e-===O2↑+2H2O,C错误;空气进入电池,氧气得到电子发生还原反应,发生ORR反应:O2+4e-+2H2O===4OH-,D正确。
14.一种肼(N2H4)-空气碱性燃料电池工作原理如图所示(已知阴离子交换膜只允许阴离子通过)。下列说法错误的是( )
A.a为空气,b为N2H4
B.M电极为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
答案 B
解析 燃料电池通入燃料的一极为负极,电子从负极流出,故 b为N2H4,A正确;此电池为碱性燃料电池,M为正极,则电极反应为O2+4e-+2H2O===4OH-,B不正确;燃料电池中,阴离子移向负极,根据得失电子守恒,有关系式e-~OH-,则电路中通过1 mol电子时,同时有1 mol OH-从左室正极区通过阴离子交换膜移到右室负极区,C正确;负极反应式为N2H4-4e-+4OH-===N2+4H2O,正极反应式为O2+4e-+2H2O===4OH-,根据得失电子守恒,N2H4~4e-~O2,当有1 mol即32 g N2H4完全反应生成N2,消耗1 mol O2,则当有16 g N2H4完全反应生成N2,消耗0.5 mol O2,标准状况下为11.2 L,D正确。
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的________(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为___________________,
电池总反应式为________________________________________________________________。
答案 (1)b 负 (2)负 流出
(3)CH4-8e-+10OH-===CO+7H2O CH4+2O2+2KOH===K2CO3+3H2O
解析 (1)氢氧燃料电池中,电子从负极向正极移动,X是负极,Y是正极,氧气应通入正极。 (2)根据电极反应可知,A极发生氧化反应,应该是电池的负极,电子从该极流出。(3)甲烷-空气燃料电池,通甲烷的一极(X)为负极,通空气的一极(Y)为正极,电池总反应式为CH4+2O2+2KOH===K2CO3+3H2O,负极反应式为CH4-8e-+10OH-===CO+7H2O。
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_________________________________________________,b是______极,b电极反应式为____________________________________________________,生产过程中H+向______(填“a”或“b”)电极区域移动。
②该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1 H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为________(填“正极”或“负极”),电极c的反应式为_______________________________________________________________。
当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为________g (假设反应物耗尽,忽略气体的溶解)。
答案 (1)①2SO2+O2+2H2O===2H2SO4 正 O2+4e-+4H+===2H2O b ②D (2)负极 CH3OH-6e-+H2O===CO2+6H+ 12
解析 (1)①根据装置图甲可知a电极通入SO2,SO2发生失去电子的氧化反应,O2从正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O===2H2SO4,b电极是正极,O2在酸性条件下得电子生成水,反应式为O2+4e-+4H+===2H2O,原电池中阳离子向正极移动,则生产过程中H+向b电极区域移动。②原电池反应的过程中一定有电子发生转移,A项错误;原电池装置不一定需要两个活泼性不同的金属电极,例如燃料电池等,B项错误;原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,C项错误;原电池中氧化反应和还原反应可以拆开在两极发生,D项正确。(2)根据装置图乙可知电子从电极c流出,则电极c是负极,电池总反应为2CH3OH+3O2===2CO2+4H2O,所以CH3OH在负极发生失去电子的氧化反应转化为CO2,则电极c的反应式为CH3OH-6e-+H2O===CO2+6H+;当转移1 mol电子时,左侧质量减轻×12 g=2 g,还有1 mol H+通过质子交换膜进入右侧,质量减少1 g,正极反应式为O2+4H++4e-===2H2O,右侧质量增加32 g×=8 g,加上转移过来的1 g H+,因此左右两侧溶液的质量之差为8 g+1 g+2 g+1 g=12 g。
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2OZn(OH)2+2Ag。
下列说法不正确的是( )
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
3.铅蓄电池是一种典型的可充电电池,其放电时的电池总反应为Pb+PbO2+4H++2SO===2PbSO4+2H2O,则下列说法不正确的是( )
A.电池工作时,负极反应式:Pb-2e-===Pb2+
B.铅蓄电池是二次电池,放电时是化学能转化为电能
C.电池工作时,电子由Pb板通过导线流向PbO2板
D.电池工作时,溶液中H+移向PbO2板
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极上发生还原反应
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法中正确的是( )
A.MnO2是负极,电极反应式为MnO2+e-===MnO
B.Li是正极,电极反应式为Li-e-===Li+
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是( )
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204×1023个电子
8.(2023·四川广安华蓥中学期中)H2O2在强碱性溶液中主要以HO形式存在。Al-H2O2燃料电池工作原理如图所示。正极反应式为HO+2e-+H2O===3OH-。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,OH-向Al极迁移
D.若正极生成4.5 mol OH-,电路经过2.4 mol电子,电池效率为60%
题组三 电解在物质制备中的应用
9.下列说法错误的是( )
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
10.(2023·苏州高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则H2SO4溶液中就转移2 mol电子
D.氢氧燃料电池中负极通入氢气发生氧化反应
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是( )
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
12.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是( )
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
13.(2023·徐州高一检测)锌-空气电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== 2Zn(OH),下列有关说法正确的是( )
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
14.一种肼(N2H4)-空气碱性燃料电池工作原理如图所示(已知阴离子交换膜只允许阴离子通过)。下列说法错误的是( )
A.a为空气,b为N2H4
B.M电极为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的________(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为___________________,
电池总反应式为________________________________________________________________。
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_________________________________________________,b是______极,b电极反应式为____________________________________________________,生产过程中H+向______(填“a”或“b”)电极区域移动。
②该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1 H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为________(填“正极”或“负极”),电极c的反应式为_______________________________________________________________。
当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为________g (假设反应物耗尽,忽略气体的溶解)。
题组一 一次电池、二次电池
1.下列有关锌锰干电池的说法正确的是( )
A.锌外壳是负极,石墨棒是正极
B.在外电路中电子从石墨棒流向锌外壳
C.电流从锌外壳流到石墨棒上
D.在电池内部阳离子从石墨棒向锌外壳移动
答案 A
解析 A项,在锌锰干电池中,锌外壳是负极,石墨棒是正极,故正确;B项,在外电路中电子从锌外壳流向石墨棒,故错误;C项,电流的方向与电子的流向相反,应从石墨棒流向锌外壳,故错误;D项,电池内部,阳离子向正极石墨棒移动,故错误。
2.银锌纽扣电池如图所示,其电池的总反应式为Zn+Ag2O+H2OZn(OH)2+2Ag。
下列说法不正确的是( )
A.锌作负极,发生氧化反应
B.正极为Ag2O,发生还原反应
C.电池工作时,电流从Ag2O经导线流向Zn
D.负极的电极反应式为Zn-2e-===Zn2+
答案 D
解析 Zn失电子发生氧化反应而作负极,故A正确;正极上Ag2O得电子发生还原反应,故B正确;原电池中电流从正极沿导线流向负极,该电池中Zn是负极、Ag2O是正极,所以放电时电流从Ag2O经导线流向Zn,故C正确;碱性条件下锌离子生成Zn(OH)2,所以负极电极反应式为Zn+2OH--2e-===Zn(OH)2,故D错误。
3.铅蓄电池是一种典型的可充电电池,其放电时的电池总反应为Pb+PbO2+4H++2SO===2PbSO4+2H2O,则下列说法不正确的是( )
A.电池工作时,负极反应式:Pb-2e-===Pb2+
B.铅蓄电池是二次电池,放电时是化学能转化为电能
C.电池工作时,电子由Pb板通过导线流向PbO2板
D.电池工作时,溶液中H+移向PbO2板
答案 A
解析 负极反应为Pb-2e-+SO===PbSO4,故A错误。
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极上发生还原反应
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
答案 C
解析 由电池总反应可知,Zn失去电子生成Zn(OH)2,故A正确;MnO2为原电池的正极,发生还原反应,故B正确;原电池中,电子由负极通过外电路流向正极,故C错误;负极反应为Zn-2e-+2OH-===Zn(OH)2,消耗1 mol Zn转移2 mol电子,若转移0.2 mol电子,消耗0.1 mol Zn,质量为6.5 g,故D正确。
5.(2022·广州高一期中)手机使用的锂电池以质量轻、能量高而备受关注,目前已成功研制出多种锂电池。某种锂电池的总反应是Li+MnO2===LiMnO2。下列说法中正确的是( )
A.MnO2是负极,电极反应式为MnO2+e-===MnO
B.Li是正极,电极反应式为Li-e-===Li+
C.电池内部产生的MnO向锂电极移动
D.钠比锂更活泼,相同质量的钠作电极比锂提供的电能更多
答案 C
解析 由锂电池的总反应为Li+MnO2===LiMnO2可知Li失去电子,Li作负极,正极上MnO2得到电子,正极反应为MnO2+e-===MnO,故A错误;电池内部产生的MnO向负极即锂电极移动,故C正确;钠和锂为同主族元素,相同物质的量的Na和Li失电子数相同,Li的相对原子质量较小,则相同质量的钠作电极比锂失电子数少,提供的电能少,故D错误。
题组二 燃料电池
6.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述错误的是( )
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是2H2O+2e-===H2↑+2OH-
C.电池总反应为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
答案 B
解析 A项,a极通入H2,为负极,电极反应式为2H2+4OH--4e-===4H2O,发生的是氧化反应,正确;B项,b极通入O2,为正极,电极反应式为O2+2H2O+4e-===4OH-,错误;C项,正、负极电极反应式相加可得,电池总反应为2H2+O2===2H2O,正确;D项,氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源,正确。
7.一种直接铁燃料电池(电池反应为3Fe+2O2===Fe3O4)的装置如图所示,下列说法正确的是( )
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6 g Fe参与反应,导线中转移1.204×1023个电子
答案 B
解析 该电池中铁失去电子,为电池负极,A项错误;电子由Fe极沿导线移向多孔碳极,C项错误;根据电池反应3Fe+2O2===Fe3O4,可知,3 mol铁参与反应时转移8 mol电子,故5.6 g Fe参与反应,导线中转移1.605×1023个电子,D项错误。
8.(2023·四川广安华蓥中学期中)H2O2在强碱性溶液中主要以HO形式存在。Al-H2O2燃料电池工作原理如图所示。正极反应式为HO+2e-+H2O===3OH-。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,OH-向Al极迁移
D.若正极生成4.5 mol OH-,电路经过2.4 mol电子,电池效率为60%
答案 D
解析 观察图示知,Al-H2O2燃料电池中铝电极为负极,铂电极为正极。负极发生氧化反应,A项正确;电流由正极经外电路流向负极,B项正确;铂极为正极,铝极为负极,OH-向负极迁移,C项正确;正极反应式为HO+2e-+H2O===3OH-,n(OH-)=4.5 mol,n(e-)=3 mol,电池效率η=×100%=80%,D项错误。
题组三 电解在物质制备中的应用
9.下列说法错误的是( )
A.电解水可以制得氢气和氧气
B.电解饱和食盐水可以制得钠和氯气
C.电解熔融的氧化铝可以制得金属铝
D.手机充电时电能转化为化学能
答案 B
解析 电解饱和食盐水得到的是NaOH、H2和Cl2,电解熔融NaCl可以得到Na和Cl2,B项错误。
10.(2023·苏州高一期中)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则H2SO4溶液中就转移2 mol电子
D.氢氧燃料电池中负极通入氢气发生氧化反应
答案 C
解析 干电池是一次电池,铅蓄电池是可充电电池,属于二次电池,氢氧燃料电池属于燃料电池,故A正确;在干电池中,Zn作负极,被氧化,故B正确;铅蓄电池工作过程中负极每消耗1 mol铅,则线路中会转移2 mol电子,硫酸中无电子转移,故C错误。
11.随着环保整治的逐渐推进,乙醇作为一种燃料逐渐走进人们的视野,如“乙醇汽油”“乙醇电池”等。如图是一种新型的乙醇电池的工作示意图,该电池总反应为C2H5OH+3O2===2CO2+3H2O。下列有关该电池的说法正确的是( )
A.a极为正极,b极为负极
B.负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+
C.反应中转移6 mol电子时,正极消耗33.6 L O2
D.该燃料电池工作一段时间后,酸性增强
答案 B
解析 依据质子(H+)向正极移动,可确定a极为负极,b极为正极,A项错误;在电池负极,C2H5OH在酸性电解质溶液中失电子,生成二氧化碳等,负极反应式为C2H5OH+3H2O-12e-===2CO2+12H+,B项正确;正极反应式为O2+4e-+4H+===2H2O,当反应中转移6 mol电子时,正极消耗1.5 mol O2,但由于温度、压强未知,所以O2的体积不一定是33.6 L,C项错误;由电池总反应C2H5OH+3O2===2CO2+3H2O可知,该燃料电池工作一段时间后,H+的物质的量不变,但溶剂的质量增加,所以溶液的酸性减弱,D项错误。
12.(2022·河北衡水高一期中)热激活电池常用作火箭的工作电源,某种热激活电池以Ca和PbSO4为电极材料,以无水LiCl-KCl为电解质,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。当电解质受热熔融后,电池即可瞬间放电。下列有关说法不正确的是( )
A.PbSO4电极发生还原反应
B.负极的电极反应式为Ca-2e-===Ca2+
C.放电时,K+向负极移动
D.每转移1 mol电子,正极质量减少48 g
答案 C
解析 放电时,原电池电解质溶液中的阳离子移向正极。
13.(2023·徐州高一检测)锌-空气电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电时总反应为2Zn+O2+4OH-+2H2O=== 2Zn(OH),下列有关说法正确的是( )
A.放电时电解质溶液中OH-向正极移动
B.放电时,电路中通过2 mol电子,消耗氧气11.2 L
C.发生OER反应的电极反应式为2H2O-4e-===O2↑+4H+
D.在电池放电过程中,空气进入电池,发生ORR反应,释放OH-
答案 D
解析 原电池中阴离子向负极移动,故放电时电解质溶液中OH-向负极移动,A错误;没有说明是标况,不能计算氧气体积,B错误;反应在碱性条件下进行,发生OER反应的电极反应式为4OH--4e-===O2↑+2H2O,C错误;空气进入电池,氧气得到电子发生还原反应,发生ORR反应:O2+4e-+2H2O===4OH-,D正确。
14.一种肼(N2H4)-空气碱性燃料电池工作原理如图所示(已知阴离子交换膜只允许阴离子通过)。下列说法错误的是( )
A.a为空气,b为N2H4
B.M电极为正极,电极反应为O2+4e-+4H+===2H2O
C.电路中通过1 mol电子时,同时有1 mol OH-从左室通过阴离子交换膜移到右室
D.当有16 g N2H4完全反应生成N2,消耗标准状况下11.2 L O2
答案 B
解析 燃料电池通入燃料的一极为负极,电子从负极流出,故 b为N2H4,A正确;此电池为碱性燃料电池,M为正极,则电极反应为O2+4e-+2H2O===4OH-,B不正确;燃料电池中,阴离子移向负极,根据得失电子守恒,有关系式e-~OH-,则电路中通过1 mol电子时,同时有1 mol OH-从左室正极区通过阴离子交换膜移到右室负极区,C正确;负极反应式为N2H4-4e-+4OH-===N2+4H2O,正极反应式为O2+4e-+2H2O===4OH-,根据得失电子守恒,N2H4~4e-~O2,当有1 mol即32 g N2H4完全反应生成N2,消耗1 mol O2,则当有16 g N2H4完全反应生成N2,消耗0.5 mol O2,标准状况下为11.2 L,D正确。
15.(2022·天津高一期中)(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向可知,氧气从______(填“a”或“b”)口通入,X极为电池的________(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)若将(1)中燃料电池改为甲烷-空气燃料电池,工作时,负极反应式为___________________,
电池总反应式为________________________________________________________________。
答案 (1)b 负 (2)负 流出
(3)CH4-8e-+10OH-===CO+7H2O CH4+2O2+2KOH===K2CO3+3H2O
解析 (1)氢氧燃料电池中,电子从负极向正极移动,X是负极,Y是正极,氧气应通入正极。 (2)根据电极反应可知,A极发生氧化反应,应该是电池的负极,电子从该极流出。(3)甲烷-空气燃料电池,通甲烷的一极(X)为负极,通空气的一极(Y)为正极,电池总反应式为CH4+2O2+2KOH===K2CO3+3H2O,负极反应式为CH4-8e-+10OH-===CO+7H2O。
16.(1)科研人员设想用如图甲所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_________________________________________________,b是______极,b电极反应式为____________________________________________________,生产过程中H+向______(填“a”或“b”)电极区域移动。
②该小组同学反思原电池的原理,其中观点正确的是________(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原电池装置一定需要两个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的原电池如图乙所示,质子交换膜(只允许H+通过)左右两侧的溶液均为1 L 2 mol·L-1 H2SO4溶液。电池总反应为2CH3OH+3O2===2CO2+4H2O,电极c为________(填“正极”或“负极”),电极c的反应式为_______________________________________________________________。
当电池中有1 mol e-发生转移时左右两侧溶液的质量之差为________g (假设反应物耗尽,忽略气体的溶解)。
答案 (1)①2SO2+O2+2H2O===2H2SO4 正 O2+4e-+4H+===2H2O b ②D (2)负极 CH3OH-6e-+H2O===CO2+6H+ 12
解析 (1)①根据装置图甲可知a电极通入SO2,SO2发生失去电子的氧化反应,O2从正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O===2H2SO4,b电极是正极,O2在酸性条件下得电子生成水,反应式为O2+4e-+4H+===2H2O,原电池中阳离子向正极移动,则生产过程中H+向b电极区域移动。②原电池反应的过程中一定有电子发生转移,A项错误;原电池装置不一定需要两个活泼性不同的金属电极,例如燃料电池等,B项错误;原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,C项错误;原电池中氧化反应和还原反应可以拆开在两极发生,D项正确。(2)根据装置图乙可知电子从电极c流出,则电极c是负极,电池总反应为2CH3OH+3O2===2CO2+4H2O,所以CH3OH在负极发生失去电子的氧化反应转化为CO2,则电极c的反应式为CH3OH-6e-+H2O===CO2+6H+;当转移1 mol电子时,左侧质量减轻×12 g=2 g,还有1 mol H+通过质子交换膜进入右侧,质量减少1 g,正极反应式为O2+4H++4e-===2H2O,右侧质量增加32 g×=8 g,加上转移过来的1 g H+,因此左右两侧溶液的质量之差为8 g+1 g+2 g+1 g=12 g。
