专题7 第三单元 含氮化合物的合理使用 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019)
文档属性
| 名称 | 专题7 第三单元 含氮化合物的合理使用 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019) |

|
|
| 格式 | docx | ||
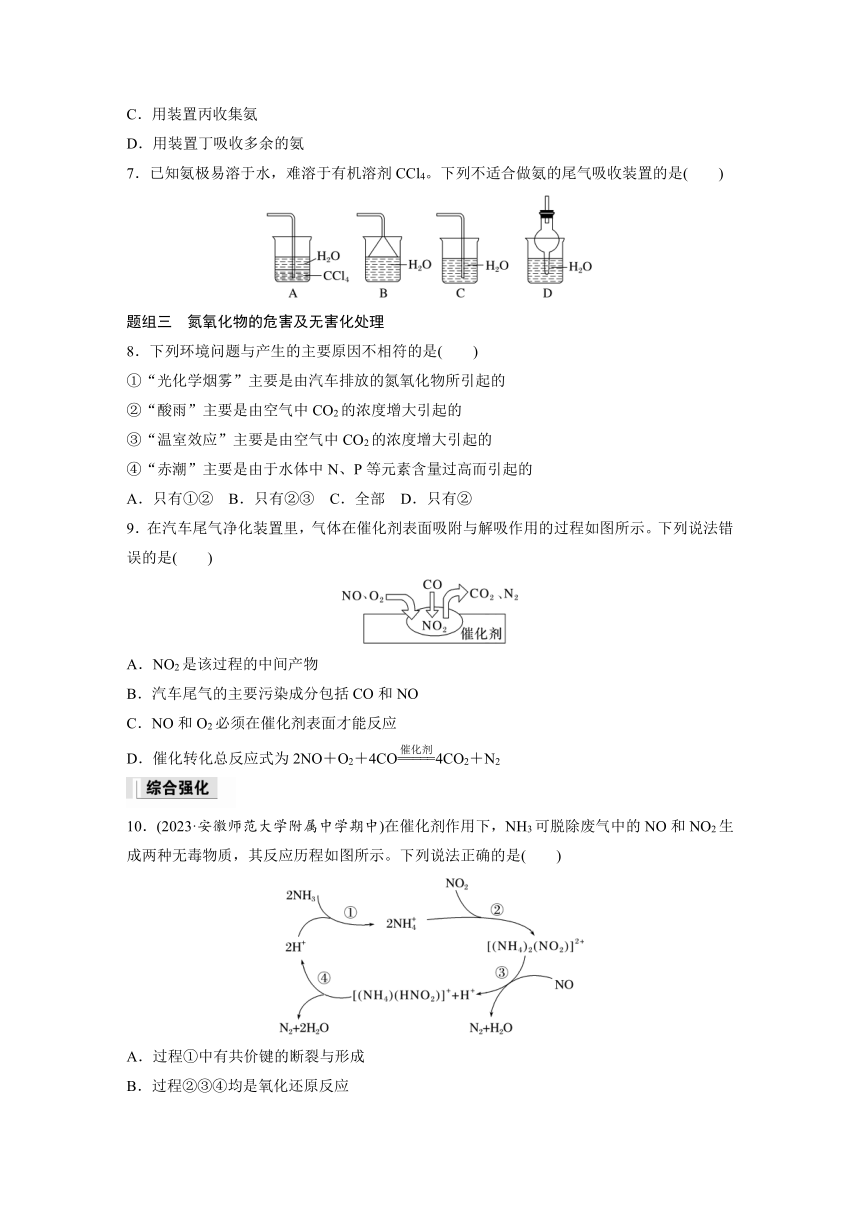
| 文件大小 | 421.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-04 22:59:43 | ||
图片预览



文档简介
第三单元 含氮化合物的合理使用
题组一 铵盐的性质、氮肥
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是( )
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
2.下列关于铵盐的说法正确的是( )
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
4.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是( )
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
6.下列装置能达到实验目的的是( )
A.用装置甲制备氨
B.用装置乙除去氨中少量水
C.用装置丙收集氨
D.用装置丁吸收多余的氨
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是( )
题组三 氮氧化物的危害及无害化处理
8.下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
9.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
10.(2023·安徽师范大学附属中学期中)在催化剂作用下,NH3可脱除废气中的NO和NO2生成两种无毒物质,其反应历程如图所示。下列说法正确的是( )
A.过程①中有共价键的断裂与形成
B.过程②③④均是氧化还原反应
C.废气中NO和NO2不能被碱液吸收
D.上述历程的总反应为2NH3+NO+NO22N2+3H2O
11.尿素的结构简式为,下列关于尿素的叙述不正确的是( )
A.尿素是一种氮肥
B.尿素也是人体新陈代谢的一种产物
C.尿素在水中可以电离出NH
D.尿素的分子式为CH4N2O,是一种有机氮肥
12.(2023·江苏常州中学月考)废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮。
下列有关说法正确的是( )
A.步骤a发生反应:NH+O2===NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为________,证明化肥中含________(填离子符号,下同)。
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为________,证明化肥中含有________或________。
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为__________。
14.(2023·浙江金华高一期中)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
Ⅰ.NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如图所示:
(1)SCR催化反应器中NH3还原NO2的化学方程式为_________________________________。
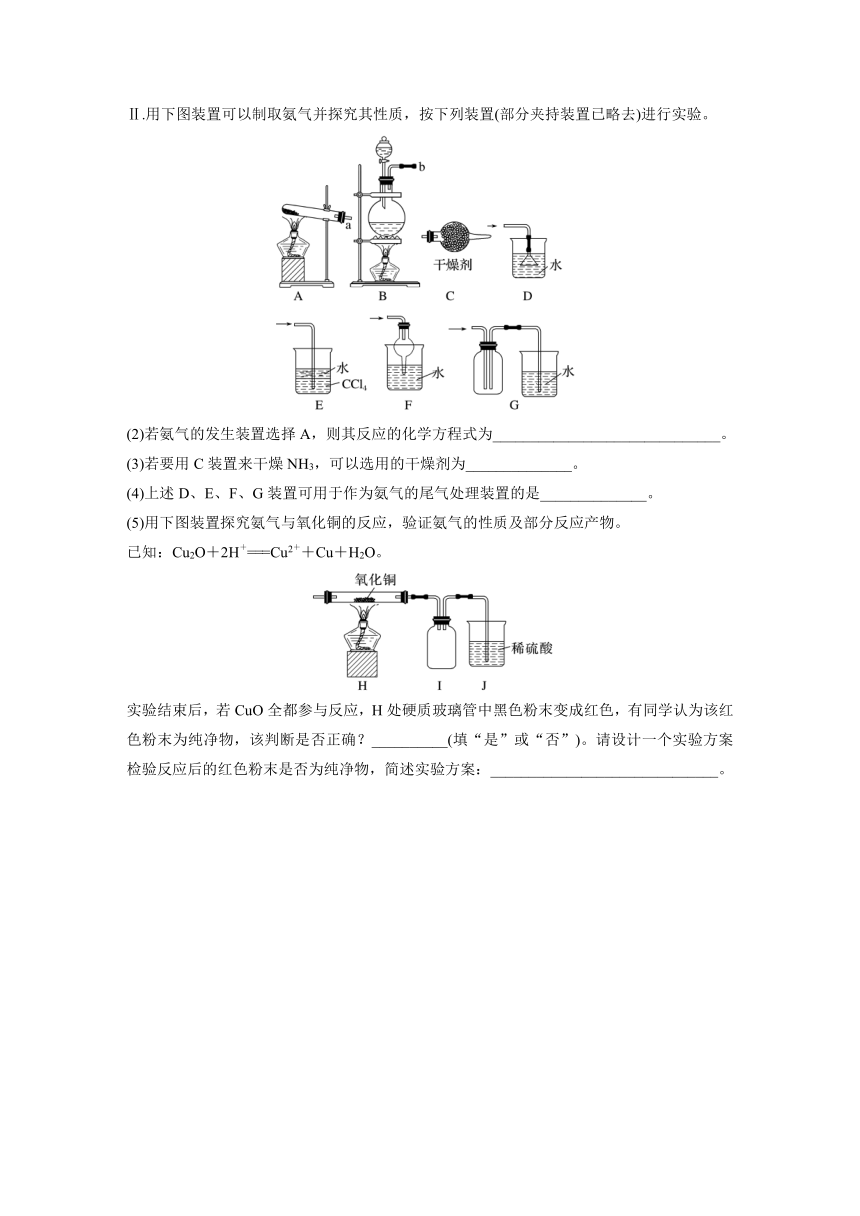
Ⅱ.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(2)若氨气的发生装置选择A,则其反应的化学方程式为______________________________。
(3)若要用C装置来干燥NH3,可以选用的干燥剂为______________。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是______________。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:Cu2O+2H+===Cu2++Cu+H2O。
实验结束后,若CuO全都参与反应,H处硬质玻璃管中黑色粉末变成红色,有同学认为该红色粉末为纯净物,该判断是否正确?__________(填“是”或“否”)。请设计一个实验方案检验反应后的红色粉末是否为纯净物,简述实验方案:______________________________。
题组一 铵盐的性质、氮肥
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是( )
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
答案 B
解析 碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碳酸铵受热分解生成氨气、二氧化碳和水,碳酸氢钠受热分解生成二氧化碳、水和固体碳酸钠,试管底部的物质不可能完全消失。
2.下列关于铵盐的说法正确的是( )
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
答案 C
解析 氯化铵受热分解生成氨气和氯化氢,A错误;氯化铵是强酸弱碱盐,其水溶液显弱酸性,能使紫色石蕊试液变红,B错误;铵盐大多都易溶于水,C正确;要密封保存铵盐,防止分解,D错误。
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
答案 B
解析 将固体放入试管中,加强碱溶液加热后,把湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
4.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
答案 D
解析 复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是( )
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
答案 D
6.下列装置能达到实验目的的是( )
A.用装置甲制备氨
B.用装置乙除去氨中少量水
C.用装置丙收集氨
D.用装置丁吸收多余的氨
答案 D
解析 用装置甲制备氨时试管口应该略向下倾斜,A错误;氨能被浓硫酸吸收,不能用装置乙除去氨中少量水,B错误;氨密度小于空气,用向下排空气法收集,但集气装置不能密闭,故不能用装置丙收集氨,C错误;氨极易溶于水,用装置丁吸收多余的氨可以防止倒吸,D正确。
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是( )
答案 C
解析 NH3极易溶于水,若用C项中的装置做NH3的尾气处理装置,则容易发生倒吸;NH3难溶于CCl4,故A装置可防倒吸;B和D项装置原理相似都可以防倒吸。
题组三 氮氧化物的危害及无害化处理
8.下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
答案 D
解析 “酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
9.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
答案 C
解析 由题图可知:2NO+O2===2NO2,2NO2+4CO4CO2+N2,总反应为2NO+O2+4CO4CO2+N2,NO2是该过程的中间产物,A、D项正确;汽车尾气的主要污染成分为有毒的CO和NO,B项正确;NO和O2在常温下就能反应生成NO2,C项错误。
10.(2023·安徽师范大学附属中学期中)在催化剂作用下,NH3可脱除废气中的NO和NO2生成两种无毒物质,其反应历程如图所示。下列说法正确的是( )
A.过程①中有共价键的断裂与形成
B.过程②③④均是氧化还原反应
C.废气中NO和NO2不能被碱液吸收
D.上述历程的总反应为2NH3+NO+NO22N2+3H2O
答案 D
解析 NH3与H+反应生成NH时仅有共价键的形成,A不正确;根据N元素的价态分析②不属于氧化还原反应,B不正确;废气中NO和NO2可用碱液吸收,发生反应:NO+NO2+2NaOH===2NaNO2+H2O,C不正确;根据反应历程图分析反应中共消耗2 mol NH3,1 mol NO,1 mol NO2,反应方程式正确,D正确。
11.尿素的结构简式为,下列关于尿素的叙述不正确的是( )
A.尿素是一种氮肥
B.尿素也是人体新陈代谢的一种产物
C.尿素在水中可以电离出NH
D.尿素的分子式为CH4N2O,是一种有机氮肥
答案 C
解析 据尿素的结构简式,尿素分子中不含NH,在溶液中也不能电离出NH。
12.(2023·江苏常州中学月考)废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮。
下列有关说法正确的是( )
A.步骤a发生反应:NH+O2===NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
答案 C
解析 步骤a中铵根离子被氧化,发生反应:NH+2O2===NO+H2O+2H+,故A错误;含氨氮的废水直接大量排放,可使水中藻类植物大量繁殖,造成水体污染,故B错误;化学沉淀法脱氮时,溶液的碱性过强,镁离子转化为氢氧化镁沉淀,则氨氮的去除率将下降,故C正确;高温下微生物不能存活,不利于脱氮,故D错误。
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为________,证明化肥中含________(填离子符号,下同)。
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为________,证明化肥中含有________或________。
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为__________。
答案 (1)NH3 NH (2)CO2 CO HCO (3)NH4HCO3
解析 (1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明化肥中含有NH。(2)将上述反应后的溶液中加入盐酸,生成无色无味气体,将所得气体通入澄清石灰水后出现浑浊现象,可以推知生成的无色无味的气体为二氧化碳,证明化肥中含有CO或HCO。(3)另取少量化肥溶于水,加入CaCl2溶液后无明显反应现象,由于钙离子能够与CO反应生成沉淀,因此证明溶液中不存在CO,结合上一步反应,可推知化肥中一定存在HCO;再结合(1)的结论可知:该化肥的化学式为NH4HCO3。
14.(2023·浙江金华高一期中)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
Ⅰ.NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如图所示:
(1)SCR催化反应器中NH3还原NO2的化学方程式为_________________________________。
Ⅱ.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(2)若氨气的发生装置选择A,则其反应的化学方程式为______________________________。
(3)若要用C装置来干燥NH3,可以选用的干燥剂为______________。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是______________。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:Cu2O+2H+===Cu2++Cu+H2O。
实验结束后,若CuO全都参与反应,H处硬质玻璃管中黑色粉末变成红色,有同学认为该红色粉末为纯净物,该判断是否正确?__________(填“是”或“否”)。请设计一个实验方案检验反应后的红色粉末是否为纯净物,简述实验方案:______________________________。
答案 (1)8NH3+6NO27N2+12H2O
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)碱石灰
(4)EF
(5)否 取适量反应后的固体粉末,加入适量稀硫酸,溶液变为蓝色,说明该固体粉末为混合物,不变蓝,则为纯净物
解析 (1)由图可知,在SCR催化反应器中氨气与二氧化氮反应生成氮气和水,反应的化学方程式为8NH3+6NO27N2+12H2O。(4)装置E中氨气不直接与水接触,氨气溶于水不会造成压强差,不会产生倒吸;装置F中干燥管的容积大,达到防倒吸的目的;装置D中倒置漏斗浸入水中会产生倒吸;装置G中进气管太长,会使倒吸入广口瓶中的水通过导气管倒吸进入反应装置中。(5)Cu2O和Cu都是红色的,实验结束后H处硬质玻璃管中黑色粉末变成红色不能确定为纯净物。
题组一 铵盐的性质、氮肥
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是( )
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
2.下列关于铵盐的说法正确的是( )
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
4.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是( )
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
6.下列装置能达到实验目的的是( )
A.用装置甲制备氨
B.用装置乙除去氨中少量水
C.用装置丙收集氨
D.用装置丁吸收多余的氨
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是( )
题组三 氮氧化物的危害及无害化处理
8.下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
9.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
10.(2023·安徽师范大学附属中学期中)在催化剂作用下,NH3可脱除废气中的NO和NO2生成两种无毒物质,其反应历程如图所示。下列说法正确的是( )
A.过程①中有共价键的断裂与形成
B.过程②③④均是氧化还原反应
C.废气中NO和NO2不能被碱液吸收
D.上述历程的总反应为2NH3+NO+NO22N2+3H2O
11.尿素的结构简式为,下列关于尿素的叙述不正确的是( )
A.尿素是一种氮肥
B.尿素也是人体新陈代谢的一种产物
C.尿素在水中可以电离出NH
D.尿素的分子式为CH4N2O,是一种有机氮肥
12.(2023·江苏常州中学月考)废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮。
下列有关说法正确的是( )
A.步骤a发生反应:NH+O2===NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为________,证明化肥中含________(填离子符号,下同)。
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为________,证明化肥中含有________或________。
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为__________。
14.(2023·浙江金华高一期中)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
Ⅰ.NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如图所示:
(1)SCR催化反应器中NH3还原NO2的化学方程式为_________________________________。
Ⅱ.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(2)若氨气的发生装置选择A,则其反应的化学方程式为______________________________。
(3)若要用C装置来干燥NH3,可以选用的干燥剂为______________。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是______________。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:Cu2O+2H+===Cu2++Cu+H2O。
实验结束后,若CuO全都参与反应,H处硬质玻璃管中黑色粉末变成红色,有同学认为该红色粉末为纯净物,该判断是否正确?__________(填“是”或“否”)。请设计一个实验方案检验反应后的红色粉末是否为纯净物,简述实验方案:______________________________。
题组一 铵盐的性质、氮肥
1.给装有下列少量固体物质的试管加热,试管底部的物质不可能完全消失的是( )
A.碳酸氢铵 B.碳酸氢钠
C.氯化铵 D.碳酸铵
答案 B
解析 碳酸氢铵受热分解生成氨气、二氧化碳和水,氯化铵受热分解生成氨气和氯化氢,碳酸铵受热分解生成氨气、二氧化碳和水,碳酸氢钠受热分解生成二氧化碳、水和固体碳酸钠,试管底部的物质不可能完全消失。
2.下列关于铵盐的说法正确的是( )
A.将NH4Cl固体加热,NH4Cl发生了升华
B.铵盐的溶液能使石蕊试液变蓝色
C.铵盐大多都易溶于水
D.要密封保存铵盐,防止氨气泄漏
答案 C
解析 氯化铵受热分解生成氨气和氯化氢,A错误;氯化铵是强酸弱碱盐,其水溶液显弱酸性,能使紫色石蕊试液变红,B错误;铵盐大多都易溶于水,C正确;要密封保存铵盐,防止分解,D错误。
3.检验铵盐的一般方法是将待测物取少许置于试管中,然后( )
A.加水溶解后,再滴入酚酞溶液
B.加强碱溶液加热后,用湿润的红色石蕊试纸在试管口检验
C.加入强酸溶液加热后,再滴入酚酞溶液
D.加入强碱溶液加热后,再滴入酚酞溶液
答案 B
解析 将固体放入试管中,加强碱溶液加热后,把湿润的红色石蕊试纸放在试管口,湿润的红色石蕊试纸会变蓝色,证明产生的气体是氨,则该盐中含有铵根离子,B正确。
4.(2022·山东郓城县第一中学月考)下列氮肥属于复合肥料的是( )
A.CO(NH2)2 B.(NH4)2SO4
C.NH3·H2O D.KNO3
答案 D
解析 复合肥料是指同时含有两种或两种以上营养元素的肥料,KNO3含有钾元素和氮元素,属于复合肥料。
题组二 氨的实验室制法
5.在实验室里,某学习小组设计了下列制取纯净干燥氨的方案,简易、可行的方案是( )
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
答案 D
6.下列装置能达到实验目的的是( )
A.用装置甲制备氨
B.用装置乙除去氨中少量水
C.用装置丙收集氨
D.用装置丁吸收多余的氨
答案 D
解析 用装置甲制备氨时试管口应该略向下倾斜,A错误;氨能被浓硫酸吸收,不能用装置乙除去氨中少量水,B错误;氨密度小于空气,用向下排空气法收集,但集气装置不能密闭,故不能用装置丙收集氨,C错误;氨极易溶于水,用装置丁吸收多余的氨可以防止倒吸,D正确。
7.已知氨极易溶于水,难溶于有机溶剂CCl4。下列不适合做氨的尾气吸收装置的是( )
答案 C
解析 NH3极易溶于水,若用C项中的装置做NH3的尾气处理装置,则容易发生倒吸;NH3难溶于CCl4,故A装置可防倒吸;B和D项装置原理相似都可以防倒吸。
题组三 氮氧化物的危害及无害化处理
8.下列环境问题与产生的主要原因不相符的是( )
①“光化学烟雾”主要是由汽车排放的氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度增大引起的
③“温室效应”主要是由空气中CO2的浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①② B.只有②③ C.全部 D.只有②
答案 D
解析 “酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
9.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是( )
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应式为2NO+O2+4CO4CO2+N2
答案 C
解析 由题图可知:2NO+O2===2NO2,2NO2+4CO4CO2+N2,总反应为2NO+O2+4CO4CO2+N2,NO2是该过程的中间产物,A、D项正确;汽车尾气的主要污染成分为有毒的CO和NO,B项正确;NO和O2在常温下就能反应生成NO2,C项错误。
10.(2023·安徽师范大学附属中学期中)在催化剂作用下,NH3可脱除废气中的NO和NO2生成两种无毒物质,其反应历程如图所示。下列说法正确的是( )
A.过程①中有共价键的断裂与形成
B.过程②③④均是氧化还原反应
C.废气中NO和NO2不能被碱液吸收
D.上述历程的总反应为2NH3+NO+NO22N2+3H2O
答案 D
解析 NH3与H+反应生成NH时仅有共价键的形成,A不正确;根据N元素的价态分析②不属于氧化还原反应,B不正确;废气中NO和NO2可用碱液吸收,发生反应:NO+NO2+2NaOH===2NaNO2+H2O,C不正确;根据反应历程图分析反应中共消耗2 mol NH3,1 mol NO,1 mol NO2,反应方程式正确,D正确。
11.尿素的结构简式为,下列关于尿素的叙述不正确的是( )
A.尿素是一种氮肥
B.尿素也是人体新陈代谢的一种产物
C.尿素在水中可以电离出NH
D.尿素的分子式为CH4N2O,是一种有机氮肥
答案 C
解析 据尿素的结构简式,尿素分子中不含NH,在溶液中也不能电离出NH。
12.(2023·江苏常州中学月考)废水中的氨氮(NH3、NH)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NHNON2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮。
下列有关说法正确的是( )
A.步骤a发生反应:NH+O2===NO+H2O+H+
B.含氨氮的废水直接大量排放,对水体的影响不大
C.化学沉淀法脱氮时,溶液的碱性过强,氨氮的去除率将下降
D.微生物脱氮可在高温条件下进行,以加快脱氮的速率
答案 C
解析 步骤a中铵根离子被氧化,发生反应:NH+2O2===NO+H2O+2H+,故A错误;含氨氮的废水直接大量排放,可使水中藻类植物大量繁殖,造成水体污染,故B错误;化学沉淀法脱氮时,溶液的碱性过强,镁离子转化为氢氧化镁沉淀,则氨氮的去除率将下降,故C正确;高温下微生物不能存活,不利于脱氮,故D错误。
13.常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
(1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为________,证明化肥中含________(填离子符号,下同)。
(2)向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为________,证明化肥中含有________或________。
(3)另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为__________。
答案 (1)NH3 NH (2)CO2 CO HCO (3)NH4HCO3
解析 (1)取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明化肥中含有NH。(2)将上述反应后的溶液中加入盐酸,生成无色无味气体,将所得气体通入澄清石灰水后出现浑浊现象,可以推知生成的无色无味的气体为二氧化碳,证明化肥中含有CO或HCO。(3)另取少量化肥溶于水,加入CaCl2溶液后无明显反应现象,由于钙离子能够与CO反应生成沉淀,因此证明溶液中不存在CO,结合上一步反应,可推知化肥中一定存在HCO;再结合(1)的结论可知:该化肥的化学式为NH4HCO3。
14.(2023·浙江金华高一期中)人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,合成氨是人类发展史上的一项重大突破。某化学兴趣小组对氨气进行研究:
Ⅰ.NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术),反应原理如图所示:
(1)SCR催化反应器中NH3还原NO2的化学方程式为_________________________________。
Ⅱ.用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(2)若氨气的发生装置选择A,则其反应的化学方程式为______________________________。
(3)若要用C装置来干燥NH3,可以选用的干燥剂为______________。
(4)上述D、E、F、G装置可用于作为氨气的尾气处理装置的是______________。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
已知:Cu2O+2H+===Cu2++Cu+H2O。
实验结束后,若CuO全都参与反应,H处硬质玻璃管中黑色粉末变成红色,有同学认为该红色粉末为纯净物,该判断是否正确?__________(填“是”或“否”)。请设计一个实验方案检验反应后的红色粉末是否为纯净物,简述实验方案:______________________________。
答案 (1)8NH3+6NO27N2+12H2O
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)碱石灰
(4)EF
(5)否 取适量反应后的固体粉末,加入适量稀硫酸,溶液变为蓝色,说明该固体粉末为混合物,不变蓝,则为纯净物
解析 (1)由图可知,在SCR催化反应器中氨气与二氧化氮反应生成氮气和水,反应的化学方程式为8NH3+6NO27N2+12H2O。(4)装置E中氨气不直接与水接触,氨气溶于水不会造成压强差,不会产生倒吸;装置F中干燥管的容积大,达到防倒吸的目的;装置D中倒置漏斗浸入水中会产生倒吸;装置G中进气管太长,会使倒吸入广口瓶中的水通过导气管倒吸进入反应装置中。(5)Cu2O和Cu都是红色的,实验结束后H处硬质玻璃管中黑色粉末变成红色不能确定为纯净物。
