专题9 第二单元 第2课时 反应条件的控制 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019)
文档属性
| 名称 | 专题9 第二单元 第2课时 反应条件的控制 课时对点练(原卷版+解析版)2024-2025学年高一化学必修2(苏教版2019) |
|
|
| 格式 | docx | ||
| 文件大小 | 461.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-05 00:42:51 | ||
图片预览



文档简介
第2课时 反应条件的控制
题组一 Fe(OH)2的制备
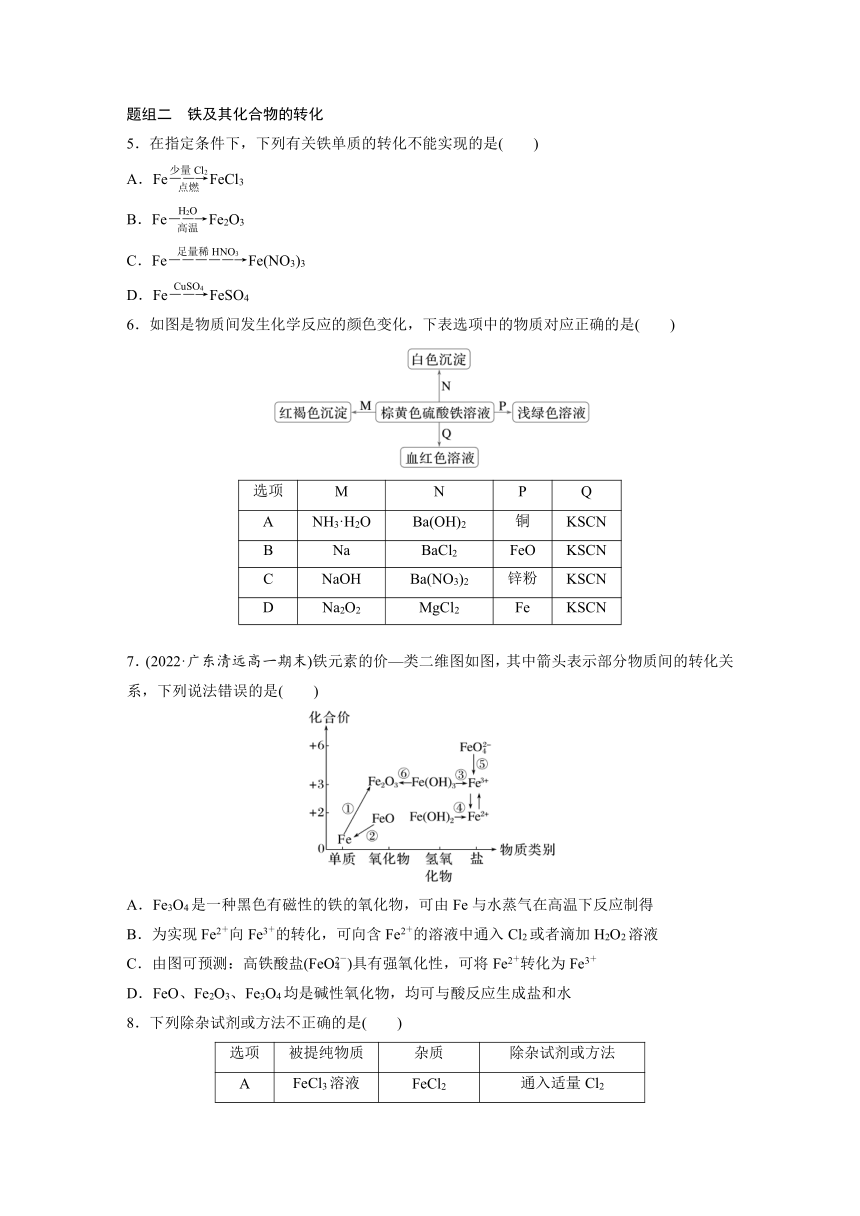
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
2.(2023·温州高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色
4.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
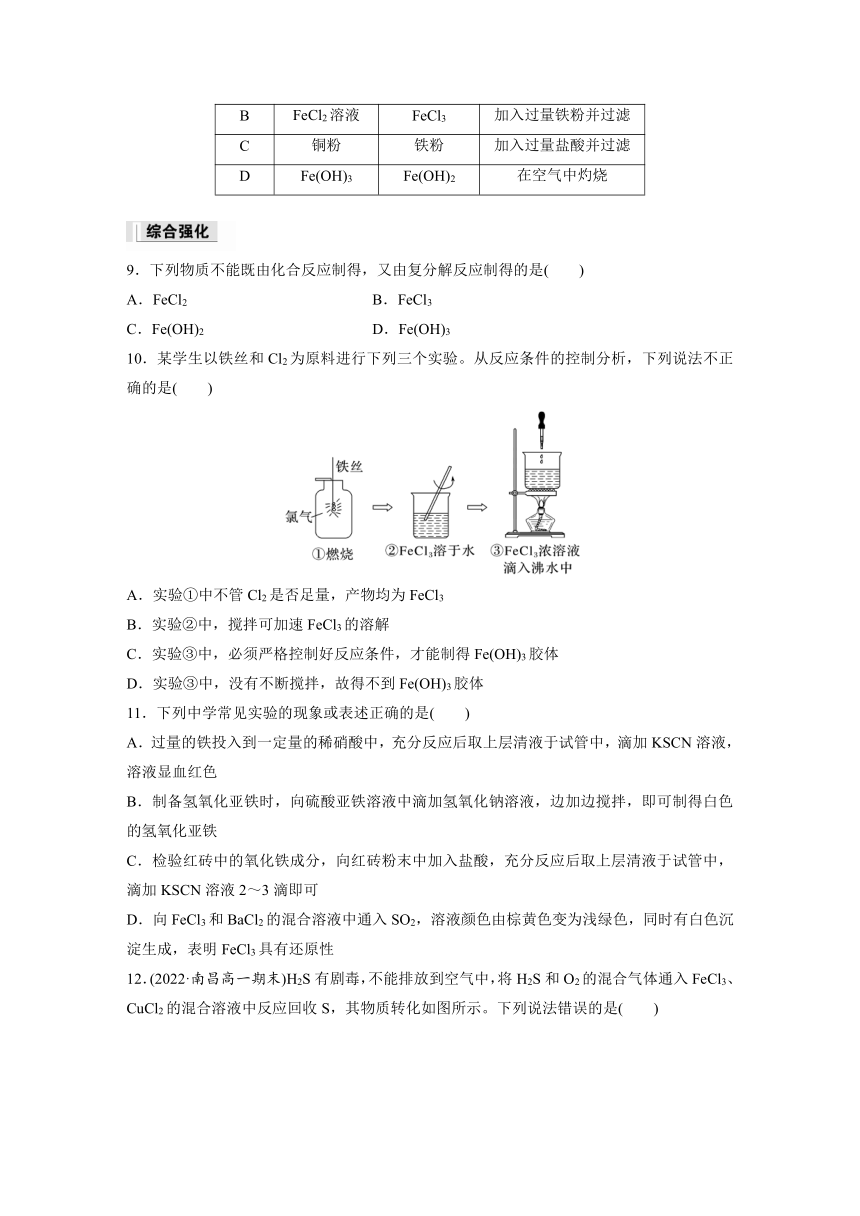
题组二 铁及其化合物的转化
5.在指定条件下,下列有关铁单质的转化不能实现的是( )
A.FeFeCl3
B.FeFe2O3
C.FeFe(NO3)3
D.FeFeSO4
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
7.(2022·广东清远高一期末)铁元素的价—类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是( )
A.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐(FeO)具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
8.下列除杂试剂或方法不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
9.下列物质不能既由化合反应制得,又由复分解反应制得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是( )
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
11.下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿色,同时有白色沉淀生成,表明FeCl3具有还原性
12.(2022·南昌高一期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中应大于2
13.某工程师为了从使用过的印刷电路板腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
(1)步骤Ⅰ的操作名称:______;实验室中该操作所需玻璃仪器:______、________、________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:___________________________________。
(3)检验腐蚀废液中是否含有Fe3+所需试剂名称:______,实验现象:__________________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________
___________________________,此转化的化学方程式为_______________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
14.阅读下列材料,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+Fe3+,A反应中Fe2+作__________剂,B反应中Fe3+作__________剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__________性。
(2)新配制的FeCl2溶液应加入____________以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__________。
(3)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中溶液呈血红色(证明含有FeCl2),你认为此方案__________(填“合理”或“不合理”),若不合理,如何改进:_____________________。
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)_______________________________、
_________________________________。
(2)由实验ⅱ得出的结论是______________________________________________。为进一步验证假设,该小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是__________________________________。
(4)通过以上实验,可得到的结论是__________________________________。
题组一 Fe(OH)2的制备
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
答案 D
解析 B项中CCl4的密度比水大,应在下层,不能长时间观察到白色沉淀;D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
2.(2023·温州高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
答案 C
解析 FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保在无氧的环境里生成Fe(OH)2,故A正确;在FeCl2溶液的上面加一层苯,以隔绝空气防止氧气溶入,故B正确;向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气而溶有氧气,故C错误;产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,故D正确。
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色
答案 B
解析 B中盛有一定量的NaOH溶液,A中Fe与稀硫酸反应产生FeSO4和H2,关闭E时,A中的H2将FeSO4溶液压入B中与NaOH溶液反应产生Fe(OH)2白色沉淀,A、C正确;实验开始时应先将活塞E打开,用氢气排尽装置中的空气,B错误;取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色,D正确。
4.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
答案 D
题组二 铁及其化合物的转化
5.在指定条件下,下列有关铁单质的转化不能实现的是( )
A.FeFeCl3
B.FeFe2O3
C.FeFe(NO3)3
D.FeFeSO4
答案 B
解析 Cl2具有强氧化性,可以把Fe氧化生成FeCl3,A不符合题意;Fe与水蒸气反应生成Fe3O4,B符合题意;HNO3具有强氧化性且足量,故此时Fe与硝酸反应生成Fe(NO3)3,C不符合题意;Fe与CuSO4发生置换反应生成Cu和FeSO4,D不符合题意。
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
答案 C
解析 Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;FeO不能还原Fe3+,B项错误;MgCl2与Fe2(SO4)3不反应,D项错误。
7.(2022·广东清远高一期末)铁元素的价—类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是( )
A.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐(FeO)具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
答案 D
解析 Fe3O4是一种黑色有磁性的铁的氧化物,铁单质与水蒸气在高温下发生反应:3Fe+4H2O(g)Fe3O4+4H2,故A说法正确;Fe2+转化成Fe3+,铁元素的化合价升高,需要加入氧化剂才能实现转化,如O2、Cl2、H2O2等,故B说法正确;FeO中铁元素显+6价,具有强氧化性,能将Fe2+氧化成Fe3+,故C说法正确;Fe3O4不是碱性氧化物,故D说法错误。
8.下列除杂试剂或方法不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
答案 D
解析 FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;Fe(OH)3、Fe(OH)2受热都易分解,D错误。
9.下列物质不能既由化合反应制得,又由复分解反应制得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
答案 C
解析 A项,FeCl2可由化合反应Fe+2FeCl3===3FeCl2制得,也可由复分解反应如FeSO4+BaCl2===BaSO4↓+FeCl2制得;B项,FeCl3可由化合反应2Fe+3Cl22FeCl3制得,也可由复分解反应如Fe2(SO4)3+3BaCl2===3BaSO4↓+2FeCl3制得;C项,Fe(OH)2不能由化合反应制得,可由复分解反应如FeCl2+2NaOH===Fe(OH)2↓+2NaCl制得;D项,Fe(OH)3可由化合反应4Fe(OH)2+O2+2H2O===4Fe(OH)3制得,也可由复分解反应如FeCl3+3NaOH===Fe(OH)3↓+3NaCl制得。
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是( )
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
答案 D
解析 Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;搅拌可加速物质的溶解,故B正确;严格控制好条件,才能制得Fe(OH)3胶体,故C正确、D错误。
11.下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿色,同时有白色沉淀生成,表明FeCl3具有还原性
答案 C
解析 过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁离子,然后铁和三价铁离子反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀,故B错误;氧化铁和盐酸反应生成氯化铁溶液和水,三价铁离子遇KSCN溶液会变血红色,故C正确。
12.(2022·南昌高一期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中应大于2
答案 D
解析 鱼、肉、蛋腐败时均能产生H2S,A项正确;由题图可以看出,Fe2+在O2的作用下变成Fe3+,发生的反应为O2+4Fe2++4H+===4Fe3++2H2O,B项正确;图示转化中,Cu、H、Cl元素的化合价没有变化,C项正确;由图可知,总反应为2H2S+O2===2S↓+2H2O,Fe3+是混合液的成分之一,为避免混合液失效,混合气体中O2的含量要大一些,以保证Fe3+不会损失,故应小于2,D项错误。
13.某工程师为了从使用过的印刷电路板腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
(1)步骤Ⅰ的操作名称:______;实验室中该操作所需玻璃仪器:______、________、________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:___________________________________。
(3)检验腐蚀废液中是否含有Fe3+所需试剂名称:______,实验现象:__________________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________
___________________________,此转化的化学方程式为_______________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
答案 (1)过滤 烧杯 漏斗 玻璃棒 (2)2Fe3++Cu===2Fe2++Cu2+ (3)硫氰化钾溶液 溶液变为血红色 (4)先产生白色絮状沉淀,然后逐步变为灰绿色,最终变为红褐色 FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3 (5)Fe、Cu 2Fe2++Cl2===2Fe3++2Cl-
解析 废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===
3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
14.阅读下列材料,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+Fe3+,A反应中Fe2+作__________剂,B反应中Fe3+作__________剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__________性。
(2)新配制的FeCl2溶液应加入____________以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__________。
(3)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中溶液呈血红色(证明含有FeCl2),你认为此方案__________(填“合理”或“不合理”),若不合理,如何改进:_____________________。
答案 (1)还原 氧化 还原
(2)铁粉 Cl2
(3)不合理 取少量溶液,先加KSCN溶液,溶液不变血红色,再加入氯水,溶液变成血红色,则证明原溶液中含有Fe2+
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)_______________________________、
_________________________________。
(2)由实验ⅱ得出的结论是______________________________________________。为进一步验证假设,该小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是__________________________________。
(4)通过以上实验,可得到的结论是__________________________________。
答案 (1)Fe2++2OH-===Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)化肥中肯定有Fe2(SO4)3(或假设a不成立) (3)Cl2+2Fe2+===2Cl-+2Fe3+ (4)该化肥中含有FeSO4和Fe2(SO4)3(或假设b成立)
解析 (1)FeSO4溶液与NaOH溶液反应生成白色沉淀Fe(OH)2,Fe(OH)2易被氧化为Fe(OH)3,所以预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀。(2)向溶液X中加入1滴KSCN溶液,溶液显血红色,说明含有Fe2(SO4)3,则假设a不成立。(3)实验ⅳ说明溶液X中含有Fe2+,且Fe2+被氯水中的氯气氧化为Fe3+。(4)实验ⅲ说明溶液X中含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是该化肥中含有FeSO4和Fe2(SO4)3或假设b成立。
题组一 Fe(OH)2的制备
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
2.(2023·温州高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色
4.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
题组二 铁及其化合物的转化
5.在指定条件下,下列有关铁单质的转化不能实现的是( )
A.FeFeCl3
B.FeFe2O3
C.FeFe(NO3)3
D.FeFeSO4
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
7.(2022·广东清远高一期末)铁元素的价—类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是( )
A.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐(FeO)具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
8.下列除杂试剂或方法不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
9.下列物质不能既由化合反应制得,又由复分解反应制得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是( )
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
11.下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿色,同时有白色沉淀生成,表明FeCl3具有还原性
12.(2022·南昌高一期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中应大于2
13.某工程师为了从使用过的印刷电路板腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
(1)步骤Ⅰ的操作名称:______;实验室中该操作所需玻璃仪器:______、________、________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:___________________________________。
(3)检验腐蚀废液中是否含有Fe3+所需试剂名称:______,实验现象:__________________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________
___________________________,此转化的化学方程式为_______________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
14.阅读下列材料,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+Fe3+,A反应中Fe2+作__________剂,B反应中Fe3+作__________剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__________性。
(2)新配制的FeCl2溶液应加入____________以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__________。
(3)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中溶液呈血红色(证明含有FeCl2),你认为此方案__________(填“合理”或“不合理”),若不合理,如何改进:_____________________。
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)_______________________________、
_________________________________。
(2)由实验ⅱ得出的结论是______________________________________________。为进一步验证假设,该小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是__________________________________。
(4)通过以上实验,可得到的结论是__________________________________。
题组一 Fe(OH)2的制备
1.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是( )
答案 D
解析 B项中CCl4的密度比水大,应在下层,不能长时间观察到白色沉淀;D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
2.(2023·温州高一检测)实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )
A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸
B.可在FeCl2溶液的上面加一层苯,以隔绝空气
C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入到试管内
D.产生Fe(OH)2沉淀后,不能振荡试管
答案 C
解析 FeCl2和烧碱溶液要现用现配,且配制溶液的蒸馏水要煮沸以除去氧气,确保在无氧的环境里生成Fe(OH)2,故A正确;在FeCl2溶液的上面加一层苯,以隔绝空气防止氧气溶入,故B正确;向FeCl2溶液中滴加烧碱溶液时,要将胶头滴管尖嘴伸入到FeCl2溶液中,防止氢氧化钠溶液在滴入时接触空气而溶有氧气,故C错误;产生Fe(OH)2沉淀后,若振荡试管,会增大沉淀与空气接触的机会,使沉淀更易被氧化,故D正确。
3.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol·L-1硫酸、NaOH溶液。下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始时应先将活塞E关闭
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B中
D.取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色
答案 B
解析 B中盛有一定量的NaOH溶液,A中Fe与稀硫酸反应产生FeSO4和H2,关闭E时,A中的H2将FeSO4溶液压入B中与NaOH溶液反应产生Fe(OH)2白色沉淀,A、C正确;实验开始时应先将活塞E打开,用氢气排尽装置中的空气,B错误;取下装置B中的橡皮塞,使空气进入,颜色变化为白色变成灰绿色,最终变成红褐色,D正确。
4.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
答案 D
题组二 铁及其化合物的转化
5.在指定条件下,下列有关铁单质的转化不能实现的是( )
A.FeFeCl3
B.FeFe2O3
C.FeFe(NO3)3
D.FeFeSO4
答案 B
解析 Cl2具有强氧化性,可以把Fe氧化生成FeCl3,A不符合题意;Fe与水蒸气反应生成Fe3O4,B符合题意;HNO3具有强氧化性且足量,故此时Fe与硝酸反应生成Fe(NO3)3,C不符合题意;Fe与CuSO4发生置换反应生成Cu和FeSO4,D不符合题意。
6.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
答案 C
解析 Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;FeO不能还原Fe3+,B项错误;MgCl2与Fe2(SO4)3不反应,D项错误。
7.(2022·广东清远高一期末)铁元素的价—类二维图如图,其中箭头表示部分物质间的转化关系,下列说法错误的是( )
A.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe与水蒸气在高温下反应制得
B.为实现Fe2+向Fe3+的转化,可向含Fe2+的溶液中通入Cl2或者滴加H2O2溶液
C.由图可预测:高铁酸盐(FeO)具有强氧化性,可将Fe2+转化为Fe3+
D.FeO、Fe2O3、Fe3O4均是碱性氧化物,均可与酸反应生成盐和水
答案 D
解析 Fe3O4是一种黑色有磁性的铁的氧化物,铁单质与水蒸气在高温下发生反应:3Fe+4H2O(g)Fe3O4+4H2,故A说法正确;Fe2+转化成Fe3+,铁元素的化合价升高,需要加入氧化剂才能实现转化,如O2、Cl2、H2O2等,故B说法正确;FeO中铁元素显+6价,具有强氧化性,能将Fe2+氧化成Fe3+,故C说法正确;Fe3O4不是碱性氧化物,故D说法错误。
8.下列除杂试剂或方法不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 铜粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
答案 D
解析 FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;Fe(OH)3、Fe(OH)2受热都易分解,D错误。
9.下列物质不能既由化合反应制得,又由复分解反应制得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)2 D.Fe(OH)3
答案 C
解析 A项,FeCl2可由化合反应Fe+2FeCl3===3FeCl2制得,也可由复分解反应如FeSO4+BaCl2===BaSO4↓+FeCl2制得;B项,FeCl3可由化合反应2Fe+3Cl22FeCl3制得,也可由复分解反应如Fe2(SO4)3+3BaCl2===3BaSO4↓+2FeCl3制得;C项,Fe(OH)2不能由化合反应制得,可由复分解反应如FeCl2+2NaOH===Fe(OH)2↓+2NaCl制得;D项,Fe(OH)3可由化合反应4Fe(OH)2+O2+2H2O===4Fe(OH)3制得,也可由复分解反应如FeCl3+3NaOH===Fe(OH)3↓+3NaCl制得。
10.某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是( )
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
答案 D
解析 Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;搅拌可加速物质的溶解,故B正确;严格控制好条件,才能制得Fe(OH)3胶体,故C正确、D错误。
11.下列中学常见实验的现象或表述正确的是( )
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变为浅绿色,同时有白色沉淀生成,表明FeCl3具有还原性
答案 C
解析 过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁离子,然后铁和三价铁离子反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀,故B错误;氧化铁和盐酸反应生成氯化铁溶液和水,三价铁离子遇KSCN溶液会变血红色,故C正确。
12.(2022·南昌高一期末)H2S有剧毒,不能排放到空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
A.腐败的鱼、肉、蛋中都有硫化氢气体产生
B.O2在转化过程中发生的反应为O2+4Fe2++4H+===4Fe3++2H2O
C.图示转化中,有三种元素的化合价未发生改变
D.为避免混合液失效,混合气体中应大于2
答案 D
解析 鱼、肉、蛋腐败时均能产生H2S,A项正确;由题图可以看出,Fe2+在O2的作用下变成Fe3+,发生的反应为O2+4Fe2++4H+===4Fe3++2H2O,B项正确;图示转化中,Cu、H、Cl元素的化合价没有变化,C项正确;由图可知,总反应为2H2S+O2===2S↓+2H2O,Fe3+是混合液的成分之一,为避免混合液失效,混合气体中O2的含量要大一些,以保证Fe3+不会损失,故应小于2,D项错误。
13.某工程师为了从使用过的印刷电路板腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
(1)步骤Ⅰ的操作名称:______;实验室中该操作所需玻璃仪器:______、________、________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:___________________________________。
(3)检验腐蚀废液中是否含有Fe3+所需试剂名称:______,实验现象:__________________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:_______________________
___________________________,此转化的化学方程式为_______________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:__________________________。
答案 (1)过滤 烧杯 漏斗 玻璃棒 (2)2Fe3++Cu===2Fe2++Cu2+ (3)硫氰化钾溶液 溶液变为血红色 (4)先产生白色絮状沉淀,然后逐步变为灰绿色,最终变为红褐色 FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3 (5)Fe、Cu 2Fe2++Cl2===2Fe3++2Cl-
解析 废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===
3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
14.阅读下列材料,回答相应问题。
铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化Fe2+Fe3+,A反应中Fe2+作__________剂,B反应中Fe3+作__________剂,服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。这说明维生素C具有__________性。
(2)新配制的FeCl2溶液应加入____________以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的__________。
(3)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证:
取少许未知试液于试管中溶液呈血红色(证明含有FeCl2),你认为此方案__________(填“合理”或“不合理”),若不合理,如何改进:_____________________。
答案 (1)还原 氧化 还原
(2)铁粉 Cl2
(3)不合理 取少量溶液,先加KSCN溶液,溶液不变血红色,再加入氯水,溶液变成血红色,则证明原溶液中含有Fe2+
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显血红色
(1)对实验ⅰ的预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表示)_______________________________、
_________________________________。
(2)由实验ⅱ得出的结论是______________________________________________。为进一步验证假设,该小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显血红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显血红色,颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是__________________________________。
(4)通过以上实验,可得到的结论是__________________________________。
答案 (1)Fe2++2OH-===Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)化肥中肯定有Fe2(SO4)3(或假设a不成立) (3)Cl2+2Fe2+===2Cl-+2Fe3+ (4)该化肥中含有FeSO4和Fe2(SO4)3(或假设b成立)
解析 (1)FeSO4溶液与NaOH溶液反应生成白色沉淀Fe(OH)2,Fe(OH)2易被氧化为Fe(OH)3,所以预期现象是先产生白色沉淀,后逐步变为灰绿色,最后出现红褐色沉淀。(2)向溶液X中加入1滴KSCN溶液,溶液显血红色,说明含有Fe2(SO4)3,则假设a不成立。(3)实验ⅳ说明溶液X中含有Fe2+,且Fe2+被氯水中的氯气氧化为Fe3+。(4)实验ⅲ说明溶液X中含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是该化肥中含有FeSO4和Fe2(SO4)3或假设b成立。
