2025年中考化学二轮专项测试练习---计算题(含答案)
文档属性
| 名称 | 2025年中考化学二轮专项测试练习---计算题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 362.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-05 21:22:18 | ||
图片预览

文档简介
2025年中考化学二轮专项测试---计算题
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.中国紫——硅酸铜钡(BaCuSi2O6)被认为是古代人工制造的化学颜料。下列有关BaCuSi2O6说法正确的是
A.含有三种金属元素 B.硅元素和氧元素的质量比为1∶3
C.钡元素的质量分数最大 D.该物质中Cu的化合价为+1
2.在组成化合物的常见元素中,部分元素有可变化合价。下列纯争物中化合价标注正确的一项是
A. B. C. D.
3.我国化学家侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展做出了杰出贡献。生产过程涉及的主要化学反应如下:
①
②
实验室称取含有氯化钠的纯碱样品12.5g,加入一定溶质质量分数的稀盐酸95g,恰好完全反应,得到氯化钠溶液103.1g。下列分析不正确的是
A.若反应①中得到53.5g氯化铵,它与30g尿素[CO(NH2)2]所含氮元素质量相等
B.若Na2CO3粉末中混有少量的NaHCO3,可用加热的方法除去
C.所得氯化钠溶液中溶质的质量分数为11.3%
D.纯碱样品中碳酸钠的质量分数为84.8%
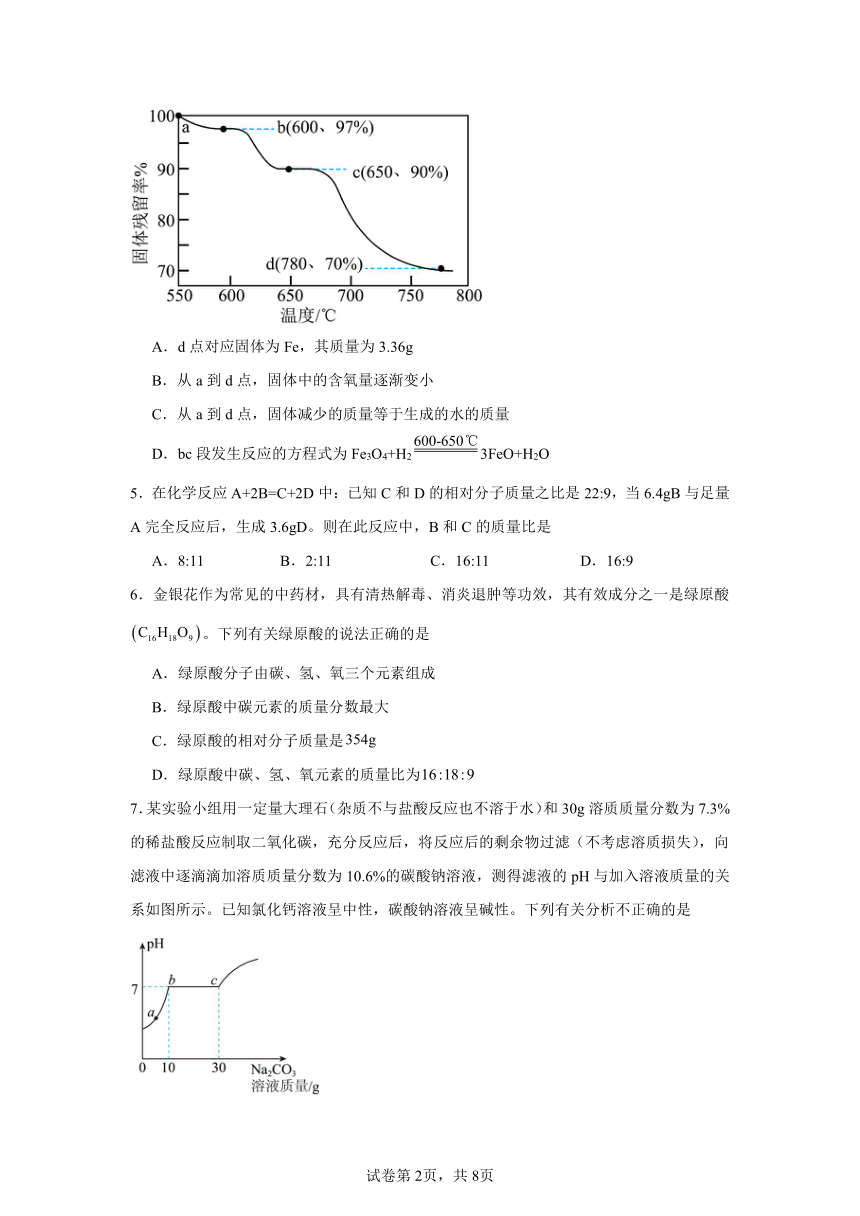
4.CO、H2还原Fe2O3的过程相似,大致分为三个阶段。向4.8gFe2O3中不断通入H2,不断加热,实验测得固体残留率(固体残留率=×100%)随温度的变化曲线如图所示。下列叙述错误的是
A.d点对应固体为Fe,其质量为3.36g
B.从a到d点,固体中的含氧量逐渐变小
C.从a到d点,固体减少的质量等于生成的水的质量
D.bc段发生反应的方程式为Fe3O4+H23FeO+H2O
5.在化学反应A+2B=C+2D中:已知C和D的相对分子质量之比是22:9,当6.4gB与足量A完全反应后,生成3.6gD。则在此反应中,B和C的质量比是
A.8:11 B.2:11 C.16:11 D.16:9
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸。下列有关绿原酸的说法正确的是
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸的相对分子质量是
D.绿原酸中碳、氢、氧元素的质量比为
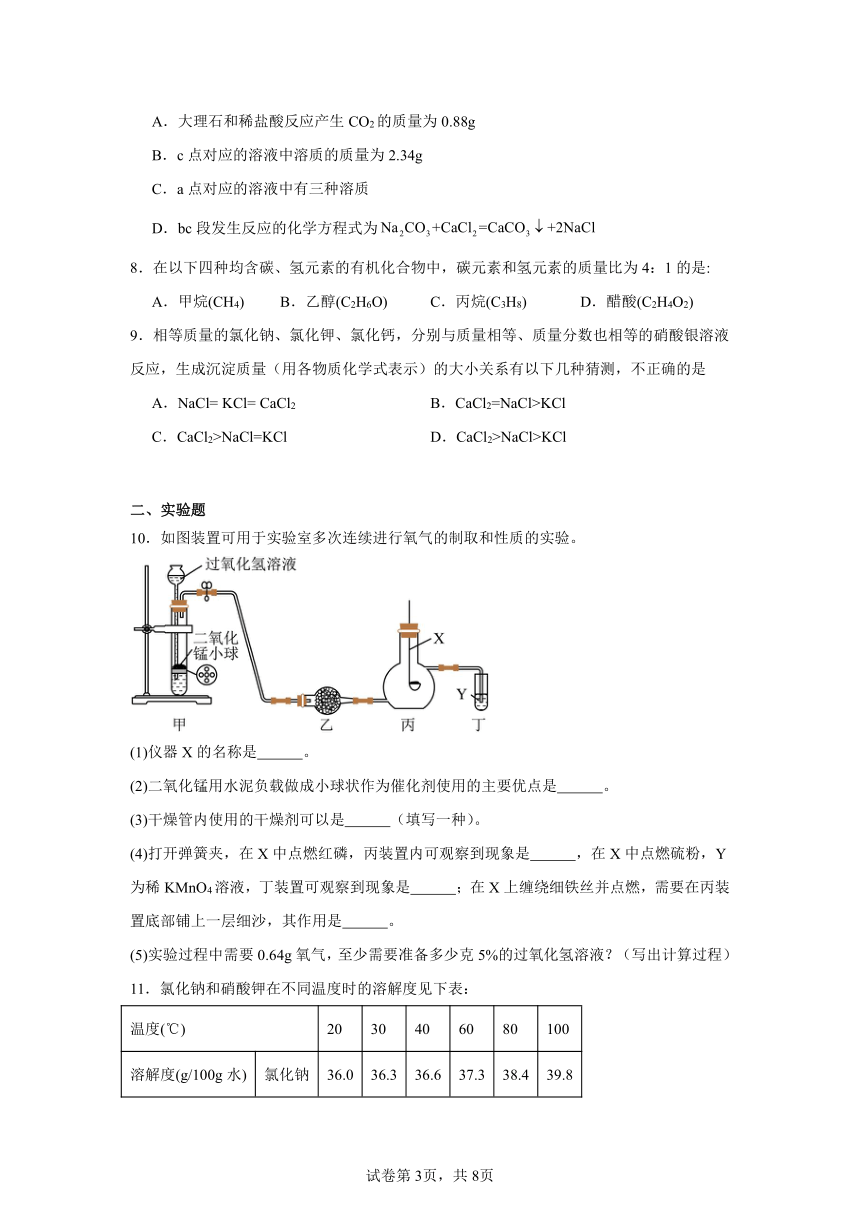
7.某实验小组用一定量大理石(杂质不与盐酸反应也不溶于水)和30g溶质质量分数为7.3%的稀盐酸反应制取二氧化碳,充分反应后,将反应后的剩余物过滤(不考虑溶质损失),向滤液中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,测得滤液的pH与加入溶液质量的关系如图所示。已知氯化钙溶液呈中性,碳酸钠溶液呈碱性。下列有关分析不正确的是
A.大理石和稀盐酸反应产生CO2的质量为0.88g
B.c点对应的溶液中溶质的质量为2.34g
C.a点对应的溶液中有三种溶质
D.bc段发生反应的化学方程式为
8.在以下四种均含碳、氢元素的有机化合物中,碳元素和氢元素的质量比为4:1的是:
A.甲烷(CH4) B.乙醇(C2H6O) C.丙烷(C3H8) D.醋酸(C2H4O2)
9.相等质量的氯化钠、氯化钾、氯化钙,分别与质量相等、质量分数也相等的硝酸银溶液反应,生成沉淀质量(用各物质化学式表示)的大小关系有以下几种猜测,不正确的是
A.NaCl= KCl= CaCl2 B.CaCl2=NaCl>KCl
C.CaCl2>NaCl=KCl D.CaCl2>NaCl>KCl
二、实验题
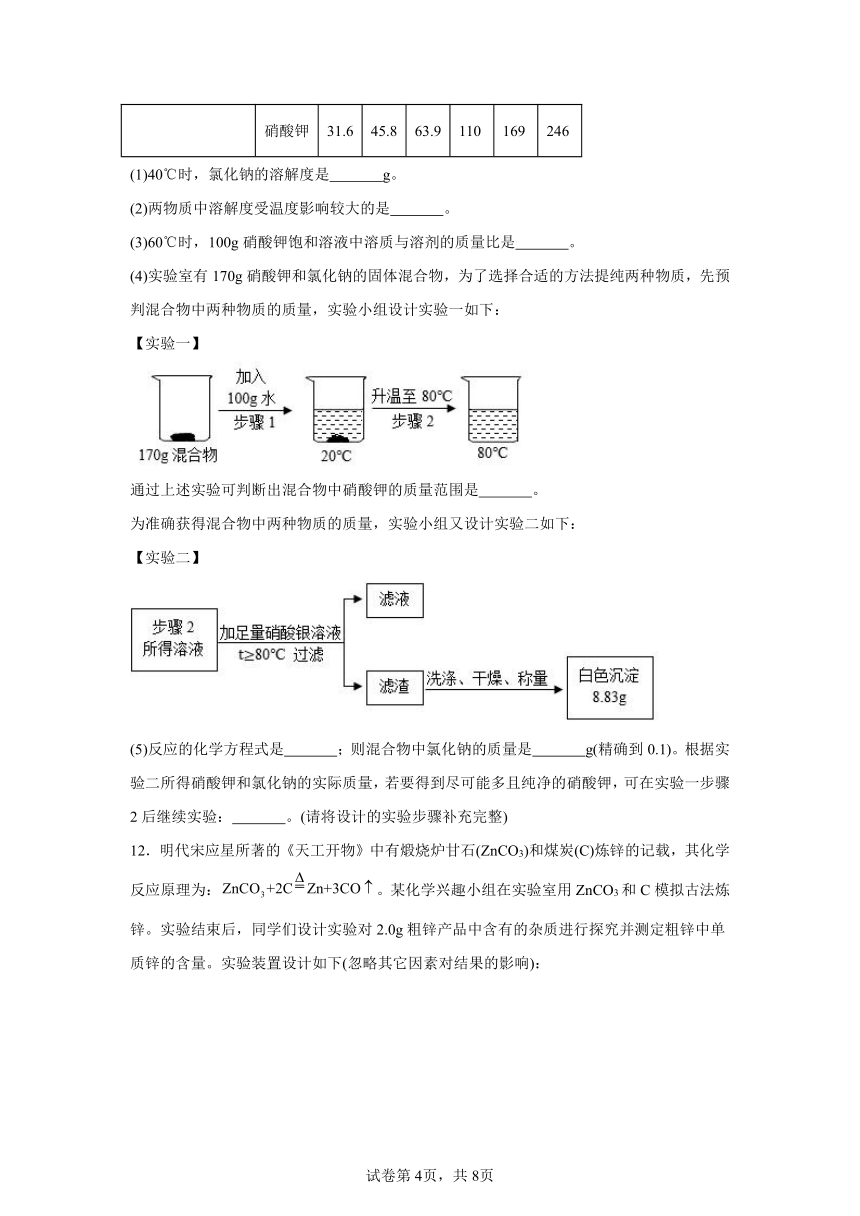
10.如图装置可用于实验室多次连续进行氧气的制取和性质的实验。
(1)仪器X的名称是 。
(2)二氧化锰用水泥负载做成小球状作为催化剂使用的主要优点是 。
(3)干燥管内使用的干燥剂可以是 (填写一种)。
(4)打开弹簧夹,在X中点燃红磷,丙装置内可观察到现象是 ,在X中点燃硫粉,Y为稀KMnO4溶液,丁装置可观察到现象是 ;在X上缠绕细铁丝并点燃,需要在丙装置底部铺上一层细沙,其作用是 。
(5)实验过程中需要0.64g氧气,至少需要准备多少克5%的过氧化氢溶液?(写出计算过程)
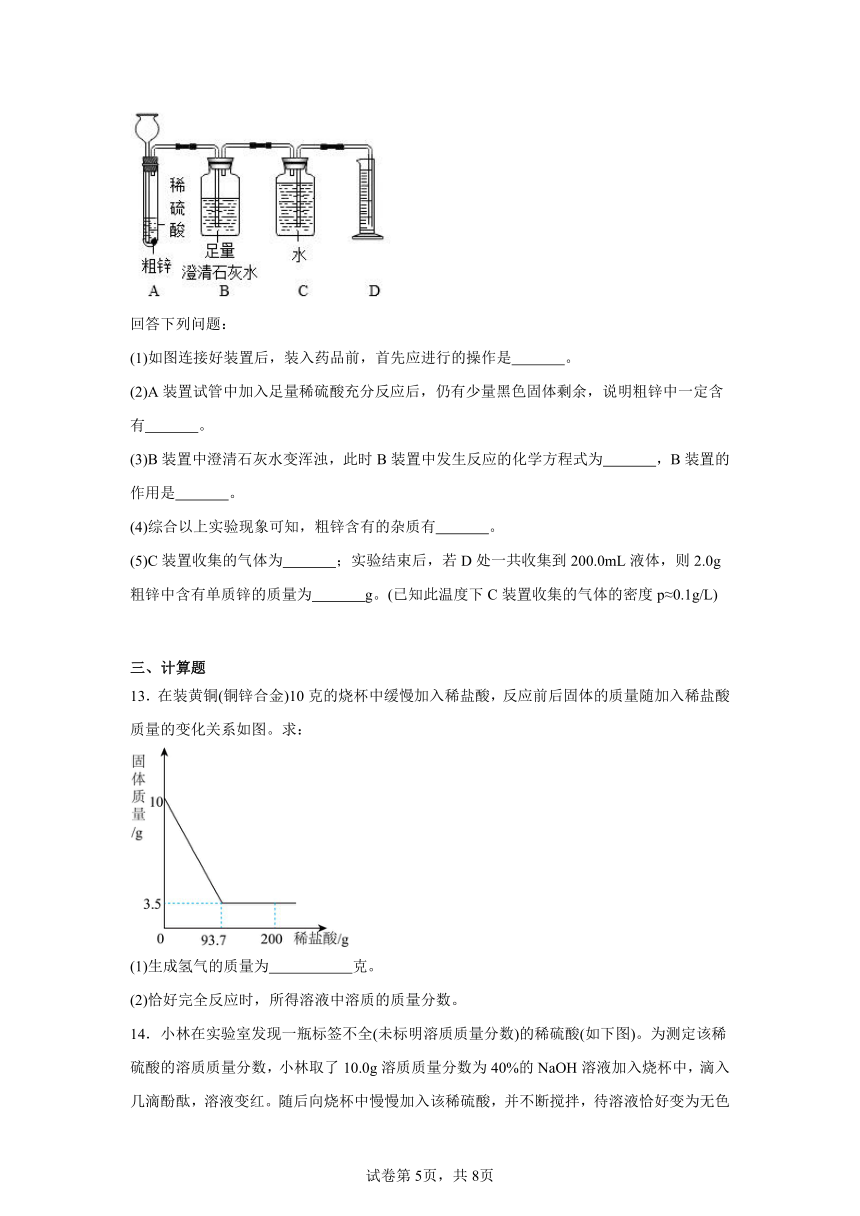
11.氯化钠和硝酸钾在不同温度时的溶解度见下表:
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)40℃时,氯化钠的溶解度是 g。
(2)两物质中溶解度受温度影响较大的是 。
(3)60℃时,100g硝酸钾饱和溶液中溶质与溶剂的质量比是 。
(4)实验室有170g硝酸钾和氯化钠的固体混合物,为了选择合适的方法提纯两种物质,先预判混合物中两种物质的质量,实验小组设计实验一如下:
【实验一】
通过上述实验可判断出混合物中硝酸钾的质量范围是 。
为准确获得混合物中两种物质的质量,实验小组又设计实验二如下:
【实验二】
(5)反应的化学方程式是 ;则混合物中氯化钠的质量是 g(精确到0.1)。根据实验二所得硝酸钾和氯化钠的实际质量,若要得到尽可能多且纯净的硝酸钾,可在实验一步骤2后继续实验: 。(请将设计的实验步骤补充完整)
12.明代宋应星所著的《天工开物》中有煅烧炉甘石(ZnCO3)和煤炭(C)炼锌的记载,其化学反应原理为:。某化学兴趣小组在实验室用ZnCO3和C模拟古法炼锌。实验结束后,同学们设计实验对2.0g粗锌产品中含有的杂质进行探究并测定粗锌中单质锌的含量。实验装置设计如下(忽略其它因素对结果的影响):
回答下列问题:
(1)如图连接好装置后,装入药品前,首先应进行的操作是 。
(2)A装置试管中加入足量稀硫酸充分反应后,仍有少量黑色固体剩余,说明粗锌中一定含有 。
(3)B装置中澄清石灰水变浑浊,此时B装置中发生反应的化学方程式为 ,B装置的作用是 。
(4)综合以上实验现象可知,粗锌含有的杂质有 。
(5)C装置收集的气体为 ;实验结束后,若D处一共收集到200.0mL液体,则2.0g粗锌中含有单质锌的质量为 g。(已知此温度下C装置收集的气体的密度p≈0.1g/L)
三、计算题
13.在装黄铜(铜锌合金)10克的烧杯中缓慢加入稀盐酸,反应前后固体的质量随加入稀盐酸质量的变化关系如图。求:
(1)生成氢气的质量为 克。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
14.小林在实验室发现一瓶标签不全(未标明溶质质量分数)的稀硫酸(如下图)。为测定该稀硫酸的溶质质量分数,小林取了10.0g溶质质量分数为40%的NaOH溶液加入烧杯中,滴入几滴酚酞,溶液变红。随后向烧杯中慢慢加入该稀硫酸,并不断搅拌,待溶液恰好变为无色时,共消耗该稀硫酸24.5g。求:
(1)10.0g质量分数为40%的NaOH溶液中溶质的质量为 g。
(2)求该稀硫酸中溶质的质量分数。(请写出计算过程)
15.氢化钛()作为储氢材料备受关注。用钛粉(Ti)生产的反应为。若制得,计算参加反应的的质量(写出计算过程及结果)。
四、填空与简答
16.2021年5月,“天问一号”搭载祝融号火星车成功着陆火星。
(1)火星车使用的新型镁锂合金属于 (填“金属”或“复合”)材料,实现了探测器的轻量化。
(2)火星车热控材料——纳米气凝胶的主要成分是二氧化硅,化学式为 ,其中硅元素的化合价为 。
(3)火星车集热窗内装有正十一烷(C11H24),此物质属于 (填“无机物”或“有机物”),其中碳、氢元素的质量比为 。
(4)火星车的动力来源于太阳能,人类正在利用和开发的新能源还有 (写一种)。
17.化学在新冠疫情防控中发挥了重要作用,例如防疫关键环节中的灭菌与消毒。
(1)免洗手凝胶消毒剂携带方便,使用时会闻到酒精的气味,说明分子在不停地 。
(2)公共场所佩戴口罩已成为防疫常态。生产医用口罩的过程中常用环氧乙烷(C2H4O)灭菌,环氧乙烷中碳、氢、氧三种元素的质量比为 。
(3)日常消杀也是必需的防疫措施。二氧化氯(C1O2)是一种常用消毒剂,其制取的一种原理是:,则X的化学式为 。
18.在学习溶液相关知识后,某校化学兴趣小组的两位同学在家里配制蔗糖溶液,用于制作冰镇糖水。结合蔗糖的溶解度表,回答下列问题:
温度/℃ 4 20 40 60
溶解度/G 186 204 238 287
(1)40℃时,蔗糖的溶解度为 g。
(2)配制蔗糖溶液的过程中,能够加快蔗糖溶解的方法有 (任写一条)
(3)①20℃时,二人向100g水中加入了100g蔗糖,充分溶解后,所得溶液的质量是 g。
②取少量配好的糖水品尝后,一人认为溶液太甜,另一人认为甜度合适。于是二人取100g糖水,按如图方案(部分流程省略)分别进行冰镇。
下列说法不正确的是 (填字母)。
A、B和C烧杯中溶液的甜度相同
B、C→D的过程中,糖水中蔗糖的质量不变
C、降温至4℃时,B烧杯中可能会有晶体析出
D、降温至4℃时,D烧杯中一定不会有晶体析出
19.金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是(写其中一个化学方程式) 。
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。
①步骤II的操作是
②步骤II中产生的现象是 。步骤I中锌和稀硫酸反应的化学方程式为 。
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用 m和n的代数式表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.C
5.C
6.B
7.B
8.B
9.C
10.(1)燃烧匙
(2)便于实施固液分离
(3)生石灰(合理即可)
(4) 产生大量白烟,放出热量 稀KMnO4溶液褪色 防止高温生成物溅落,炸裂瓶底
(5)解:设至少需要过氧化氢的质量为x。
x=1.36g
则至少需要准备5%的过氧化氢溶液的质量为
答:至少需要准备27.2克5%的过氧化氢溶液。
11.(1)36.6
(2)硝酸钾
(3)11:10
(4)131.6g≤m≤169g
(5) 设混合物中氯化钠的质量为x
答:混合物中氯化钠的质量为3.6g; 蒸发90g水,再降温至20℃,过滤,将所得固体洗涤干燥
12.(1)检查装置气密性
(2)C
(3) 检验是否有二氧化碳生成
(4)ZnCO3和C
(5) 氢气/H2 0.65
13.(1)0.2
(2)解:设反应生成氯化锌的质量为y
y=13.6g
则恰好完全反应时,所得溶液中溶质的质量分数为:
答:恰好完全反应时,所得溶液中溶质的质量分数为13.6%
14.(1)4
(2)解:设该稀硫酸中溶质的质量分数为w
或:设消耗的稀硫酸中溶质的质量为x
该稀硫酸溶质质量分数为
答:该稀硫酸中溶质的质量分数为20%。
15.设:参加反应的的质量为x。
x=4kg;
答:参加反应的的质量为4kg。
16. 金属 SiO2 +4 有机物 11:2 核能
17.(1)运动
(2)6:1:4
(3)NaCl
18.(1)238
(2)升高温度或搅拌
(3) 200 C
19. 光泽好、耐磨、硬度大 (或 ) 过滤 有红色固体析出,溶液由蓝色变无色,有气泡产生 CuO、Cu、Zn.
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.中国紫——硅酸铜钡(BaCuSi2O6)被认为是古代人工制造的化学颜料。下列有关BaCuSi2O6说法正确的是
A.含有三种金属元素 B.硅元素和氧元素的质量比为1∶3
C.钡元素的质量分数最大 D.该物质中Cu的化合价为+1
2.在组成化合物的常见元素中,部分元素有可变化合价。下列纯争物中化合价标注正确的一项是
A. B. C. D.
3.我国化学家侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展做出了杰出贡献。生产过程涉及的主要化学反应如下:
①
②
实验室称取含有氯化钠的纯碱样品12.5g,加入一定溶质质量分数的稀盐酸95g,恰好完全反应,得到氯化钠溶液103.1g。下列分析不正确的是
A.若反应①中得到53.5g氯化铵,它与30g尿素[CO(NH2)2]所含氮元素质量相等
B.若Na2CO3粉末中混有少量的NaHCO3,可用加热的方法除去
C.所得氯化钠溶液中溶质的质量分数为11.3%
D.纯碱样品中碳酸钠的质量分数为84.8%
4.CO、H2还原Fe2O3的过程相似,大致分为三个阶段。向4.8gFe2O3中不断通入H2,不断加热,实验测得固体残留率(固体残留率=×100%)随温度的变化曲线如图所示。下列叙述错误的是
A.d点对应固体为Fe,其质量为3.36g
B.从a到d点,固体中的含氧量逐渐变小
C.从a到d点,固体减少的质量等于生成的水的质量
D.bc段发生反应的方程式为Fe3O4+H23FeO+H2O
5.在化学反应A+2B=C+2D中:已知C和D的相对分子质量之比是22:9,当6.4gB与足量A完全反应后,生成3.6gD。则在此反应中,B和C的质量比是
A.8:11 B.2:11 C.16:11 D.16:9
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸。下列有关绿原酸的说法正确的是
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸的相对分子质量是
D.绿原酸中碳、氢、氧元素的质量比为
7.某实验小组用一定量大理石(杂质不与盐酸反应也不溶于水)和30g溶质质量分数为7.3%的稀盐酸反应制取二氧化碳,充分反应后,将反应后的剩余物过滤(不考虑溶质损失),向滤液中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,测得滤液的pH与加入溶液质量的关系如图所示。已知氯化钙溶液呈中性,碳酸钠溶液呈碱性。下列有关分析不正确的是
A.大理石和稀盐酸反应产生CO2的质量为0.88g
B.c点对应的溶液中溶质的质量为2.34g
C.a点对应的溶液中有三种溶质
D.bc段发生反应的化学方程式为
8.在以下四种均含碳、氢元素的有机化合物中,碳元素和氢元素的质量比为4:1的是:
A.甲烷(CH4) B.乙醇(C2H6O) C.丙烷(C3H8) D.醋酸(C2H4O2)
9.相等质量的氯化钠、氯化钾、氯化钙,分别与质量相等、质量分数也相等的硝酸银溶液反应,生成沉淀质量(用各物质化学式表示)的大小关系有以下几种猜测,不正确的是
A.NaCl= KCl= CaCl2 B.CaCl2=NaCl>KCl
C.CaCl2>NaCl=KCl D.CaCl2>NaCl>KCl
二、实验题
10.如图装置可用于实验室多次连续进行氧气的制取和性质的实验。
(1)仪器X的名称是 。
(2)二氧化锰用水泥负载做成小球状作为催化剂使用的主要优点是 。
(3)干燥管内使用的干燥剂可以是 (填写一种)。
(4)打开弹簧夹,在X中点燃红磷,丙装置内可观察到现象是 ,在X中点燃硫粉,Y为稀KMnO4溶液,丁装置可观察到现象是 ;在X上缠绕细铁丝并点燃,需要在丙装置底部铺上一层细沙,其作用是 。
(5)实验过程中需要0.64g氧气,至少需要准备多少克5%的过氧化氢溶液?(写出计算过程)
11.氯化钠和硝酸钾在不同温度时的溶解度见下表:
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)40℃时,氯化钠的溶解度是 g。
(2)两物质中溶解度受温度影响较大的是 。
(3)60℃时,100g硝酸钾饱和溶液中溶质与溶剂的质量比是 。
(4)实验室有170g硝酸钾和氯化钠的固体混合物,为了选择合适的方法提纯两种物质,先预判混合物中两种物质的质量,实验小组设计实验一如下:
【实验一】
通过上述实验可判断出混合物中硝酸钾的质量范围是 。
为准确获得混合物中两种物质的质量,实验小组又设计实验二如下:
【实验二】
(5)反应的化学方程式是 ;则混合物中氯化钠的质量是 g(精确到0.1)。根据实验二所得硝酸钾和氯化钠的实际质量,若要得到尽可能多且纯净的硝酸钾,可在实验一步骤2后继续实验: 。(请将设计的实验步骤补充完整)
12.明代宋应星所著的《天工开物》中有煅烧炉甘石(ZnCO3)和煤炭(C)炼锌的记载,其化学反应原理为:。某化学兴趣小组在实验室用ZnCO3和C模拟古法炼锌。实验结束后,同学们设计实验对2.0g粗锌产品中含有的杂质进行探究并测定粗锌中单质锌的含量。实验装置设计如下(忽略其它因素对结果的影响):
回答下列问题:
(1)如图连接好装置后,装入药品前,首先应进行的操作是 。
(2)A装置试管中加入足量稀硫酸充分反应后,仍有少量黑色固体剩余,说明粗锌中一定含有 。
(3)B装置中澄清石灰水变浑浊,此时B装置中发生反应的化学方程式为 ,B装置的作用是 。
(4)综合以上实验现象可知,粗锌含有的杂质有 。
(5)C装置收集的气体为 ;实验结束后,若D处一共收集到200.0mL液体,则2.0g粗锌中含有单质锌的质量为 g。(已知此温度下C装置收集的气体的密度p≈0.1g/L)
三、计算题
13.在装黄铜(铜锌合金)10克的烧杯中缓慢加入稀盐酸,反应前后固体的质量随加入稀盐酸质量的变化关系如图。求:
(1)生成氢气的质量为 克。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
14.小林在实验室发现一瓶标签不全(未标明溶质质量分数)的稀硫酸(如下图)。为测定该稀硫酸的溶质质量分数,小林取了10.0g溶质质量分数为40%的NaOH溶液加入烧杯中,滴入几滴酚酞,溶液变红。随后向烧杯中慢慢加入该稀硫酸,并不断搅拌,待溶液恰好变为无色时,共消耗该稀硫酸24.5g。求:
(1)10.0g质量分数为40%的NaOH溶液中溶质的质量为 g。
(2)求该稀硫酸中溶质的质量分数。(请写出计算过程)
15.氢化钛()作为储氢材料备受关注。用钛粉(Ti)生产的反应为。若制得,计算参加反应的的质量(写出计算过程及结果)。
四、填空与简答
16.2021年5月,“天问一号”搭载祝融号火星车成功着陆火星。
(1)火星车使用的新型镁锂合金属于 (填“金属”或“复合”)材料,实现了探测器的轻量化。
(2)火星车热控材料——纳米气凝胶的主要成分是二氧化硅,化学式为 ,其中硅元素的化合价为 。
(3)火星车集热窗内装有正十一烷(C11H24),此物质属于 (填“无机物”或“有机物”),其中碳、氢元素的质量比为 。
(4)火星车的动力来源于太阳能,人类正在利用和开发的新能源还有 (写一种)。
17.化学在新冠疫情防控中发挥了重要作用,例如防疫关键环节中的灭菌与消毒。
(1)免洗手凝胶消毒剂携带方便,使用时会闻到酒精的气味,说明分子在不停地 。
(2)公共场所佩戴口罩已成为防疫常态。生产医用口罩的过程中常用环氧乙烷(C2H4O)灭菌,环氧乙烷中碳、氢、氧三种元素的质量比为 。
(3)日常消杀也是必需的防疫措施。二氧化氯(C1O2)是一种常用消毒剂,其制取的一种原理是:,则X的化学式为 。
18.在学习溶液相关知识后,某校化学兴趣小组的两位同学在家里配制蔗糖溶液,用于制作冰镇糖水。结合蔗糖的溶解度表,回答下列问题:
温度/℃ 4 20 40 60
溶解度/G 186 204 238 287
(1)40℃时,蔗糖的溶解度为 g。
(2)配制蔗糖溶液的过程中,能够加快蔗糖溶解的方法有 (任写一条)
(3)①20℃时,二人向100g水中加入了100g蔗糖,充分溶解后,所得溶液的质量是 g。
②取少量配好的糖水品尝后,一人认为溶液太甜,另一人认为甜度合适。于是二人取100g糖水,按如图方案(部分流程省略)分别进行冰镇。
下列说法不正确的是 (填字母)。
A、B和C烧杯中溶液的甜度相同
B、C→D的过程中,糖水中蔗糖的质量不变
C、降温至4℃时,B烧杯中可能会有晶体析出
D、降温至4℃时,D烧杯中一定不会有晶体析出
19.金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是(写其中一个化学方程式) 。
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。
①步骤II的操作是
②步骤II中产生的现象是 。步骤I中锌和稀硫酸反应的化学方程式为 。
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用 m和n的代数式表示)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.C
4.C
5.C
6.B
7.B
8.B
9.C
10.(1)燃烧匙
(2)便于实施固液分离
(3)生石灰(合理即可)
(4) 产生大量白烟,放出热量 稀KMnO4溶液褪色 防止高温生成物溅落,炸裂瓶底
(5)解:设至少需要过氧化氢的质量为x。
x=1.36g
则至少需要准备5%的过氧化氢溶液的质量为
答:至少需要准备27.2克5%的过氧化氢溶液。
11.(1)36.6
(2)硝酸钾
(3)11:10
(4)131.6g≤m≤169g
(5) 设混合物中氯化钠的质量为x
答:混合物中氯化钠的质量为3.6g; 蒸发90g水,再降温至20℃,过滤,将所得固体洗涤干燥
12.(1)检查装置气密性
(2)C
(3) 检验是否有二氧化碳生成
(4)ZnCO3和C
(5) 氢气/H2 0.65
13.(1)0.2
(2)解:设反应生成氯化锌的质量为y
y=13.6g
则恰好完全反应时,所得溶液中溶质的质量分数为:
答:恰好完全反应时,所得溶液中溶质的质量分数为13.6%
14.(1)4
(2)解:设该稀硫酸中溶质的质量分数为w
或:设消耗的稀硫酸中溶质的质量为x
该稀硫酸溶质质量分数为
答:该稀硫酸中溶质的质量分数为20%。
15.设:参加反应的的质量为x。
x=4kg;
答:参加反应的的质量为4kg。
16. 金属 SiO2 +4 有机物 11:2 核能
17.(1)运动
(2)6:1:4
(3)NaCl
18.(1)238
(2)升高温度或搅拌
(3) 200 C
19. 光泽好、耐磨、硬度大 (或 ) 过滤 有红色固体析出,溶液由蓝色变无色,有气泡产生 CuO、Cu、Zn.
答案第1页,共2页
答案第1页,共2页
同课章节目录
