2025届高三化学一轮复习专项强化训练————活化能(含解析)
文档属性
| 名称 | 2025届高三化学一轮复习专项强化训练————活化能(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-01-06 14:56:57 | ||
图片预览



文档简介
腾冲市2025届高三化学一轮复习专项强化训练
——活化能
1.甲烷在某含催化剂作用下部分反应的能量变化如图所示,下列说法错误的是
B.步骤2逆向反应的
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
2.某温度下,在密闭容器中充入一定
量的,发生下列反应:
,,
测得各气体浓度与反应时间的关系如图所示。
下列反应进程示意图符合题意的是
B.
C.D.
3.催化剂Ⅰ和Ⅱ均能催化反应。
反应历程(下图)中,M为中间产物。其它条件相同时,
下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
4.一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
5.18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为: 能量变化如图所示。已知为快速
平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH- C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
6.碳酸二甲酯是一种低毒、性能优良的有机合成中间体,科学家提出了新的合成方案(吸附在固体催化剂表面上的物种用*标注),反应机理如图所示。
下列说法正确的是
A.反应过程中除固体催化剂外,还使用了做催化剂
B.反应进程中决速步骤的能垒为
C.第3步的基元反应方程式为:
D.升高温度,合成碳酸二甲酯反应速率增加,平衡向逆反应方向移动
7.在石油氧化脱硫工艺中会发生以下气相反应:,反应机理及各物质的相对能量如图所示(COM、IM代表中间体,TS代表过渡态)。下列说法错误的是
A.总反应为放热反应 B.从反应物到生成物存在两条反应路径
C.在涉及TS4和TS5的路径中,决速步骤为
D.在恒温恒压的容器中发生总反应,压缩容器容积,平衡不发生移动
8.已知和经过两种途径转化为的反应如下:途径Ⅰ:①;②;途径Ⅱ:③;④。其反应过程的能量变化如图所示,已知的单位为。
下列说法错误的是
A.途径Ⅰ中反应的
B.途径Ⅱ中转化为的反应速率是由反应③决定的
C.途径Ⅰ和途径Ⅱ总反应的焓变: D.途径Ⅱ过程中,物质很难大量积累
9.三甲胺是重要的化工原料。我国科学家利用(简称)在铜催化作用下转化得到,下图是计算机模拟单个DMF分子在铜催化剂表面的反应历程,如图所示(*表示物质吸附在铜催化剂上),下列说法错误的是
A.该反应为放热反应,降温可提高DMF的平衡转化率
B.该历程包含6个基元反应
C.若DMF完全转化为三甲胺,则会吸收的能量
D.由图可知该反应历程的最大能垒为
10.我国科学家团队设计并合成了纳米催化剂,并研究在催化剂表面电催化合成氨的反应机理如图所示,*表示吸附态。下列说法正确的是
A.催化剂表面吸附时释放能量,解吸时需吸收能量
B.“途径①”速率最慢的步骤为
C.“途径①”中有极性键的断裂与生成
D.在催化剂表面发生反应转化为的过程,“途径①”比“途径②”更易进行
11.热力学规定:在298.15K时,由最稳定单质生成1mol化合物时的焓变,叫做该物质的标准摩尔生成焓;最稳定单质的标准摩尔生成焓规定为零。将等物质的量的和充入真空恒容密闭容器中,在有催化剂的条件下发生反应:。相关物质的标准摩尔生成焓数据如下表所示。我国学者通过计算机模拟进行理论研究,认为在合金或合金催化下,该反应以甲烷逐级脱氢开始反应。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面)。下列说法正确的是
物质
0
A.该反应正向为放热反应
B.容器内气体密度不变时,反应达到平衡状态
C.甲烷逐级脱氢历程中最大能垒(活化能)
D.两种催化剂比较,脱氢反应阶段催化效果更好的是合金
12.已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是
A.1mol A(g)的能量低于1mol B(g)的能量
B.
C.断裂1mol A(g)化学键吸收的热量小于形
成1mol C(g)和3mol D(g)化学键所放出的热量
D.反应过程中,由于,反应②速率大于反应①,气体B很难大量积累
13.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物催化醋酸甲酯羰基化反应制备醋酸的反应机理和各基元反应活化能垒如图所示。其中Cat.表示催化剂,TS和TN分别表示各基元反应的过渡态和产物。下列说法错误的是
A.反应中Ru的成键数目不变
B.该羰基化反应每消耗1mol 生成1mol
C.由生成经历了4个基元反应,其中第四步反应速率最慢
D.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物降低了反应的活化能,但不改变反应的焓变
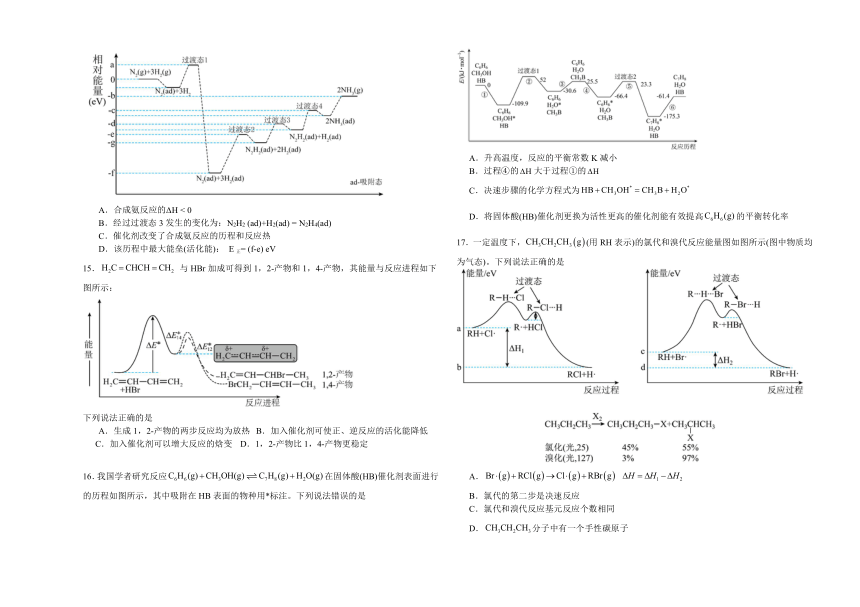
14.合成氨反应为N2 (g)+3H2(g)2NH3(g)。在铁触媒催化剂表面上合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用ad标注。下列说法不正确的是
A.合成氨反应的ΔH < 0
B.经过过渡态3发生的变化为:N2H2 (ad)+H2(ad) = N2H4(ad)
C.催化剂改变了合成氨反应的历程和反应热
D.该历程中最大能垒(活化能): E正= (f-e) eV
15. 与HBr加成可得到1,2-产物和1,4-产物,其能量与反应进程如下图所示:
下列说法正确的是
A.生成1,2-产物的两步反应均为放热 B.加入催化剂可使正、逆反应的活化能降低
C.加入催化剂可以增大反应的焓变 D.1,2-产物比1,4-产物更稳定
16.我国学者研究反应在固体酸(HB)催化剂表面进行的历程如图所示,其中吸附在HB表面的物种用*标注。下列说法错误的是
A.升高温度,反应的平衡常数K减小
B.过程④的大于过程①的
C.决速步骤的化学方程式为
D.将固体酸(HB)催化剂更换为活性更高的催化剂能有效提高的平衡转化率
17.一定温度下,(用RH表示)的氯代和溴代反应能量图如图所示(图中物质均为气态)。下列说法正确的是
A.
B.氯代的第二步是决速反应
C.氯代和溴代反应基元反应个数相同
D.分子中有一个手性碳原子
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C B C C B A C C C B
题号 11 12 13 14 15 16 17
答案 D D B C B D C
1.C
【详解】A.由能量变化图可知,,A项正确;
B.由能量变化图可知,步骤2逆向反应的,B项正确;
C.由能量变化图可知,步骤1的活化能,步骤2的活化能,步骤1的活化能大于步骤2的活化能,步骤1的反应比步骤2慢,C项错误;
D.该过程甲烷转化为甲醇,属于加氧氧化,该过程实现了甲烷的氧化,D项正确;
故选C。
2.B
【分析】由图可知,反应初期随着时间的推移X的浓度逐渐减小、Y和Z的浓度逐渐增大,后来随着时间的推移X和Y的浓度逐渐减小、Z的浓度继续逐渐增大,说明X(g)Y(g)的反应速率大于Y(g)Z(g)的反应速率,则反应X(g)Y(g)的活化能小于反应Y(g)Z(g)的活化能。
【详解】A.X(g)Y(g)和Y(g)Z(g)的 H都小于0,而图像显示Y的能量高于X,即图像显示X(g)Y(g)为吸热反应,A项不符合题意;
B.图像显示X(g)Y(g)和Y(g)Z(g)的 H都小于0,且X(g)Y(g)的活化能小于Y(g)Z(g)的活化能,B项符合题意;
C.图像显示X(g)Y(g)和Y(g)Z(g)的 H都小于0,但图像上X(g)Y(g)的活化能大于Y(g)Z(g)的活化能,C项不符合题意;
D.图像显示X(g)Y(g)和Y(g)Z(g)的 H都大于0,且X(g)Y(g)的活化能大于Y(g)Z(g)的活化能,D项不符合题意;
选B。
3.C
【详解】A.由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
B.由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,R的浓度增大,B正确;
C.由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
D.由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确;
故选C。
4.C
【详解】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.产物I和产物II存在可逆反应,则产物II和产物I的比值即该可逆反应的平衡常数K,由于平衡常数只与温度有关,所以增加HCl浓度平衡时产物II和产物I的比例不变,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
5.B
【详解】A.一般来说,反应的活化能越高,反应速率越慢,由图可知,反应I和反应Ⅳ的活化能较高,因此反应的决速步为反应I、Ⅳ,故A错误;
B.反应I为加成反应,而与为快速平衡,反应Ⅱ的成键和断键方式为或,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B正确;
C.反应Ⅲ的成键和断键方式为或,因此反应结束后溶液中不会存在CH318H,故C错误;
D.该总反应对应反应物的总能量高于生成物总能量,总反应为放热反应,因此和CH3O-的总能量与和OH-的总能量之差等于图示总反应的焓变,故D错误;
综上所述,正确的是B项,故答案为B。
6.A
【详解】A.HO·在反应前参与反应,反应后又生成,作催化剂,A正确;
B.反应进程中经过渡态Ⅰ的反应能垒最大,是决速步骤,其能垒为[103.1-(-22.6)]×102eV=1.257×104eV,B错误;
C.第3步的基元反应方程式为:,C错误;
D.由图可以看出,2CH3OH+CO2→CH3OCOOCH3+H2O △H>0,升高温度,合成碳酸二甲酯反应速率增加,平衡向正反应方向移动,D错误;
故答案为:A。
7.C
【详解】A.由题图可知,反应物相对能量为0,生成物相对能量为-659.2,故总反应为放热反应,故A正确;
B.由题图可知,经历TS1过程后,反应按TS2→TS3→TS6和TS4→TS5→TS6两条路径进行,所以从反应物到生成物存在两条反应路径,故B正确;
C.观察TS1→TS4→TS5→TS6反应路径,活化能最大的步骤出现在TS5处,所以决速步骤为,故C错误;
D.结合总反应方程式,可知反应前后气体分子数不变,所以改变容器容积对该反应的平衡没有影响,故D正确;
答案选C。
【点睛】本题考查反应机理分析,具体考查反应热、反应路径、决速步骤和平衡移动等,意在考查考生接受信息、提取信息、分析信息和运用信息的能力,以及变化观念与平衡思想、证据推理与模型认知的学科核心素养。
8.C
【详解】
A.由图可知,反应的,A正确;
B.由图可知,反应③的活化能大于反应④的活化能,活化能越大反应速率越慢,决速步骤由最慢的步骤决定,故途径Ⅱ中 A(g)转化为 E(g)的反应速率是由反应③决定的,B正确;
C.根据盖斯定律,途径I 和途径Ⅱ总反应的焓变相等,即,C错误;
D.由图可知,途径Ⅱ中反应④的活化能低于反应③的活化能,活化能越低反应速率越快,故反应④的反应速率大于反应③的反应速率,物 质N(g)很难大量积累,D正确;
故选C。
9.C
【详解】A.由图可知,该反应为反应物总能量高于生成物总能量的放热反应,降低温度,平衡向正反应方向移动,DMF的平衡转化率增大,故A正确;
B.有断键或成键的都属于基元反应,由图可知,该历程中每一步都有键断裂或者有键形成,即包含6个基元反应,故B正确;
C.由反应物和生成物的相对能量可知,反应放热为,完全转化为三甲胺,则会释放出的能量,故C错误;
D.由图可知,最大能垒(活化能)为,反应的方程式为,故D正确;
故选C。
10.B
【详解】A.由图可知,途径①催化剂表面N2吸附时释放能量,途径②催化剂表面N2吸附时吸收能量,途径①和途径②NH3解吸时均需吸收能量,故A错误;
B.活化能越高,反应速率越慢,故“途径①”速率最慢的步骤为*NNH+H++e →*NHNH,故B正确;
C.由图可知,“途径①”中有N-H的生成和氮氮三键的断裂,故“途径①”中有极性键的生成与非极性键的断裂,故C错误;
D. N2在催化剂表面发生反应转化为*NH3的过程,途径②活化能低,故“途径②”比“途径①”更易进行,故D错误;
故答案为B。
11.D
【详解】A.由题给数据可知,反应物的标准摩尔生成焓之和为,生成物的标准摩尔生成焓之和为,则该反应为反应物总能量小于生成物总能量的吸热反应,A项错误;
B.该反应在恒容密闭容器中进行,反应中容器体积不变,混合气体的密度始终不变,B项错误;
C.从图中可以看出,正反应的活化能最大的为形成过渡态2的活化能,,C项错误;
D.据图可知使用合金作催化剂时,整个过程中的每一步反应的活化能都较小,反应速率较快,催化效果更好,D项正确;
故答案选D。
12.D
【详解】A.由图可知,1mol A(g)的能量低于1mol B(g)和2molD的能量总和,但不能确定1molA(g)的能量和1mol B(g)的能量大小,故A错误;
B.ΔH=正反应活化能-逆反应活化能,则 ΔH=(Ea3-Ea4) ,故B错误;
C.由图可知1molA的能量小于1molC和3molD的总能量,则该反应是吸热反应,即断裂1mol A(g)化学键吸收的热量大于形成1mol C(g)和3mol D(g)化学键所放出的热量,故C错误;
D.反应的活化能越小,反应速率越快,由于活化能Ea3<Ea1,则反应②消耗B的速率大于反应①生成B的速率,气体B很难大量积累,故D正确;
答案选D。
13.B
【详解】A.由Rh(Ⅰ)-Ru(Ⅲ)双金属配合物催化醋酸甲酯羰基化反应制备醋酸的反应机理图可知,Ru都是与2个Cl和2个I形成4个键,A项正确;
B.由反应机理可知,总反应为CO+H2O+CH3COOCH32CH3COOH,该羰基化反应每消耗1molCH3COOCH3生成2molCH3COOH,B项错误;
C.由各基元反应活化能垒图可知,由CH3I生成CH3OI经历了4个基元反应,其中第四步即产物TN3→Cat.+CH3COI的活化能最大,反应速率最慢,C项正确;
D.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物为催化剂,催化剂可以降低反应的活化能,加快反应速率,但不改变反应的焓变,D项正确;
答案选B。
14.C
【详解】A.由图可知,合成氨反应为反应物总能量大于生成物总能量的放热反应,反应的△H<0,故A项正确;
B.由图可知,经过过渡态3步骤发生的反应为N2H2 (ad)+2H2(ad) = N2H4(ad)+H2(ad),即N2H2(ad)+H2(ad)=N2H4(ad),故B项正确;
C.由图可知,铁触媒催化剂改变了合成氨反应的反应历程,但不能改变反应热,故C项错误;
D.由图可知,该历程中最大能垒(活化能)E正=-eeV-(-feV)=(f-e)eV,故D项正确;
故本题选C。
15.B
【详解】A.由图知生成1,2-产物第一步吸热,第二步放热,A项错误;
B.催化剂可以降低正、逆反应所需能量,增加活化分子百分数,B项正确;
C.加入催化剂反应的焓变不变,C项错误;
D.1,4-产物比1,2-产物能量更低,更稳定,D项错误;
16.D
【详解】A.由图知,为放热反应,升高温度,平衡逆向移动,平衡常数K减小,A正确;
B.由图知,过程④的,过程①的,故过程④的大于过程①的,B正确;
C.由图知,决速步骤为过程②,化学方程式为,C正确;
D.催化剂只能改变反应速率,不能改变平衡转化率,D错误;
故选D。
17.C
【详解】A.由图可知,①RH(g)+Cl(g)=RCl(g)+H(g)H1,②RH(g)+Br(g)=RBr(g)+H(g) H2,②-①可得Br(g)+RCl(g)→Cl(g)+RBr(g) H=ΔH2 ΔH1,A错误;
B.由图可知,氯代第一步反应活化能大于第二步,说明第一步反应速率小于第二步,则氯代的第一步是决速反应,B错误;
C.由图可知,氯代和溴代均分两步完成,氯代和溴代反应基元反应个数相同,C正确;
D.CH3CH2CH3分子中每个碳原子都连有2个或3个相同的H原子,则该分子中没有手性碳原子,D错误;
故选C。
——活化能
1.甲烷在某含催化剂作用下部分反应的能量变化如图所示,下列说法错误的是
B.步骤2逆向反应的
C.步骤1的反应比步骤2快
D.该过程实现了甲烷的氧化
2.某温度下,在密闭容器中充入一定
量的,发生下列反应:
,,
测得各气体浓度与反应时间的关系如图所示。
下列反应进程示意图符合题意的是
B.
C.D.
3.催化剂Ⅰ和Ⅱ均能催化反应。
反应历程(下图)中,M为中间产物。其它条件相同时,
下列说法不正确的是
A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
4.一定条件下,苯基丙炔()可与发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ B.反应活化能:反应I<反应Ⅱ
C.增加浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
5.18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为: 能量变化如图所示。已知为快速
平衡,下列说法正确的是
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH- C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
6.碳酸二甲酯是一种低毒、性能优良的有机合成中间体,科学家提出了新的合成方案(吸附在固体催化剂表面上的物种用*标注),反应机理如图所示。
下列说法正确的是
A.反应过程中除固体催化剂外,还使用了做催化剂
B.反应进程中决速步骤的能垒为
C.第3步的基元反应方程式为:
D.升高温度,合成碳酸二甲酯反应速率增加,平衡向逆反应方向移动
7.在石油氧化脱硫工艺中会发生以下气相反应:,反应机理及各物质的相对能量如图所示(COM、IM代表中间体,TS代表过渡态)。下列说法错误的是
A.总反应为放热反应 B.从反应物到生成物存在两条反应路径
C.在涉及TS4和TS5的路径中,决速步骤为
D.在恒温恒压的容器中发生总反应,压缩容器容积,平衡不发生移动
8.已知和经过两种途径转化为的反应如下:途径Ⅰ:①;②;途径Ⅱ:③;④。其反应过程的能量变化如图所示,已知的单位为。
下列说法错误的是
A.途径Ⅰ中反应的
B.途径Ⅱ中转化为的反应速率是由反应③决定的
C.途径Ⅰ和途径Ⅱ总反应的焓变: D.途径Ⅱ过程中,物质很难大量积累
9.三甲胺是重要的化工原料。我国科学家利用(简称)在铜催化作用下转化得到,下图是计算机模拟单个DMF分子在铜催化剂表面的反应历程,如图所示(*表示物质吸附在铜催化剂上),下列说法错误的是
A.该反应为放热反应,降温可提高DMF的平衡转化率
B.该历程包含6个基元反应
C.若DMF完全转化为三甲胺,则会吸收的能量
D.由图可知该反应历程的最大能垒为
10.我国科学家团队设计并合成了纳米催化剂,并研究在催化剂表面电催化合成氨的反应机理如图所示,*表示吸附态。下列说法正确的是
A.催化剂表面吸附时释放能量,解吸时需吸收能量
B.“途径①”速率最慢的步骤为
C.“途径①”中有极性键的断裂与生成
D.在催化剂表面发生反应转化为的过程,“途径①”比“途径②”更易进行
11.热力学规定:在298.15K时,由最稳定单质生成1mol化合物时的焓变,叫做该物质的标准摩尔生成焓;最稳定单质的标准摩尔生成焓规定为零。将等物质的量的和充入真空恒容密闭容器中,在有催化剂的条件下发生反应:。相关物质的标准摩尔生成焓数据如下表所示。我国学者通过计算机模拟进行理论研究,认为在合金或合金催化下,该反应以甲烷逐级脱氢开始反应。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面)。下列说法正确的是
物质
0
A.该反应正向为放热反应
B.容器内气体密度不变时,反应达到平衡状态
C.甲烷逐级脱氢历程中最大能垒(活化能)
D.两种催化剂比较,脱氢反应阶段催化效果更好的是合金
12.已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是
A.1mol A(g)的能量低于1mol B(g)的能量
B.
C.断裂1mol A(g)化学键吸收的热量小于形
成1mol C(g)和3mol D(g)化学键所放出的热量
D.反应过程中,由于,反应②速率大于反应①,气体B很难大量积累
13.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物催化醋酸甲酯羰基化反应制备醋酸的反应机理和各基元反应活化能垒如图所示。其中Cat.表示催化剂,TS和TN分别表示各基元反应的过渡态和产物。下列说法错误的是
A.反应中Ru的成键数目不变
B.该羰基化反应每消耗1mol 生成1mol
C.由生成经历了4个基元反应,其中第四步反应速率最慢
D.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物降低了反应的活化能,但不改变反应的焓变
14.合成氨反应为N2 (g)+3H2(g)2NH3(g)。在铁触媒催化剂表面上合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用ad标注。下列说法不正确的是
A.合成氨反应的ΔH < 0
B.经过过渡态3发生的变化为:N2H2 (ad)+H2(ad) = N2H4(ad)
C.催化剂改变了合成氨反应的历程和反应热
D.该历程中最大能垒(活化能): E正= (f-e) eV
15. 与HBr加成可得到1,2-产物和1,4-产物,其能量与反应进程如下图所示:
下列说法正确的是
A.生成1,2-产物的两步反应均为放热 B.加入催化剂可使正、逆反应的活化能降低
C.加入催化剂可以增大反应的焓变 D.1,2-产物比1,4-产物更稳定
16.我国学者研究反应在固体酸(HB)催化剂表面进行的历程如图所示,其中吸附在HB表面的物种用*标注。下列说法错误的是
A.升高温度,反应的平衡常数K减小
B.过程④的大于过程①的
C.决速步骤的化学方程式为
D.将固体酸(HB)催化剂更换为活性更高的催化剂能有效提高的平衡转化率
17.一定温度下,(用RH表示)的氯代和溴代反应能量图如图所示(图中物质均为气态)。下列说法正确的是
A.
B.氯代的第二步是决速反应
C.氯代和溴代反应基元反应个数相同
D.分子中有一个手性碳原子
参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 C B C C B A C C C B
题号 11 12 13 14 15 16 17
答案 D D B C B D C
1.C
【详解】A.由能量变化图可知,,A项正确;
B.由能量变化图可知,步骤2逆向反应的,B项正确;
C.由能量变化图可知,步骤1的活化能,步骤2的活化能,步骤1的活化能大于步骤2的活化能,步骤1的反应比步骤2慢,C项错误;
D.该过程甲烷转化为甲醇,属于加氧氧化,该过程实现了甲烷的氧化,D项正确;
故选C。
2.B
【分析】由图可知,反应初期随着时间的推移X的浓度逐渐减小、Y和Z的浓度逐渐增大,后来随着时间的推移X和Y的浓度逐渐减小、Z的浓度继续逐渐增大,说明X(g)Y(g)的反应速率大于Y(g)Z(g)的反应速率,则反应X(g)Y(g)的活化能小于反应Y(g)Z(g)的活化能。
【详解】A.X(g)Y(g)和Y(g)Z(g)的 H都小于0,而图像显示Y的能量高于X,即图像显示X(g)Y(g)为吸热反应,A项不符合题意;
B.图像显示X(g)Y(g)和Y(g)Z(g)的 H都小于0,且X(g)Y(g)的活化能小于Y(g)Z(g)的活化能,B项符合题意;
C.图像显示X(g)Y(g)和Y(g)Z(g)的 H都小于0,但图像上X(g)Y(g)的活化能大于Y(g)Z(g)的活化能,C项不符合题意;
D.图像显示X(g)Y(g)和Y(g)Z(g)的 H都大于0,且X(g)Y(g)的活化能大于Y(g)Z(g)的活化能,D项不符合题意;
选B。
3.C
【详解】A.由图可知两种催化剂均出现四个波峰,所以使用Ⅰ和Ⅱ,反应历程都分4步进行,A正确;
B.由图可知该反应是放热反应,所以达平衡时,升高温度平衡向左移动,R的浓度增大,B正确;
C.由图可知Ⅰ的最高活化能小于Ⅱ的最高活化能,所以使用Ⅰ时反应速率更快,反应体系更快达到平衡,C错误;
D.由图可知在前两个历程中使用Ⅰ活化能较低反应速率较快,后两个历程中使用Ⅰ活化能较高反应速率较慢,所以使用Ⅰ时,反应过程中M所能达到的最高浓度更大,D正确;
故选C。
4.C
【详解】A.反应I、Ⅲ为放热反应,相同物质的量的反应物,反应I放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应I>反应Ⅱ,故A正确;
B.短时间里反应I得到的产物比反应Ⅱ得到的产物多,说明反应I的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应I<反应Ⅱ,故B正确;
C.产物I和产物II存在可逆反应,则产物II和产物I的比值即该可逆反应的平衡常数K,由于平衡常数只与温度有关,所以增加HCl浓度平衡时产物II和产物I的比例不变,故C错误;
D.根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,故D正确。
综上所述,答案为C。
5.B
【详解】A.一般来说,反应的活化能越高,反应速率越慢,由图可知,反应I和反应Ⅳ的活化能较高,因此反应的决速步为反应I、Ⅳ,故A错误;
B.反应I为加成反应,而与为快速平衡,反应Ⅱ的成键和断键方式为或,后者能生成18OH-,因此反应结束后,溶液中存在18OH-,故B正确;
C.反应Ⅲ的成键和断键方式为或,因此反应结束后溶液中不会存在CH318H,故C错误;
D.该总反应对应反应物的总能量高于生成物总能量,总反应为放热反应,因此和CH3O-的总能量与和OH-的总能量之差等于图示总反应的焓变,故D错误;
综上所述,正确的是B项,故答案为B。
6.A
【详解】A.HO·在反应前参与反应,反应后又生成,作催化剂,A正确;
B.反应进程中经过渡态Ⅰ的反应能垒最大,是决速步骤,其能垒为[103.1-(-22.6)]×102eV=1.257×104eV,B错误;
C.第3步的基元反应方程式为:,C错误;
D.由图可以看出,2CH3OH+CO2→CH3OCOOCH3+H2O △H>0,升高温度,合成碳酸二甲酯反应速率增加,平衡向正反应方向移动,D错误;
故答案为:A。
7.C
【详解】A.由题图可知,反应物相对能量为0,生成物相对能量为-659.2,故总反应为放热反应,故A正确;
B.由题图可知,经历TS1过程后,反应按TS2→TS3→TS6和TS4→TS5→TS6两条路径进行,所以从反应物到生成物存在两条反应路径,故B正确;
C.观察TS1→TS4→TS5→TS6反应路径,活化能最大的步骤出现在TS5处,所以决速步骤为,故C错误;
D.结合总反应方程式,可知反应前后气体分子数不变,所以改变容器容积对该反应的平衡没有影响,故D正确;
答案选C。
【点睛】本题考查反应机理分析,具体考查反应热、反应路径、决速步骤和平衡移动等,意在考查考生接受信息、提取信息、分析信息和运用信息的能力,以及变化观念与平衡思想、证据推理与模型认知的学科核心素养。
8.C
【详解】
A.由图可知,反应的,A正确;
B.由图可知,反应③的活化能大于反应④的活化能,活化能越大反应速率越慢,决速步骤由最慢的步骤决定,故途径Ⅱ中 A(g)转化为 E(g)的反应速率是由反应③决定的,B正确;
C.根据盖斯定律,途径I 和途径Ⅱ总反应的焓变相等,即,C错误;
D.由图可知,途径Ⅱ中反应④的活化能低于反应③的活化能,活化能越低反应速率越快,故反应④的反应速率大于反应③的反应速率,物 质N(g)很难大量积累,D正确;
故选C。
9.C
【详解】A.由图可知,该反应为反应物总能量高于生成物总能量的放热反应,降低温度,平衡向正反应方向移动,DMF的平衡转化率增大,故A正确;
B.有断键或成键的都属于基元反应,由图可知,该历程中每一步都有键断裂或者有键形成,即包含6个基元反应,故B正确;
C.由反应物和生成物的相对能量可知,反应放热为,完全转化为三甲胺,则会释放出的能量,故C错误;
D.由图可知,最大能垒(活化能)为,反应的方程式为,故D正确;
故选C。
10.B
【详解】A.由图可知,途径①催化剂表面N2吸附时释放能量,途径②催化剂表面N2吸附时吸收能量,途径①和途径②NH3解吸时均需吸收能量,故A错误;
B.活化能越高,反应速率越慢,故“途径①”速率最慢的步骤为*NNH+H++e →*NHNH,故B正确;
C.由图可知,“途径①”中有N-H的生成和氮氮三键的断裂,故“途径①”中有极性键的生成与非极性键的断裂,故C错误;
D. N2在催化剂表面发生反应转化为*NH3的过程,途径②活化能低,故“途径②”比“途径①”更易进行,故D错误;
故答案为B。
11.D
【详解】A.由题给数据可知,反应物的标准摩尔生成焓之和为,生成物的标准摩尔生成焓之和为,则该反应为反应物总能量小于生成物总能量的吸热反应,A项错误;
B.该反应在恒容密闭容器中进行,反应中容器体积不变,混合气体的密度始终不变,B项错误;
C.从图中可以看出,正反应的活化能最大的为形成过渡态2的活化能,,C项错误;
D.据图可知使用合金作催化剂时,整个过程中的每一步反应的活化能都较小,反应速率较快,催化效果更好,D项正确;
故答案选D。
12.D
【详解】A.由图可知,1mol A(g)的能量低于1mol B(g)和2molD的能量总和,但不能确定1molA(g)的能量和1mol B(g)的能量大小,故A错误;
B.ΔH=正反应活化能-逆反应活化能,则 ΔH=(Ea3-Ea4) ,故B错误;
C.由图可知1molA的能量小于1molC和3molD的总能量,则该反应是吸热反应,即断裂1mol A(g)化学键吸收的热量大于形成1mol C(g)和3mol D(g)化学键所放出的热量,故C错误;
D.反应的活化能越小,反应速率越快,由于活化能Ea3<Ea1,则反应②消耗B的速率大于反应①生成B的速率,气体B很难大量积累,故D正确;
答案选D。
13.B
【详解】A.由Rh(Ⅰ)-Ru(Ⅲ)双金属配合物催化醋酸甲酯羰基化反应制备醋酸的反应机理图可知,Ru都是与2个Cl和2个I形成4个键,A项正确;
B.由反应机理可知,总反应为CO+H2O+CH3COOCH32CH3COOH,该羰基化反应每消耗1molCH3COOCH3生成2molCH3COOH,B项错误;
C.由各基元反应活化能垒图可知,由CH3I生成CH3OI经历了4个基元反应,其中第四步即产物TN3→Cat.+CH3COI的活化能最大,反应速率最慢,C项正确;
D.Rh(Ⅰ)-Ru(Ⅲ)双金属配合物为催化剂,催化剂可以降低反应的活化能,加快反应速率,但不改变反应的焓变,D项正确;
答案选B。
14.C
【详解】A.由图可知,合成氨反应为反应物总能量大于生成物总能量的放热反应,反应的△H<0,故A项正确;
B.由图可知,经过过渡态3步骤发生的反应为N2H2 (ad)+2H2(ad) = N2H4(ad)+H2(ad),即N2H2(ad)+H2(ad)=N2H4(ad),故B项正确;
C.由图可知,铁触媒催化剂改变了合成氨反应的反应历程,但不能改变反应热,故C项错误;
D.由图可知,该历程中最大能垒(活化能)E正=-eeV-(-feV)=(f-e)eV,故D项正确;
故本题选C。
15.B
【详解】A.由图知生成1,2-产物第一步吸热,第二步放热,A项错误;
B.催化剂可以降低正、逆反应所需能量,增加活化分子百分数,B项正确;
C.加入催化剂反应的焓变不变,C项错误;
D.1,4-产物比1,2-产物能量更低,更稳定,D项错误;
16.D
【详解】A.由图知,为放热反应,升高温度,平衡逆向移动,平衡常数K减小,A正确;
B.由图知,过程④的,过程①的,故过程④的大于过程①的,B正确;
C.由图知,决速步骤为过程②,化学方程式为,C正确;
D.催化剂只能改变反应速率,不能改变平衡转化率,D错误;
故选D。
17.C
【详解】A.由图可知,①RH(g)+Cl(g)=RCl(g)+H(g)H1,②RH(g)+Br(g)=RBr(g)+H(g) H2,②-①可得Br(g)+RCl(g)→Cl(g)+RBr(g) H=ΔH2 ΔH1,A错误;
B.由图可知,氯代第一步反应活化能大于第二步,说明第一步反应速率小于第二步,则氯代的第一步是决速反应,B错误;
C.由图可知,氯代和溴代均分两步完成,氯代和溴代反应基元反应个数相同,C正确;
D.CH3CH2CH3分子中每个碳原子都连有2个或3个相同的H原子,则该分子中没有手性碳原子,D错误;
故选C。
同课章节目录
